全乙酰化表没食子儿茶素没食子酸酯的合成纯化及生物活性研究进展
2022-10-28刘苗苗黄峻榕曹云刚
刘苗苗,潘 越,范 鑫,黄峻榕,曹云刚
(陕西科技大学食品科学与工程学院,陕西 西安 710021)
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是未发酵茶叶中的主要活性成分,约占茶叶中儿茶素总量的50%~80%。诸多研究证实,EGCG富含酚羟基结构,具有抗氧化、抗紫外线、抑菌、抗动脉粥样硬化、降血糖血脂、抗癌等广泛的生物活性。但EGCG的多羟基结构使其存在化学性质不稳定、极易氧化变质、脂溶性差、生物利用度低等问题,且其在体内易发生生物转化或者被肠道菌群降解,因而限制了EGCG的深度开发利用。
结构修饰是改善EGCG理化特性的有效手段,其中乙酰化修饰是近来备受关注的修饰方法之一。研究表明,EGCG经小分子乙酰基(CH—CO—或Ac—)酯化后,脂溶性、稳定性及生物利用度均得到改善;同时相比其他修饰基团,乙酰基空间位阴效应较小,不会影响周围酚羟基参与反应,因而生物活性得以有效发挥。全乙酰化表没食子儿茶素没食子酸酯(total acetylated epigallocatechin gallate,AcEGCG)是在EGCG的8 个芳环氧原子上均引入乙酰基而形成的酯类化合物。由于EGCG的酚羟基最大程度地受到乙酰基的保护,因而AcEGCG的脂溶性和稳定性显著提高,其生物利用度更高,且在细胞内有效成分的浓度和半衰期也相对较高和较长。就生物活性而言,AcEGCG的抗紫外线、抗癌以及细胞损伤修复等功能均优于EGCG。因此,AcEGCG在保健食品、抗癌药物、化妆品等方面较EGCG更具应用潜力和开发前景。目前,AcEGCG的来源主要依靠化学手段合成,但受到工艺、成本及安全性多因素的制约,尚无较为成熟、绿色的制备方法。AcEGCG的生物活性已得到广泛证实,进一步探究和明确其内在作用机制对于AcEGCG的科学应用至关重要。本文调研了大量文献,对现有AcEGCG的合成纯化方法进行综述,论述其优势和不足;同时介绍AcEGCG的理化性质以及抗紫外线、细胞损伤修复、抗炎症、抗癌等生物活性的研究进展,并对今后AcEGCG的研究及开发利用提出建议,以期为相关研究提供参考。
1 AcEGCG的合成纯化
1.1 AcEGCG的合成纯化机理
EGCG分子结构中有多个反应活性基团和活性部位,其中酚羟基是最具特征性的活性基团。乙酰化反应是在EGCG芳环酚羟基的氧原子上引入乙酰基,即羟基氢原子被酰基所取代而生成酯类化合物的过程,因此也称为酯化反应,属于-酰基化。该反应通常以乙酸酐((CHCO)O)为酰化试剂,反应时必须加入路易斯酸或者质子酸等催化剂以增强酰化试剂的亲电能力,使反应得以顺利进行。通过控制反应物浓度比、催化剂、反应溶剂、反应时间等反应条件可以调控EGCG乙酰化程度。当EGCG芳环的8 个酚羟基被完全酰基化后,即可生成AcEGCG。目前,AcEGCG的合成主要利用化学合成法,酶法合成尚处于部分乙酰化阶段。
化学合成AcEGCG的反应体系中常包含吡啶、乙酸酐以及目标产物AcEGCG等物质,其组成复杂,因而需要经过系列纯化步骤(图1)。在纯化过程中,通常需要依次使用水、碳酸钠/碳酸氢钠溶液、饱和氯化钠溶液、无水硫酸钠等试剂。水可以终止反应,因为酸酐遇水生成对应的酸,且水也可以洗去催化剂吡啶。碳酸钠/碳酸氢钠溶液的主要目的是中和反应液中的酸类物质;饱和氯化钠溶液可以吸收反应液中的水,使有机层澄明;无水硫酸钠可吸收溶液中多余的水分,再经浓缩、干燥得到初产物。初产物经柱层析纯化后,即可得到纯度较高的AcEGCG。
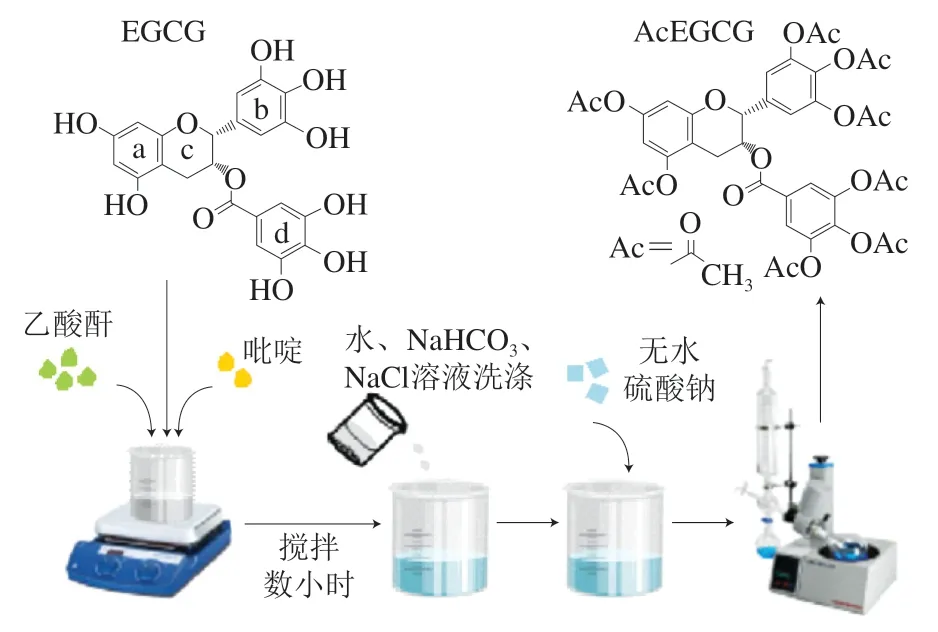
图1 化学合成法制备AcEGCG的主要过程[8,13-14]Fig. 1 Preparation of AcEGCG by chemical synthesis method[8,13-14]
1.2 化学合成法
AcEGCG的合成主要采用化学合成法,现有研究大多利用乙酸酐为EGCG的酰化试剂,在吡啶催化下直接合成(图1)。Kohri等于2001年报道了利用吡啶和乙酸酐合成AcEGCG的具体方法:向1 g EGCG(2.18 mmol)中加入14 mL吡啶和16 mL乙酸酐(157 mmol),45 ℃搅拌反应20 h。反应液经预冷、搅拌、静置、抽滤后得到白色沉淀,再经洗涤、减压干燥、硅胶柱层析后,获得1.7 g AcEGCG(2.14 mmol),产物得率为98%。经高效液相色谱(high performance liquid chromatography,HPLC)检测,样品纯度为99%。Lam等在此基础上,以吡啶为催化剂,将EGCG和乙酸酐在室温下搅拌过夜后得到AcEGCG,产物得率为82%。随后Utenova等以N为保护剂,以30 mL二氯乙烷作为溶剂,向70 mg EGCG(0.15 mmol)中加入186 mg,-二甲氨基吡啶(1.52 mmol)和0.14 mL乙酸酐(1.52 mmol),于0 ℃和室温下分别搅拌1 h和4 h。反应液经50 mL三氯甲烷稀释后,用30 mL硫酸铜洗涤4 次,30 mL饱和碳酸氢钠溶洗涤2 次,浓盐水洗涤1 次。经无水硫酸镁干燥后减压蒸干,最后使用HPLC进行纯化,共得到66 mg产物,产物得率为55%。
近年来,国内学者也对AcEGCG的化学合成方法进行了系统研究,酸酐用量、催化剂用量、反应时间、反应温度等对AcEGCG的合成和纯度均具有重要影响。刘晓辉在乙酸乙酯溶液(200 mL)中依次加入0.920 g质量分数98% ECCG、20 mL乙酸酐和2 mL吡啶,室温下300 r/min搅拌反应5 h,经稀酸、饱和碳酸氢钠溶液洗涤后,产物纯度为89.53%,经柱层析再纯化后,得到纯度为96.04%的AcEGCG。王金妮等在500 mL乙酸乙酯中加入3.7 g EGCG、20 mL乙酸酐、20 mL吡啶,于30 ℃下反应12 h,经体积分数0.5% HCl溶液、质量分数4%碳酸氢钠溶液及蒸馏水洗涤,减压蒸干溶剂后得到AcEGCG产物,经HPLC检测其纯度为99%。叶敏通过研究发现合成AcEGCG的最适条件:184 mg EGCG溶于20 mL乙酸乙酯,酸酐用量是EGCG物质的量的80 倍,催化剂用量为100 μL,反应时间为5 h。反应液经水、0.5 mol/L碳酸钠溶液、饱和氯化钠溶液反复洗涤,无水硫酸钠过滤,真空浓缩及干燥处理后,得到AcEGCG。该条件下AcEGCG纯度为98.42%。张建勇等也发现乙酸酐用量0.4~0.8 mL、吡啶用量0.1~0.2 mL、乙酸乙酯用量5~10 mL、反应温度25~40 ℃、反应时间5~9 h的条件有利于取代度7~8的乙酰化EGCG生成。
除以EGCG为反应底物与酸酐反应直接合成AcEGCG外,也可利用EGCG结构类似物来间接合成AcEGCG。Kuhn等以全苄基化保护的表没食子儿茶素为原料,通过加入二氯甲烷、甲基化没食子酰氯、二甲氨基吡啶、氢氧化铅、甲醇、四氢呋喃、乙酸酐、吡啶等系列试剂,经过3 步反应后最终生成AcEGCG。
相比直接合成法,间接合成AcEGCG所用化学试剂较多,步骤繁琐,不适宜工业化应用。直接化学合成AcEGCG的体系相对简单,但也存在一定问题。直接化学合成法的合成路线较为单一、反应耗时长,且酰化位点不明确,导致反应所得到的产物多为不同酰化程度的EGCG衍生物的混合物,副产物较多,对产物的纯化等后期处理要求较高;另外,酰化所用的吡啶等有毒化学试剂也给AcEGCG在食品和药品领域的应用带来不利影响。因此,探究AcEGCG的可控、定向、绿色的合成方法及酰化规律是具有潜力的研究方向。
1.3 酶法合成法
EGCG的酶法乙酰化修饰通常采用脂肪酶。朱松确立了以乙烯酯作为酰基供体的AcEGCG酶法合成路线,最优反应条件如下:脂肪酶RM IM的添加量为2.1%(以底物质量计),反应溶剂体系为乙腈和异丙醇(质量比1∶1),EGCG与乙酸乙烯酯物质的量比为1∶1,40 ℃反应12 h。在该条件下,EGCG乙酰化转化率为90.32%。经高速逆流色谱纯化,液相色谱-质谱联用鉴定,乙酰化EGCG的反应产物为单-(5’’--乙酰基EGCG)、二-(3’,5’-2--乙酰基EGCG)和三-(5’,3’,5’-3--乙酰基-EGCG)取代乙酰化EGCG的混合物(图2)。可见,目前利用脂肪酶进行EGCG乙酰化仅能得到部分乙酰化产物,鲜见利用酶法制备得到AcEGCG的研究报道。同时,酶法分子修饰EGCG的成本较高,产物的转化率不高,后期分离纯化困难,且对于酰化位点的确定也无规律性的结论。因此,酶法合成AcEGCG尚需系统深入研究。
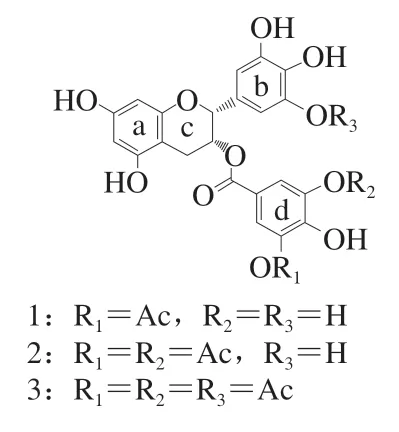
图2 EGCG酶法乙酰化产物[19]Fig. 2 Enzymatic acetylation products of EGCG[19]
2 AcEGCG的理化性质
2.1 基本理化性质
固体AcEGCG为白色粉末状物质。相比EGCG,AcEGCG的水溶性降低,几乎不溶于水,油-水分配系数增大,脂溶性增强,易溶于有机溶剂,但溶解度与溶剂极性并不完全一致,由高到低为甲醚>二乙氧基乙醇>丙氧基乙醇>丁氧基乙醇>乙醇>丙醇>仲丁醇>甲醇>异丙醇>正丁醇>正戊醇>正己醇。在生物活性分析研究中,AcEGCG的常用溶剂为聚乙二醇300/乙醇/吐温-80/水(2∶1∶0.98∶0.02,/)、二甲基亚砜/氢化蓖麻油/乙醇(60∶20∶20,/)等。另外,AcEGCG的光谱吸收特性较EGCG也发生显著变化。紫外光谱全波长扫描结果显示,EGCG在210 nm和280 nm波长处有较大吸收,而AcEGCG的最大吸收波长为250 nm。
2.2 稳定性
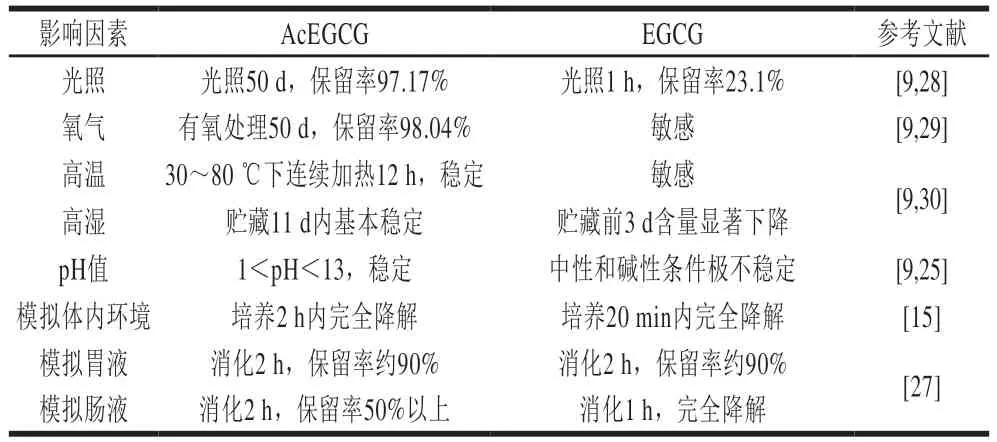
表1 AcEGCG和EGCG的稳定性Table 1 Stability of AcEGCG and EGCG
在模拟人体环境的培养基质(pH 8、温度37 ℃)中,EGCG在20 min内很快降解消失,而AcEGCG在2 h内才完全降解,稳定性较EGCG提高约5 倍。在人工模拟胃液中,AcEGCG和EGCG均能保持一定的稳定性,处理2 h后二者的降解率均维持在10%左右;在人工模拟肠液中,EGCG则迅速发生变化,处理1 h后在设定的HPLC检测条件下几乎检测不到,而AcEGCG在处理2 h后,剩余含量仍在50%以上。相比EGCG,AcEGCG的稳定性明显提高,可抵抗光照、温度、pH值、氧气等体外环境以及体内肠道环境的破坏作用,从而有利于机体吸收。
2.3 生物利用度
“利平斯基规则”指出,一个化合物违背以下任意两条就很难被生物体吸收:相对分子质量在500以下;油-水分配系数小于5;氢键供体不超过5 个;氢键受体不超过10 个。EGCG分子结构中含氢键供体8 个,氢键受体11 个,且其极性分子表面区域较大,因而很难被生物体吸收利用。Nakagawa等研究证实,EGCG的生物利用度极低,小鼠口服EGCG 56 mg 30 min、人口服EGCG 97 mg 1 h后,吸收率仅分别为0.012%和0.32%。除分子结构原因导致的生物利用度低外,EGCG在体内(如肝脏、结肠等)还会受到葡萄糖醛酸化、甲基化和硫酸化以及微生物降解等作用,进一步导致有效含量的降低。Lu Hong等发现,在人尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate-glucuronosyltransferase,UDPGT或UGT)作用下,EGCG在体内可转化为EGCG-4’--葡糖苷酸、EGCG-3’--葡糖苷酸、EGCG-7--葡糖苷酸等物质;且3 种人UGT同工酶(UGT 1A1、1A8、1A9)的催化活性均较高。陈欣发现,EGCG在肠道菌群作用下含量迅速下降,代谢转化为没食子酸、3--甲基没食子酸或4--甲基没食子酸、对羟基苯丙酸及表儿茶素没食子酸酯等物质。因此,通过改善EGCG的理化性质或减少其生物转化的化学修饰可能有助于提高其生物利用度。
AcEGCG的脂溶性较好,能够透过双脂层细胞膜,在靶向作用点大量聚集,因而生物利用度高于EGCG。Lambert等研究发现,AcEGCG在KYSE150人食管癌细胞和HCT116结肠癌细胞内的浓度是相同处理下EGCG的2.8~30.0 倍,可见其体内生物利用度大幅提高。同时,AcEGCG可以抑制脂多糖刺激引起的小鼠RAW264.7巨噬细胞一氧化氮的产生及花生四烯酸的释放,抑制能力分别是EGCG的4.4 倍和2.0 倍。对小鼠进行灌胃实验发现,AcEGCG组小鼠血浆中血药质量浓度-时间曲线下面积(area under concentration-time curve,AUC)(反映药物在体内的暴露特性)(AUC=465.0 μg/(mL·min)显著高于EGCG组(AUC=194.6 μg/(mL·min);小肠和结肠组织中AcEGCG组AUC分别是EGCG组的2.8 倍和2.4 倍。这充分说明AcEGCG在小鼠体内的生物利用度高于EGCG。综上,乙酰化可以增强EGCG的生物效价及生物利用度。
3 AcEGCG的生物活性
3.1 生物安全性
EGCG在低浓度时具有较好的生物活性,但浓度过高则表现出一定生理毒性。王东旭研究发现,小鼠多次腹水注射55 mg/kg和75 mg/kgEGCG(亚急性模型)以及单次腹水注射200 mg/kgEGCG(急性毒性模型)后,出现昏睡、立毛、弓背和活动减少等毒症现象;解剖发现肝脏出现白斑、淤血等损伤变化,且高剂量下更加明显,表明高浓度EGCG可以引起小鼠肝毒性。虽然按照GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》规定,EGCG属于低毒范围,但其生理毒性在一定程度上影响其开发应用。
AcEGCG的生物安全性也受到关注。王金妮等对小鼠连续灌胃AcEGCG和EGCG 14 d,结果发现AcEGCG组小鼠无死亡,病理检查结果与正常对照组无差异,最大耐受量为8 300 mg/kg,而EGCG组小鼠给药后第1~5天出现死亡,半数致死量为761.5 mg/kg。Ou Bingning等在细胞水平探究了AcEGCG的生理毒性,结果表明AcEGCG对BEL-7402/5-FU的细胞毒低于EGCG。可见,AcEGCG的生物安全性高于EGCG,因此更具开发应用潜力。
3.2 抗紫外线
紫外线对机体的损伤主要体现在:一方面,紫外线作为光能量易被DNA、蛋白质等直接吸收,造成DNA链的损伤及蛋白质空间结构的破坏;另一方面,机体在紫外线诱导下会产生大量活性氧(reactive oxygen species,ROS),ROS积累可直接攻击DNA、蛋白质、脂质等生物大分子,造成氧化损伤,进而引起一些氧化应激类疾病。研究表明,AcEGCG能够预防和修复紫外线造成的机体损伤。在修复模式中,AcEGCG可抑制因紫外线照射引起的HaCaT细胞存活率下降,且10 μmol/L AcEGCG修复效果显著优于同浓度EGCG。在预防模式中,紫外线辐射前施加EGCG和AcEGCG均可有效抑制因紫外线照射导致的细胞存活率下降,显著提高细胞内的抗氧化酶活性,抑制脂质过氧化产物丙二醛的产生,且一定浓度下,AcEGCG的保护效果显著优于同浓度EGCG。因此,AcEGCG在紫外线损伤预防及修复方面具有应用潜力。
3.3 保护黑色素细胞
黑色素细胞损伤、功能消退或数量减少在白癜风的发生发展中占据重要地位。研究表明,在氧化应激条件下,人表皮黑色素细胞的存活率降低,胞内乳酸脱氢酶(lactic dehydrogenase,LDH)泄漏量增加,胞内ROS水平明显升高,Caspase-9和Caspase-3表达量升高。目前认为ROS引起的氧化应激参与了白癜风的发病,而抗氧化治疗是防治白癜风的有效途径之一。Wang Siyu等研究发现,40 μmol/L AcEGCG可以提高HO处理下黑色素细胞存活率(91%),显著高于同浓度EGCG(黑色素细胞存活率67.6%)、全丙酰化EGCG及全丁酰化EGCG。Ning Weixuan等研究发现,AcEGCG对HO诱导的黑色素细胞氧化应激损伤有显著的保护作用。AcEGCG能够提高细胞存活率,降低LDH泄漏量、细胞内ROS产生量以及Caspase-9和Caspase-3表达量,且其活性显著高于EGCG,提示AcEGCG能够通过抗氧化应激和抗凋亡作用保护人黑素细胞。同时,初步临床观察显示,AcEGCG和EGCG治疗白癜风疗效与商用药物爱宁达相当,但AcEGCG起效快、作用浓度低、安全性更佳。因此,AcEGCG可能成为治疗白癜风的新药。
3.4 抗炎症、抗癌活性
AcEGCG的抗癌活性已得到广泛证实,其对人子宫内膜癌、食管癌、结肠癌、乳腺癌、宫颈癌、肺癌、肝癌等均展示出较好的抑制活性,且活性均高于EGCG(表2)。AcEGCG的抗癌机制涉及多个方面,包括抑制蛋白酶体、诱导癌细胞凋亡、影响癌症相关基因的表达、抑制血管生成等:1)泛素-蛋白酶体通路是蛋白质降解的重要途径,该通路的阴断可以影响细胞内多个短周期蛋白的降解,进而诱导癌细胞凋亡。Lam等研究发现,AcEGCG抑制蛋白酶体和诱导MCF7乳腺癌细胞凋亡的活性强于EGCG,是一种潜在的EGCG蛋白酶体抑制剂和抗癌的药物前体。Landis-Piwowar等也发现,相比EGCG,AcEGCG对人乳腺细胞MDA-MB-231蛋白酶体抑制活性、生长抑制活性及凋亡诱导活性大幅提高。2)在皮肤肿瘤形成的过程中,肿瘤干细胞标记物CD34的表达是干细胞激活和肿瘤形成所必需的,同时蛋白激酶D1(protein kinase D1,PKD1)对于角质细胞的增殖和分化过程均具有重要的调节作用。Chiou等研究发现,在多期小鼠皮肤癌变模型中,AcEGCG能够通过抑制CD34的表达和PKD1的激活有效预防皮肤癌变。3)血管生成对恶性肿瘤的发生、侵袭和转移产生重要作用,因此,抑制肿瘤血管生成是治疗肿瘤的重要策略之一。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)能够促进血管内皮细胞进行有丝分裂,从而刺激血管的形成。而丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号通路中磷酸化蛋白p-ERK1/2、磷脂酰肌醇-3-激酶(phosphoinositide-3 kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)信号通路中磷酸化蛋白p-AKT的激活以及缺氧诱导因子(hypoxia inducible factor,HIF)-1α的高水平表达均可引起mRNA的过度表达。陈润丽研究发现,AcEGCG通过降低p-ERK1/2、p-AKT以及缺氧条件下HIF-1α的高表达,减少VEGF的分泌,进而抑制人脐静脉内皮细胞的生成,最终抑制人肝癌血管的生成,其抑制作用强于EGCG(表2)。Wang Jianzhang等发现,AcEGCG一方面通过抑制PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/HIF-1α通路,减少VEGFA的分泌;另一方面通过下调细胞和趋化因子配体12的表达,限制巨噬细胞的迁移和分化,进而抑制肿瘤相关巨噬细胞分泌VEGFA,通过双重作用抑制人子宫内膜癌血管的生成。
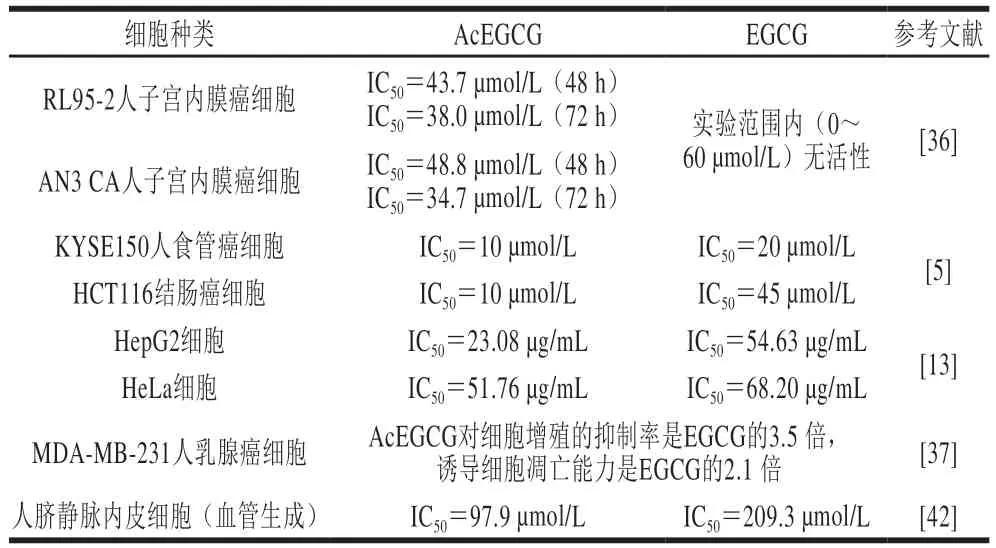
表2 AcEGCG和EGCG的抗癌活性Table 2 Anti-cancer activity of AcEGCG and EGCG
除抗癌活性外,AcEGCG还可通过抗炎作用实现对癌症的预防。诸多研究证实,体内炎症是癌变的重要诱因之一,因此炎症的防控治疗是预防癌症发生的重要途径。Chiou等研究发现,AcEGCG对炎症性肠病和可能与结肠炎相关的结肠癌具有潜在的预防效果。相比EGCG,AcEGCG对右旋糖酐硫酸盐钠刺激引起的小鼠结肠缩短、异常隐窝灶和淋巴样结节的形成具有更好的预防作用。从分子水平看,AcEGCG可以通过抑制组蛋白3赖氨酸残基9位乙酰化、下调PI3K/Akt/NF-κB磷酸化和p65乙酰化、激活ERK1/2信号通路和乙酰化核因子E2相关因子2、上调血红素加氧酶-1的表达量,最终降低促炎介质水平及抑制结肠炎的发生。进一步的研究也证实,饲喂AcEGCG可以显著降低小鼠结肠炎驱动的结肠癌。
在癌症治疗中,AcEGCG能够增强癌细胞的药物敏感性、逆转癌症多药耐药性。Heyza等在H460肺癌肿瘤移植小鼠模型中发现,60 mg/kgAcEGCG可以显著增强顺铂的抗癌活性,在研究周期内(24 d)小鼠体内的肿瘤几乎未生长。叶敏发现,AcEGCG可以显著提高阿霉素对癌细胞的抑制作用。Ou Bingning等研究发现,AcEGCG联合5-氟脲嘧啶(5-fluorouracil,5-FU)的抑瘤率为40.53%,与EGCG联合5-FU(30.87%)相比具有显著性差异;在一定剂量范围内,AcEGCG联合柔红霉素对人肝癌细胞SMMC-7721的增敏作用较EGCG强。因此AcEGCG在与抗癌药物协同作用方面较EGCG更具潜力。
同时,AcEGCG还可缓解抗癌药物的毒性,减轻脏器损伤。柔红霉素常用于治疗抗肿瘤药耐药的急性淋巴细胞或粒细胞白血病,但其心脏毒性可以导致机体心律失常,使血清心肌酶谱和高敏肌钙蛋白T水平明显升高,血清和心肌超氧化物歧化酶(superoxide dismutase,SOD)活性降低,丙二醛含量增多,并造成心肌超微结构损伤。在小鼠模型中,AcEGCG可拮抗上述变化,对柔红霉素所致的心脏毒性具有保护作用,其作用机制可能与增强SOD活力和抗脂质过氧化有关。环磷酰胺对恶性肿瘤具有较好的疗效,但其毒副作用常导致骨髓抑制、出血性膀胱炎、生殖毒性、心脏毒性和肝毒性等。杜亚俊研究发现,AcEGCG和EGCG对环磷酰胺引起的肝脏组织损伤有一定的保护作用,且在低剂量时AcEGCG比EGCG的作用更明显。
3.5 降糖、保护视力、抗氧化(体外)、抑菌等活性
-葡萄糖苷酶和-淀粉酶可以将食物中的糖类化合物降解为单糖,促进其吸收利用。但糖尿病患者则需要适当抑制该类酶的活性,减缓糖类代谢,维持血糖平衡。叶敏研究发现,AcEGCG对-葡萄糖苷酶和-淀粉酶具有较高的抑制活性,IC分别为58.73、101.4 μg/mL,高于EGCG(IC分别为291.3、125.0 μg/mL)。脉络膜新生血管(choroidal neovascularization,CNV)由脉络膜毛细血管过度生长以及视网膜色素上皮向Bruch膜扩散形成,常见于许多眼部疾病,与视力下降密切相关。基于AcEGCG高效的血管生成抑制作用,其对于CNV引起的眼部疾病(如老年性黄斑变性)也具有较好的缓解作用。Xu Jiaowen等研究发现,AcEGCG通过抑制HIF-1α/VEGF/VEGFR2途径和M1型巨噬细胞/小胶质细胞极化,减少血管内皮细胞增殖、迁移和血管的形成,最终减缓小鼠眼部CNV的形成。因此,AcEGCG在糖尿病、眼部疾病的预防及治疗中具有一定应用潜力。
EGCG含有酚羟基结构,能够为氧化过程中的自由基R·提供H·,结束自由基的传播而终止氧化反应,因而具有较强的抗氧化性。而AcEGCG的酚羟基被酰化,从结构分析看,其抗氧化活性应该低于EGCG。王伟伟等研究发现,AcEGCG清除自由基活性与其取代度有一定关系,总抗氧化活性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性和羟自由基清除活性随着取代度增加而逐渐减弱,超氧阴离子自由基清除活性随着取代度的增加呈先升高后降低趋势。Utenova等发现,AcEGCG的DPPH自由基清除活性显著低于EGCG。因此,从结构-活性的角度,特别是从自由基清除活性方面考虑,AcEGCG是否存在修饰过当的问题仍有待探究。但值得注意的是,AcEGCG的脂溶性高于EGCG,因而对其抗氧化能力的评价还需考虑所用的溶剂体系及评价方法。朱松利用过氧化值法和Rancimat仪法探究了部分乙酰化EGCG在油脂中的抗氧化活性,结果发现在相同添加量(200 mg/kg)下,部分乙酰化EGCG在油脂中的抗氧化活性高于EGCG以及二丁基羟基甲苯,证实乙酰化EGCG在油脂类食品中的抗氧化潜力。因此,可以推测AcEGCG在油脂(非水相)体系中具有潜在抗氧化活性,但还需进一步研究证实。
EGCG具有广谱抑菌活性,可通过破坏细胞膜、干扰遗传物质及蛋白质的合成、诱导胞内氧化应激等多层次作用抑制有害细菌的增殖。对EGCG进行乙酰化修饰,其抑菌活性也发生改变。Kalaiselvi等利用琼脂稀释法比较了EGCG和AcEGCG的抑菌活性,结果发现,EGCG对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、小肠结肠炎耶尔森氏菌的最小抑菌质量浓度(minimum inhibitory concentration,MIC)分别为130、150、200、250 μg/mL,而AcEGCG对这4 种细菌的MIC为100、120、150、200 μg/mL,可见EGCG经全乙酰化修饰后抑菌活性显著提高。朱媛等以乙酸酐为酰化剂,乙酸乙酯为溶剂,吡啶为催化剂,利用回流加热得到茶多酚乙酰化修饰产物,经研究发现乙酰化茶多酚对大肠杆菌的抑菌圈直径为8.64 mm,MIC为0.1 mg/mL。抑菌活性显著高于未改性的茶多酚(抑菌圈直径小于6.5 mm,MIC=0.15 mg/mL)以及山梨酸钾和苯甲酸钠等防腐剂,进一步证实乙酰化修饰是提高多酚抑菌效力的有效方式。然而目前关于AcEGCG的抑菌作用及抑菌机制研究仍十分有限,其在食品体系中的实际应用也需系统探究。AcEGCG和EGCG的生物活性综合比较分析见表3。

表3 AcEGCG和EGCG的生物活性比较分析Table 3 Comparative analysis of AcEGCG and EGCG
4 结 语
EGCG广泛的生物活性使其在食品加工与安全、人体疾病的预防与治疗等方面意义显著。随着EGCG结构修饰研究的深入,乙酰化EGCG尤其是AcEGCG已经引起研究者的关注。相比EGCG,AcEGCG的稳定性、脂溶性及生物利用度显著改善,且多种生物活性也得到显著提升,因而是优良的食品、化工原料及广谱药物。AcEGCG对机体细胞的保护作用使其在保健食品、白癜风类药物、护眼药物、修复类药物、化妆品等的研发中具有良好的应用潜力。另外,AcEGCG显著的抗炎症、抗肿瘤、抗癌活性表明其对于癌症的预防和治疗有着积极的意义,是潜在的新型抗癌药物。因此,不断加大对AcEGCG合成技术的研究和改进力度,深化AcEGCG生物活性机制的探索,对于我国食品、医药及日用化工领域的发展均有着积极的促进作用。
目前,AcEGCG的工业化生产及应用仍处于起步阶段,建议对AcEGCG的后期研究从以下几个方面开展:1)继续开发绿色、可控、高效、可持续的AcEGCG合成方法,促使实验研究向生产化的转变,满足规模化生产的需要。2)进一步完善AcEGCG的生物活性,如探究AcEGCG在非水相体系、真实食品体系以及机体内的抗氧化、抑菌等作用,扩展其潜在的应用领域。3)AcEGCG的抗肿瘤、抗癌活性已得到大量证实,但其涉及的内在机制仍有待进一步研究,同时还须加强对临床试验的探索。4)AcEGCG为EGCG的乙酰化衍生物,其机体内外的代谢和降解机制可能更为复杂,需要更深入系统的研究。5)更重要的是,需系统比较AcEGCG与部分乙酰化或其他酰化、其他修饰、或乙酰化与其他修饰联合得到的EGCG衍生物特性与生物活性,以确证AcEGCG是否存在修饰过当的问题,同时为EGCG衍生物的进一步研发、功效化和市场化提供科学依据。综上,AcEGCG作为安全、有效的EGCG前体物质具有巨大的开发潜力。
