红毛藻多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节机理
2022-10-28吴靖娜陈晓婷刘智禹
吴靖娜,潘 南,陈晓婷,陈 贝,刘智禹,*
(1.厦门医学院,海洋生物医药资源福建省高校工程研究中心,福建 厦门 361023;2.福建省水产研究所,福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
恶性肿瘤已成为严重威胁人类身体健康和生命安全的常见疾病,目前化疗仍是其主要的治疗方法之一,然而,化疗药物在消灭肿瘤细胞的同时,会导致患者肠道炎症反应造成肠道菌群紊乱,破坏肠道上皮屏障作用及肠道的免疫作用,从而引起其他病症,如骨髓抑制、肝损伤等疾病;此外,临床诊断显示,接受长期化疗的患者会出现免疫抑制的状况,导致机体对抗原的应答能力出现抑制甚至缺失的现象,所以多数患者在治疗期间会被给予适当的免疫调节剂来缓解免疫抑制现象。
环磷酰胺(cyclophosphamide,CTX)是一种常用的化疗药物,其不仅会损伤机体的正常细胞,而且容易诱发机体的免疫功能低下,已成为建立免疫抑制实验动物模型的常用药物。免疫抑制是一种表现为临时性或永久性的免疫应答功能障碍的免疫反应,大量研究表明,多糖可通过激活固有免疫细胞、适应性免疫细胞、补体系统和免疫球蛋白(immunoglobulin,Ig)的表达,从而提升机体的免疫功能,是一种非特异性免疫增强剂,能够以多靶点、多通道及多重效应的方式从免疫器官、免疫细胞和免疫活性物质对机体免疫系统进行调控。如羊栖菜多糖对CTX诱导的免疫抑制小鼠脾淋巴细胞增殖和细胞因子分泌有明显的促进作用;双孢菇子实体多糖、菌丝体多糖和发酵液多糖能够恢复CTX诱导的免疫抑制小鼠胸腺和脾脏脏器指数,显著提高免疫抑制小鼠血清中免疫相关细胞因子和IgG的分泌水平,增强巨噬细胞吞噬能力,具有明显的免疫增强能力;黑虎掌菌子实体多糖能够促进免疫抑制小鼠血清和脾脏中Ig和细胞因子的生成,增强细胞免疫和体液免疫应答作用,对CTX诱导的免疫抑制具有保护作用;香菇多糖能增强免疫抑制小鼠腹腔巨噬细胞的吞噬能力,促使脾脏淋巴细胞增殖分化和血清溶血素形成,提高小鼠胸腺和脾脏指数,降低血清中细胞因子IL-10的水平,提高血清Ig含量,逆转CTX诱导的免疫抑制。因此,寻找食源性多糖并阐明其发挥免疫调节活性的具体作用机制,可以为食源性免疫调节剂的开发与应用提供参考。
海洋藻类含有丰富的活性物质,从藻类中提取的多糖已被证明具有多种治疗功效。红毛藻()属于红藻门、原红藻纲、红毛菜属植物,生长于亚寒带至亚热带区域,我国的主要产地在福建莆田。目前,对于红毛藻中多糖的研究主要集中在制备工艺及活性评价,如宋田源等的研究结果显示红毛藻中多糖具有潜在的降血压、降血糖和降血脂的活性;詹慧等通过构建酶活力和细胞模型,同样证明了红毛藻中多糖具有降血脂活性;余刚等的研究结果表明红毛藻中多糖具有显著的体外免疫诱导活性;孙惠洁和吴云辉等的研究结果显示红毛藻中多糖对1,1-二苯基-2-三硝基苯肼自由基和羟自由基具有明显的清除能力,具有一定的体外抗氧化活性;何萍萍等的研究结果显示红毛藻中多糖对HO诱导氧化损伤的Caco-2细胞具有保护作用;张一非等在优化红毛藻中多糖提取工艺基础上,对其抗光氧化活性进行研究,发现多糖质量浓度为0~200 μg/mL时具有抗人皮肤成纤维细胞光氧化损伤能力。本课题组前期从红毛藻中提取获得一种分子质量约为333 kDa的红毛藻多糖(polysaccharides,BFP),其主要由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖5 种单糖组成。本研究通过腹腔注射CTX构建免疫抑制小鼠模型,从多个角度初步探讨BFP对免疫抑制小鼠的保护作用及其作用机制,以期为BFP开发成食源性免疫调节剂提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
雄性SPF级BALB/c小鼠购于上海斯莱克实验动物有限公司,动物生产许可证号:SCXK(沪)2017-0005。
BFP由课题组自制。
CCK-8细胞增殖及细胞毒性检测试剂盒、噻唑蓝(methyl thiazolyl tetrazolium,MTT)检测试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、RIPA裂解液 上海碧云天生物技术有限公司;乳酸脱氢酶测试盒 南京建成生物工程研究所;胎牛血清、预染蛋白Marker 赛默飞世尔科技(中国)有限公司;RPMI1640培养基 美国Corning公司;YAC-1细胞、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-2、IgG、IgA、干扰素-γ(interferon-γ,INF-γ)、核因子(nuclear factor,NF)-κB酶联免疫吸附测试(enzymelinked immunosorbent assay, ELISA)试剂盒、磁珠法总RNA提取试剂盒、SYBR Premix Ex试剂盒上海美轩生物科技有限公司;丽春红染色液 西格玛奥德里奇(上海)贸易有限公司;增强型化学发光试剂(enhanced chemiluminescence,ECL) 美国Millipore公司;蛋白酶抑制剂、磷酸酶抑制剂 瑞士Roche公司;Toll样受体(Toll-like receptor,TLR)2、TLR3、TLR4、TLR7、TLR8、IL-6、TNF-α抗体武汉三鹰生物科技有限公司;TLR9抗体、核苷酸结合寡聚域(nucleotide-binding oligomerization domain,NOD)1抗体、NOD2抗体 英国Abcam公司;细胞激活剂、固定破膜套装(固定/浓缩工作液、孵育缓冲液)、抗鼠CD3、CD25、CD19、CD4、CD8、IL-17抗体 美国BD公司。
1.2 仪器与设备
Multiskan MK3酶标仪、311二氧化碳培养箱、Fresco低温冷冻离心机 美国Thermo公司;FACS Calibur流式细胞仪 美国BD公司;Scepter细胞计数器美国Millipore公司;7500实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;165-8001小型垂直电泳槽、164-5050基础电泳仪、170-3930小型转印槽 美国Bio-Rad公司;164-5050超净工作台 苏州净化设备有限公司。
1.3 方法
1.3.1 实验动物分组
实验小鼠4~5 周龄,体质量(18±2)g,维持每天12 h的交替光照,25 ℃恒温环境,充足食物和水供给,在SPF级动物房中进行适应性喂养1 周后进行实验。60 只小鼠随机分为6 组,每组10 只。分组:生理盐水组(空白对照组)、CTX免疫抑制组(模型组)、低剂量BFP处理组、中剂量BFP处理组、高剂量BFP处理组、香菇多糖(阳性对照组)。给药方式:前3 d每天进行1 次腹腔注射,空白对照组小鼠腹腔注射100 μL生理盐水,模型组、阳性对照组和低、中、高剂量BFP处理组小鼠腹腔注射100 μL CTX(40 mg/kg);第4天开始,各组分别灌胃100 μL生理盐水、香菇多糖(40 mg/kg)、低剂量BFP(100 mg/kg)、中剂量BFP(200 mg/kg)、高剂量BFP(400 mg/kg),连续灌胃4 周。
颈椎脱臼法处死小鼠,无菌条件下取出脾脏,进行自然杀伤(natural killer,NK)细胞活性和脾淋巴细胞转化实验;用2 mL生理盐水灌洗小鼠腹腔2 次,吸出腹腔液,进行腹腔巨噬细胞吞噬中性红能力检测;收集小鼠全血,对淋巴细胞分群情况进行检测;将小鼠血液3 000 r/min、4 ℃离心15 min,收集小鼠血清,测定IL-2、IL-6、TNF-α、IFN-γ、IgA和IgG水平;收集结肠组织,检测NF-κB、TLR1、TLR2、TLR4、TLR7、TLR8、TLR9、NOD1、NOD2、IL-6和TNF-α蛋白及mRNA表达水平。
1.3.2 增强免疫力的指标测定
增强免疫力功能评价参照《允许保健食品声称的保健功能目录 非营养素补充剂(2020年版)(征求意见稿)》中“有助于增强免疫力功能检测方法”,采用细胞免疫、体液免疫功能和非特异性免疫中单核-巨噬细胞功能、NK细胞活性多个维度进行综合评价。NK细胞活性评价采用乳酸脱氢酶测定法;腹腔巨噬细胞吞噬中性红能力采用中性红吞噬实验法测定;碳廓清指数K和吞噬指数α采用小鼠碳廓清实验中校正吞噬指数法测定;血清溶血素水平采用凝血法测定;T细胞增殖率采用ConA诱导小鼠脾淋巴细胞转化实验中的MTT法测定。
1.3.3 相关细胞因子和免疫球蛋白质量浓度的测定
按试剂盒说明书操作,采用ELISA法定量测定血清中免疫相关细胞因子(IL-2、IL-6、TNF-α、IFN-γ)、IgA、IgG的质量浓度,每组3 个平行。
1.3.4 流式细胞术分析淋巴细胞分群
每管加入100 μL全血,并分别加入10 μL相应的抗体(CD3/CD4/CD8、CD3/CD19和CD4/CD25),振荡,室温避光20 min。加入1 mL溶血素试剂,振荡后室温避光10 min,1 200 r/min离心5 min,弃去上清液,振荡。加入2 mL磷酸缓冲盐溶液(phosphate buffered saline(PBS),pH 7.2、0.01 mol/L),振荡,1 200 r/min离心5 min,弃去上清液,振荡。加入500 μL PBS,采用FACS Calibur流式细胞仪分析CD3CD4T细胞、CD3CD8T细胞、CD4CD25T细胞、CD3CD19B细胞的比例,计算CD4T细胞/CD8T细胞(即CD4/CD8)。每组6 个平行。
每管加入100 μL全血,然后加入1 mL溶血素,振荡后室温避光10 min,1 200 r/min离心5 min,弃去上清液,加入2 mL PBS,1 200 r/min离心5 min,弃去上清液。加入1 mL RPMI 1640培养基重悬细胞,取200 μL细胞悬液,加入0.4 μL细胞激活剂混匀,37 ℃、5% CO培养箱培养4 h,收集细胞。1 200 r/min离心5 min后弃去培养基,用100 μL PBS重悬细胞,加入5 μL CD4抗体,室温放置30 min。加入2 mL PBS,1 500 r/min离心5 min弃去上清液。加入1 mL固定/浓缩工作液(固定浓缩液与稀释液体积比1∶3),室温放置30 min。加入2 mL孵育缓冲液,1 500 r/min离心5 min,弃去上清液,加入2 mL孵育缓冲液重悬细胞,1 500 r/min离心5 min。取100 μL上清液,加入5 μL IL-17抗体,室温避光放置30 min。加入1 mL孵育缓冲液,1 500 r/min离心5 min,弃去上清液,加入500 μL PBS,上机检测,分析CD4IL-17T细胞的比例。每组6 个平行。
1.3.5 实时荧光定量PCR检测
利用实时荧光定量PCR检测小鼠结肠组织中、(、、、、、)、NOD样受体(nucleotide oligomerization domain-like receptor,)(和)、细胞因子(和)mRNA相对表达水平的变化,每组3 个平行。
取50 mg结肠组织切成小块后,液氮研磨成粉状,按照磁珠法总RNA提取试剂盒的操作说明提取总RNA。按照SYBR Premix Ex试剂盒说明书操作,反应体系20 µL,样品管和内参管均设3个复管。反应条件为50 ℃、10 min反转录,95 ℃预变性5 min,95 ℃、15 s,60 ℃、30 s,40 个循环。以为内参基因,采用2法比较各组mRNA相对表达水平的差异。
实验所用引物委托生工生物工程(上海)有限公司合成,引物序列如表1所示。

表1 目的基因和内参基因引物Table 1 Primer sequences used for amplification of target and internal reference genes
1.3.6 Western blot分析
收集小鼠的结肠组织,Western blot方法检测小鼠结肠组织NF-κB、TLRs(TLR1、TLR2、TLR4、TLR7、TLR8、TLR9)、NLR(NOD1和NOD2)以及细胞因子(IL-6和TNF-α)的相对表达水平,每组3 个平行。
把20 mg结肠组织剪切成小块,加入200 μL RIPA裂解液,经匀浆机充分匀浆后,12 000 r/min离心5 min,取上清液,用BCA蛋白浓度测定试剂盒测定蛋白浓度。每孔加入20 μL上样液,留一孔加入10 μL预染的Marker,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿转法将凝胶中的蛋白质转至聚偏二氟乙烯膜,加入5%(质量分数)牛血清白蛋白室温封闭2 h,加入一抗稀释液(1∶1 000),4 ℃孵育24 h,TBST洗膜3 次,每次5 min,然后加入辣根过氧化物酶标记的羊抗小鼠二抗(1∶5 000)室温孵育2 h,TBST洗膜5 次,每次15 min,加入ECL试剂反应发光后,暗室中用X胶片感光、显影、定影,采集图像,Quantity-one软件分析灰度值。蛋白相对表达水平为目的蛋白条带灰度值与内参GAPDH条带灰度值之比。
1.4 数据处理与分析
采用SPSS Statistics 17.0统计软件进行数据分析,结果以平均值±标准差表示,采用检验进行组间差异分析,<0.05表示差异显著,<0.01表示差异极显著。
2 结果与分析
2.1 BFP对免疫抑制小鼠非特异性免疫的影响
由图1A可知,与空白对照组相比,模型组小鼠NK细胞活性极显著降低(<0.01);与模型组相比,低、中、高剂量BFP处理组极显著地增强NK细胞活性(<0.01);高剂量BFP的增强作用与阳性对照组相当,NK细胞活性高达57.36%。由图1B可知,与空白对照组相比,模型组小鼠巨噬细胞中性红吞噬能力极显著降低(<0.01);与模型组相比,低剂量BFP处理组能略微提高巨噬细胞吞噬中性红的能力,但无统计学意义(>0.05);中、高剂量组对巨噬细胞吞噬中性红能力的促进效果达到极显著水平(<0.01)。由图1C、D可知,与空白对照组相比,模型组小鼠碳廓清指数K和吞噬指数α均极显著降低(<0.01);与模型组相比,中、高BFP处理组可极显著提高碳廓清指数K(<0.01);低、中、高BFP处理组均能显著或极显著提高吞噬指数α(<0.05、<0.01)。


图1 BFP对免疫抑制小鼠免疫功能的影响Fig. 1 Effect of BFP on the immunity of immunosuppressed mice
2.2 BFP对免疫抑制小鼠体液免疫和细胞免疫的影响
由表2可知,与空白对照组相比,模型组小鼠T细胞增殖率、CD4T细胞比例、CD4/CD8均极显著降低;与模型组相比,低剂量BFP处理组能促进小鼠T淋巴细胞的增殖,但效果不显著(>0.05);中剂量BFP处理组的增殖效果达到显著水平(<0.05);高剂量BFP处理组达到极显著水平(<0.01),细胞增殖率高达18.58%,增殖效果与阳性对照组相当;与模型组相比,低、中剂量BFP干预能够显著提高血液中CD4T细胞的比例(<0.05),高剂量BFP处理组可以极显著提高血液中CD4T细胞的比例(<0.01);与模型组相比,低、中剂量BFP处理能够降低CD8T细胞比例,但效果不显著(>0.05),而高剂量BFP干预显著下调CD8T细胞比例(<0.05),并显著提高CD4/CD8。与空白对照组相比,模型组小鼠辅助性T细胞(helper T cell,Th)17(CD4IL-17T细胞)比例极显著升高,调节性T细胞(regulatory T cell,Treg)(CD4CD25T细胞)比例无显著变化;与模型组相比,低、中、高BFP处理均能够显著或极显著降低Th17(CD4IL-17T细胞)的比例(<0.05、<0.01),而对Treg(CD4CD25T细胞)比例没有显著影响(>0.05);中、高剂量BFP干预极显著降低了免疫抑制小鼠血液中CD3CD19B细胞的比例(<0.01)。
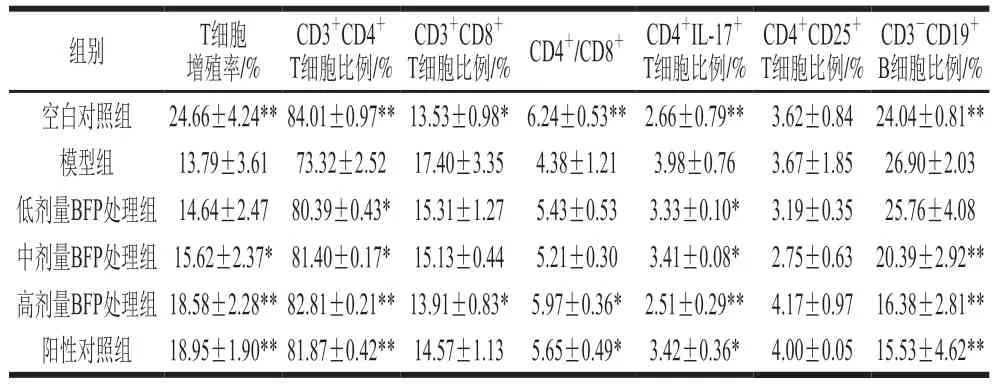
表2 BFP对免疫抑制小鼠T淋巴细胞和B淋巴细胞的影响Table 2 Effect of BFP on T lymphocytes and B lymphocytes in immunosuppressed mice
由图2可知,与空白对照组相比,模型组小鼠血清溶血素水平极显著降低;与模型组相比,低、中BFP处理组对血清溶血素水平的影响不显著(>0.05);而高剂量BFP对其的促进效果达到极显著水平(<0.01),且略高于阳性对照组。

图2 BFP对免疫抑制小鼠血清溶血素水平的影响Fig. 2 Effect of BFP on serum hemolysin level in immunosuppressed mice
由图3可知,与空白对照组相比,模型组小鼠血清中免疫相关细胞因子(IL-2、IL-6、TNF-α、INF-γ)、IgA和IgG的质量浓度极显著下降(<0.01);与模型组相比,低、中、高BFP剂量处理组均能极显著促进IL-2、IL-6、TNF-α和INF-γ的释放(<0.01),极显著提高IgA和IgG的产生(<0.01)。
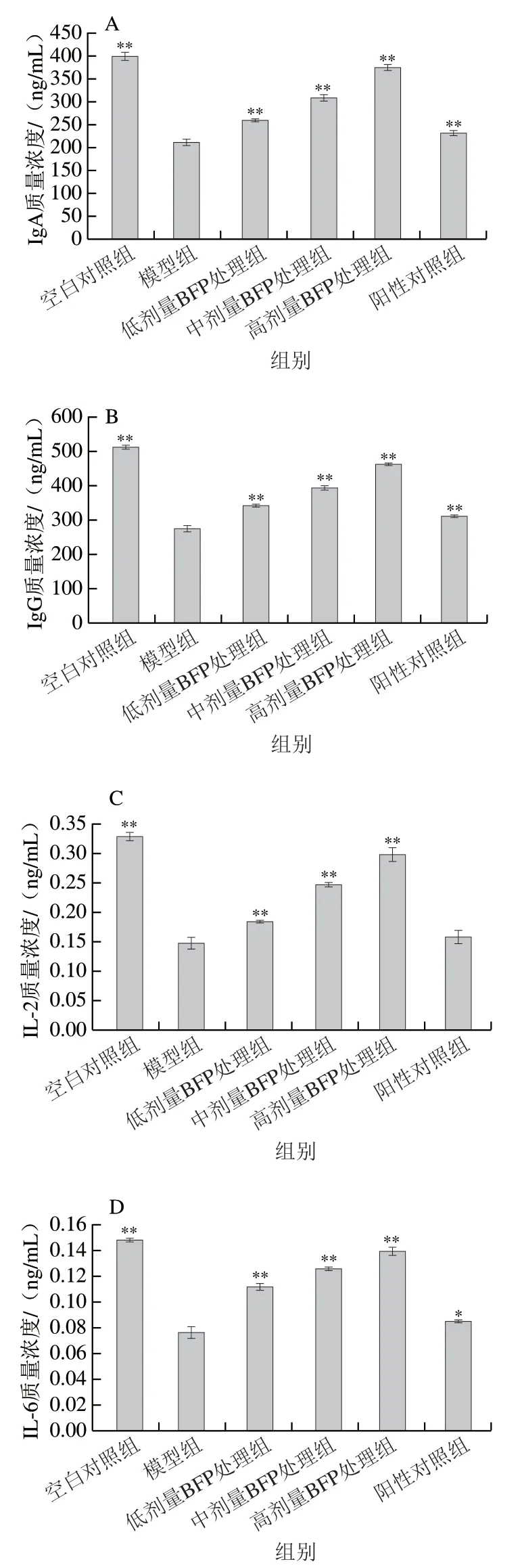

图3 BFP对免疫抑制小鼠血清中IgA(A)、IgG(B)、IL-2(C)、IL-6(D)、INF-γ(E)和TNF-α(F)质量浓度的影响Fig. 3 Effect of BFP on IgA (A), IgG (B), IL-2 (C), IL-6 (D), INF-γ (E)and TNF-α (F) levels in serum of immunosuppressed mice
2.3 BFP对免疫抑制小鼠肠道组织中免疫相关细胞表面受体及细胞因子表达水平的影响
如表3所示,与空白对照组相比,CTX处理后,模型组小鼠结肠组织中和的mRNA相对表达水平显著增加(<0.05),而其他和变化不显著(>0.05),免疫相关因子(、)的转录水平显著高于空白对照组(<0.05)。与模型组相比,中、高剂量BFP组干预显著下调了和的转录水平(<0.05),同时,中、高剂量组基因表达水平较模型组显著降低(<0.05),低、中、高剂量的基因表达水平较模型组均显著降低(<0.05),但是和mRNA相对表达水平的变化趋势与血清中IL-6和TNF-α质量浓度变化趋势不同。

表3 BFP对小鼠结肠组织中TLR、NLR以及免疫相关细胞因子mRNA相对表达水平的影响Table 3 Effect of BFP on the relative mRNA expression levels of TLR, NLR and immune-associated cytokines in the colon of mice
采用免疫印迹进一步验证免疫相关细胞表面受体及细胞因子的变化,结果如图4所示。与空白对照组相比,CTX处理后,模型组小鼠结肠组织中TLR2、TLR4、IL-6和TNF-α的蛋白相对表达水平极显著提高(<0.01);而经低、中、高剂量BFP干预后,TLR2和TLR4蛋白相对表达水平较模型组均极显著降低(<0.01),IL-6和TNF-α的蛋白相对表达水平显著降低,与基因表达检测结果一致。


图4 BFP对免疫抑制小鼠结肠组织中TLR2(A)、TLR4(B)、IL-6(C)和TNF-α(D)蛋白相对表达水平的影响及其免疫印迹图(E)Fig. 4 Effect of BFP on the relative protein expression levels of TLR2 (A),TLR4 (B), IL-6 (C) and TNF-α (D) in the colon of immunosuppressed mice and their western blot (E)
3 讨 论
机体免疫系统是关联免疫器官、免疫细胞以及免疫分子的极其复杂的防御体系,分为特异性免疫和非特异性免疫,其中特异性免疫防御体系包括B淋巴细胞介导的体液免疫应答和T淋巴细胞介导的细胞免疫应答。研究表明临床常用的抗癌药物CTX可以通过抑制免疫相关细胞因子的产生,降低NK细胞,脾脏T、B淋巴细胞,白细胞的活性,以及减弱腹腔巨噬细胞吞噬功能,从而达到免疫抑制的目的。因此,本研究采用CTX作为免疫抑制造模药物,通过口服BFP,从非特异性免疫、体液免疫及细胞免疫等多维度探讨BFP增强免疫抑制小鼠免疫能力的作用机理。
NK细胞在机体免疫中发挥着重要的免疫监视作用,当它接触靶细胞后在其表面释放细胞毒性颗粒,能非特异性地杀伤各种肿瘤细胞,而吞噬细胞(中性粒细胞、单核细胞和巨噬细胞)也是非特异性免疫的关键参与者。因此,NK细胞的活性以及细胞吞噬功能常用于评估机体的非特异性免疫状态。本实验结果表明,BFP干预能够活化CTX所致免疫抑制小鼠NK细胞,并能提高巨噬细胞吞噬能力,增加小鼠碳粒廓清指数K和吞噬指数α,这些结果说明口服BFP能有效提高免疫抑制小鼠的非特异性免疫。
淋巴细胞分为介导细胞免疫的T淋巴细胞(CD3)和介导体液免疫的B淋巴细胞(CD19)。成熟T淋巴细胞主要定居在外周免疫器官和血液中,可经过血液、组织液等进行循环,主要以杀伤靶细胞或释放免疫相关细胞因子发挥细胞免疫功能,而T淋巴细胞的增殖分化是机体细胞免疫反应的前提。实验结果发现,与模型组相比,中、高剂量BFP处理能促进小鼠T淋巴细胞的增殖(<0.05)。T淋巴细胞在胸腺中分化为成熟T细胞,即CD4T细胞和CD8T细胞。CD4T细胞可促使B淋巴细胞、T淋巴细胞以及其他免疫细胞的增殖,调控免疫细胞之间的相互作用,在免疫调节中处于中心地位,而CD8T细胞具有细胞毒性作用,可杀伤靶细胞,一般认为,CD4/CD8降低即提示机体处于免疫抑制状态。CD4T细胞在局部微环境中经抗原刺激及细胞因子的调控作用,分化为多种不同的细胞亚群,共同参与机体免疫应答,目前研究较多的亚群有Th1、Th2、Th17和Treg亚群,它们相互作用共同维持机体的免疫平衡,其中Th17主要介导固有免疫,其可分泌具有促炎作用的细胞因子IL-17,而Treg主要介导负向调控应答。研究发现,玛咖多糖能够促进CD4T细胞增殖;海胆多糖可对抗CTX引起的CD4T细胞、CD8T细胞比例以及CD4/CD8的下降,从而起到增强免疫的作用;绞股蓝粗多糖能够提高CTX诱导的免疫抑制小鼠血清和脾脏中的CD4T细胞和CD4/CD8;黑灵芝多糖可促进免疫低下小鼠小肠CD4T细胞的表达,提高CD4/CD8,强化机体细胞免疫调节,促进Th17/Treg平衡的恢复。实验结果表明,BFP能够提高免疫抑制小鼠CD4T细胞并增加CD4/CD8,降低Th17的比例,但是Treg比例没有显著差异(>0.05)。这些结果说明BFP能有效改善由CTX引起的小鼠免疫功能下降。
体液免疫是指活化的B淋巴细胞分化成浆细胞,浆细胞又分泌特异性抗体从而清除抗原并产生记忆细胞保护机体的免疫应答过程。B淋巴细胞作为专职的抗原提呈细胞,发挥着连接固有免疫和获得性免疫的作用,其特异性表面标志为CD19分子。本研究发现,与模型组相比,BFP干预降低了CD3CD19B细胞的比例。血清溶血素水平反映机体形成抗体的能力,常用于评价机体体液免疫功能,本实验结果表明,与模型组相比,高剂量BFP处理后免疫抑制小鼠的血清溶血素水平极显著升高(<0.01)。Ig是血清和体液中具有抗体活性的一类蛋白质,能够调节机体免疫环境,包括IgA、IgG、IgM等多种类型,其分泌量可以反映体液免疫系统的状况。本研究结果表明,与空白对照组相比,模型组小鼠血清中IgA和IgG的质量浓度极显著下降(<0.01),低、中、高BFP剂量处理组均能极显著提高IgA和IgG的释放量(<0.01),这些结果说明BFP能有效改善由CTX引起的小鼠体液免疫功能下降。
细胞因子不仅能够单独起效,还能与其他细胞因子相互协同或相互制约,从而在机体免疫应答时发挥生物学效应。细胞因子大部分是小分子物质,是通过刺激免疫细胞及某些非免疫细胞合成分泌而成,可参与多种免疫功能。比如IL-2是引起T细胞增殖分化的主要细胞因子,其表达水平是衡量机体细胞免疫的重要指标之一;IL-6能够调节包括T、B淋巴细胞等在内的免疫细胞功能,在体液免疫中发挥着重要作用;IFN-γ属于II型干扰素,主要由单核/巨噬细胞产生,具有促进主要组织相容性复合体分子表达、抗原提呈、抑制Th2细胞等功效。由单核巨噬细胞产生的TNF-α是免疫防护的重要介质,能够通过激活转录因子NF-κB,促使多种细胞因子基因的转录,增加细胞因子的分泌,增强T、B淋巴细胞活性,与机体免疫调节功能密切相关。本研究采用ELISA法检测小鼠血清中免疫相关细胞因子(IL-2、IL-6、TNF-α、INF-γ)的质量浓度,发现CTX免疫抑制小鼠血清中的IL-2、IL-6、TNF-α、INF-γ质量浓度极显著下降(<0.01),经低、中、高剂量BFP处理后均能极显著促进IL-2、IL-6、TNF-α和INF-γ的释放(<0.01),表明BFP能够通过促进细胞因子的分泌,参与调节机体免疫。
模式识别受体是非特异性免疫中免疫受体的代表,入侵的微生物或抗原物质可以被宿主肠道黏膜上特定模式识别受体识别,引起免疫反应,进而促进炎性细胞因子的分泌和多种免疫细胞的分化,它们是连接非特异性免疫和特异性免疫应答的关键桥梁。其中TLR和NLR是两类重要的模式识别受体,TLR位于细胞表面或胞内吞噬体膜,而NLR分布于胞质溶胶,共同借助识别细胞外和进入胞内的病原体相关分子模式而启动信号转导,促进免疫应答。多糖是具有空间结构的复杂大分子,存在活性中心,可作为配体被模式识别受体识别并激活其下游信号转导途径,最终可能会起到调控细胞免疫功能和调节免疫反应的作用。如黄芪多糖、当归多糖等多种中药多糖可以通过TLR4活化转录因子NF-κB,激活下游信号通路,调控细胞因子的表达最终发挥免疫调节作用。猪苓多糖通过TLR4受体识别,可促进树突状细胞成熟及分泌细胞因子IL-12、IL-10。本实验对小鼠肠道中部分、以及其下游部分促炎细胞因子(、)的mRNA表达水平进行检测,结果显示BFP显著下调了、的mRNA表达水平(<0.05),而对其他和的表达并没有显著影响;此结果与白术多糖和猪苓多糖的结果刚好相反,可能是因为,此时多糖是通过调控机体TLR受体的表达情况或其通路蛋白活性来发挥提高免疫力的活性,比如褐藻多糖硫酸酯通过抑制TLR4的表达及抑制NF-κB通路的激活而减缓炎症病程进展。同时,肠道组织中促炎细胞因子(、)mRNA表达水平的变化趋势与血清中不一致。这可能是由于CTX对肠道黏膜损伤主要以促炎为主,表现为促炎细胞因子mRNA表达水平的增加,而外周免疫系统中细胞因子的释放来源于脾脏和胸腺等全身性免疫系统的控制,CTX造成了免疫抑制,即表现为细胞因子水平的降低。此外免疫应答分为抗原识别、淋巴细胞增殖活化和效应阶段,在脾脏、胸腺完成应答程序之后,肠道免疫应答正好处于效应阶段。对其蛋白表达进行进一步的验证发现,BFP显著抑制了小鼠结肠组织中TLR2、TLR4、IL-6和TNF-α蛋白的表达,这与基因测定结果一致。因此,推测BFP可能通过TLR2/TLR4下游相关信号通路调节轴起到免疫功能保护作用。
4 结 论
BFP对CTX诱导的免疫抑制小鼠的非特异性免疫、体液免疫及细胞免疫具有良好的调节作用,能够有效改善CTX所致的小鼠免疫功能抑制情况。同时,BFP能够下调免疫抑制小鼠肠道相关免疫细胞表面受体(TLR2、TLR4)基因和蛋白的表达水平,降低免疫相关因子(IL-6、TNF-α)基因和蛋白的表达水平,综上,推测BFP可能通过TLR2/TLR4下游相关信号通路调节轴改善小鼠的肠道免疫环境进而起到免疫功能的保护作用,而具体的作用机制还需进一步研究。
