植物病原菌抗药性及其抗性治理策略
2022-10-25刘西莉苗建强
刘西莉, 苗建强, 张 灿
(1. 中国农业大学 植物保护学院,北京 100193;2. 西北农林科技大学 植物病理学系,陕西 杨凌 712100)
植物病害防治过程中,由于杀菌剂的多频次使用,病原菌在药剂的选择压下通常会产生抗药性,从而表现出对药剂的敏感性下降。具体体现为:一种杀菌剂在开始使用时对病害的防治效果很好,连续使用几年以后,防效降低,甚至无效。如果排除了药剂质量、使用方法和用药量等问题,药效下降或无效基本可判断为病原菌对所用杀菌剂产生了抗药性,但该现象需要进一步通过抗药性检测等方法加以确定。病原菌抗药性的产生不仅使杀菌剂防治效果降低,给农业生产带来损失,同时,农户为了提高防效而盲目加大用药量和施药次数,既增加了防治成本,也加重了药剂对农产品和环境的污染以及对非靶标生物的风险等。尤其是随着现代高活性的选择性杀菌剂的研发和广泛使用,由于其作用靶标位点单一,交互抗药性问题突出,导致病原菌的抗药性问题日趋严重,生产中面临着病害防效下降、农药残留超标、食品安全隐患等重大问题,给作物优质增产带来了巨大的挑战。目前,植物病原菌的抗药性已成为植物化学保护领域最受关注的问题之一。为此,本文系统阐释了抗药性相关术语的定义,综述了植物病原菌抗药性研究的相关内容和进展,为进一步推动我国杀菌剂抗性研究及抗性科学管理提供参考和指导。
1 植物病原菌对杀菌剂的抗药性研究历史和现状
1.1 抗药性的概念
植物病原菌抗药性 (fungicide resistance) 是指本来对农药敏感的野生型植物病原菌个体或群体,由于遗传变异而对药剂出现敏感性下降的现象[1]。“抗药性”术语包含两方面涵义:一是病原菌遗传物质发生变化,抗药性可以稳定遗传;二是抗性菌株对环境有一定的适合度 (fitness),与敏感野生群体相比,在越冬、越夏、生长、繁殖和致病力等方面具有较高的生存竞争力。病原菌抗药性有别于耐药性 (fungicide tolerance) 和不敏感性 (insensitivity)。前者是指有害生物对某种药剂的一种暂时的、不可稳定遗传的适应性反应,而后者则指有害生物对某种药剂的一种天然抵抗能力,即天生不敏感。
1.2 植物病原菌抗药性研究历史
20 世纪50 年代中期,美国学者Horsfall 提出了病原菌对杀菌剂敏感性下降的问题[2]。由于当时长期使用的是非选择性、多作用靶点的保护性杀菌剂,病原菌抗药性未成为农业生产中的重要问题,因而并未受到人们重视。直至 60 年代末,随着高效、内吸、选择性强的苯并咪唑类杀菌剂被开发和广泛用于植物病害防治,植物病原菌普遍出现了高水平抗药性[2],甚至导致植物病害化学防治失败,使农业生产蒙受巨大损失,人们才逐渐认识到病原菌抗药性问题的严重性。70 年代,荷兰Dekker 和希腊Georgopoulous 等开展了植物病原菌抗药性生物学、遗传学、流行学及其治理等方面的系统研究[3-4],并于1981 年促进国际农药工业协会成立了杀菌剂抗性行动委员会 (Fungicide Resistance Action Committee),开辟了植物病理学和植物化学保护学新的研究领域。
1.3 植物病原菌抗药性发生现状
随着学科发展,常用于植物真菌和卵菌病害化学防治的杀菌剂已达200 余种,且不断有新药剂推陈出新。因此,真菌和卵菌的抗药性是植物病原菌中最常见的,其次为细菌和线虫,其他病原如病毒的化学防治水平还很低,有些甚至还缺乏有效的化学防治手段,因此尚未出现抗药性问题。已知产生抗药性的病原菌有卵菌门霜霉目霜霉属、假霜霉属、疫霉属等卵菌和子囊菌门、担子菌门和无性型真菌的数百种真菌。产生抗药性的杀菌剂包括苯并咪唑类、苯酰胺类、羟基嘧啶类、苯胺基嘧啶类、三唑类、咪唑类、甲氧基丙烯酸酯类 (QoI)、琥珀酸脱氢酶抑制剂 (SDHI) 和氧化固醇结合蛋白抑制剂 (OSBPI)等内吸性杀菌剂,以及有机硫类、取代苯类等保护性杀菌剂,农用硫酸链霉素、春雷霉素和多氧霉素等抗菌素类化合物。
目前可用于防治植物细菌病害和线虫的药剂种类较少,用药水平较低,因此植物病原细菌和线虫的抗药性远不如真菌和卵菌抗药性得到的关注广泛。但是病原细菌繁殖速度快、容易发生变异,如果生产中频繁使用单作用位点的杀细菌剂,也会导致其逐渐产生抗药性。例如,农用硫酸链霉素在田间使用不久,梨火疫病菌就对其产生了抗性[5-6]。在用药水平较高的地区,发现了水稻白叶枯病菌对噻枯唑的田间抗性菌株[7]。近年来也发现了番茄溃疡病菌对农用硫酸链霉素的田间抗性菌株[8]。由于线虫繁殖速率一般较真菌、卵菌慢,以及传播方式存在局限性等,至今仅有少数线虫产生抗药性的事例[9]。其他病原如病毒、类菌原体和寄生性种子植物等目前还未见有抗药性的报道。
2 病原菌抗药性产生的两种观点
病原菌对杀菌剂产生抗性的原因是多方面的。通常认为主要有自然选择和诱导突变两种观点:自然选择学说认为,在自然情况下,病原菌群体中原本就存在极少量的遗传变异的抗性菌株,在不断应用杀菌剂防治病害过程中,大部分敏感菌株被杀死,原来极少数的天然抗性菌株个体在药剂选择下仍然可以继续生长繁殖、侵染寄主,其在群体中的比例不断提高,逐年积累,最后形成抗药性群体,导致药剂防效下降[10-11]。以上观点认为,引起病原菌抗药性的遗传变异是自然突变产生的,病原菌抗药性的产生是由其自身的遗传基础决定的,也就是说在杀菌剂使用之前,在病原菌群体中就存在着抗药性个体,这些抗药性个体通过遗传变异对药剂产生了适应性反应。杀菌剂只是抗药性菌株的强选择剂,而不是抗药性产生的诱变剂。诱导突变观点认为,病原菌主要是在药剂或其他外界因子的作用下发生了可稳定遗传的基因突变或过表达,导致杀菌剂与靶标蛋白的结合力变弱或提高了菌体对药剂的排泄和解毒代谢[10-11]。继而在使用常规剂量的杀菌剂防治植物病害时,大部分敏感菌株被杀死,抗性突变体则在药剂选择下仍然可以继续生长繁殖、侵染寄主,保持较高的适合度。
事实上,以上两种观点兼而有之。因此,在一个新药剂使用之前,为了获得抗性突变体来开展相关研究工作,通常可以通过药剂筛选,以期筛选出田间自然突变的抗药性菌株,但由于田间自然突变的频率很低,往往筛选的难度很大。另外一种方法,则是进行室内抗性突变体的诱导。通常会选择敏感亲本菌株,通过不断提高药剂浓度的方式进行多代驯化,在药剂选择压下病原菌可逐渐产生适应性变异,形成抗药性突变或耐药性修饰,前者抗药性状可以稳定遗传,后者则在药剂选择压消失后菌体会逐步恢复对药剂的敏感性,不可稳定遗传。
通常将通过自然筛选方式获得的田间自然突变的抗性病原菌个体称为抗性菌株;而将通过药剂驯化或者紫外照射等方式,在室内条件下获得的抗性病原菌个体称为抗性突变体。
3 影响抗药性群体形成的因素
抗药性的产生最终是否会导致植物病害化学防治失败,取决于病原菌抗药性个体在群体中所占的比例、绝对数量、抗药水平和适合度等因素[12]。影响病原菌抗药性群体形成的主要因素包括以下几方面。
3.1 病原菌
3.1.1 病原群体中潜在的抗药性个体 由于病原群体中的个体遗传物质存在差异,一些病原群体在药剂登记使用之前已存在极少数抗药性个体,长期使用同类杀菌剂,会抑制或杀死病原群体中比较敏感的部分,而抗药性个体则能生存和繁殖[11]。随着药剂防治效果下降,农户又会增加施药剂量和次数,导致选择压力进一步增加,加速抗药性病原群体的形成。
3.1.2 抗药性遗传特征 抗性病原群体形成的速度与抗药性遗传类型是质量遗传性状还是数量遗传性状有关。通常表现为质量遗传性状的抗药性是单个或几个主效基因控制的,病原群体对药剂的敏感性表现为不连续分布,抗性菌株对药剂的抗性水平往往比较高[13]。具有这类遗传特征的抗性菌株,当其在群体中的抗性频率达到1%~10%时,如继续施药1~3 次,会迅速导致抗药性病原群体形成,导致药剂防效突然下降或失败。表现为数量遗传性状的抗药性是由多基因控制的,病原菌对药剂的敏感性表现为连续分布,随着药剂使用时间延长或剂量提高,病原群体敏感性逐渐向低敏感性方向移动[13]。停止用药后,病原群体的抗药水平逐渐下降。通过比较不同时间所监测到的病原菌群体的敏感性分布情况,可以观测到群体敏感性逐年降低的动态变化。
3.1.3 抗药性突变体的适合度 指在自然环境条件下,抗性突变体与敏感群体在生长、繁殖速率和致病力等方面变化的程度。抗药性病原菌的适合度高低对抗药病原群体的形成具有重要影响[14]。通常,病原菌对大多数杀菌剂产生抗药性变异后,表现不同程度的适合度下降,若停止或减少用药,降低了药剂选择压力,抗性菌株的比例将会下降,不易形成抗药群体[14]。当然,也有些病原菌对药剂产生抗性后,其适合度不会降低[15]。
3.1.4 病害循环 植物地上部发生的病害,通常一个生长季节有多次侵染循环,病部常能产生大量的分生孢子,通过气流或雨水传播。病原菌长时间处于杀菌剂的选择压下,容易产生抗性,而抗药病原菌在药剂选择压下可以继续侵染、繁殖,在较短时间内易形成抗药群体。例如,引起灰霉病、蔬菜霜霉病、白粉病和梨黑星病的病原菌,在甲霜灵、多菌灵和嘧菌酯等药剂使用2~3年后,即可形成抗药群体[16]。而立枯病、猝倒病等土传病害以及锈病等单循环病害,抗性菌株不能在同一生长季节得到大量繁殖和筛选,抗药群体则不易形成或形成较慢。
3.2 杀菌剂类型和作用机制
杀菌剂种类包括直接作用于病原体和间接作用于病原体两种作用方式,其中间接作用药剂较难产生抗药性。直接作用的药剂大体又可分为保护性杀菌剂和内吸性杀菌剂两大类,二者在作用方式、作用机制和抗药性产生的难易程度方面具有明显的差异。作用靶点单一、选择性强的高效内吸性杀菌剂极易因药剂靶标蛋白的关键氨基酸位点发生突变,降低药剂与靶标蛋白结合的亲和性,而表现出抗药性。而传统的保护性杀菌剂,在病原菌中具有多个作用位点,菌体细胞难以同时发生多基因突变而产生抗药性。因此,田间内吸性杀菌剂产生抗药性的风险通常大于保护性杀菌剂。另外,在药剂选择压下,病原菌也可能特异性或非特异性地增强对杀菌剂的转运排泄、解毒代谢能力,但是这类非靶标抗药群体形成较慢,抗药水平较低。根据药剂选择压下病原菌抗药群体形成的速度和抗药水平,杀菌剂的固有抗性风险可分为高、中和低3 种。
3.3 其他因素
3.3.1 农业栽培措施和气候条件 凡是有利于病害发生和流行的作物栽培措施和气候条件,均因病原菌群体数量大,用药水平高,易导致抗药群体形成。例如,同一地区作物品种布局单一、种植感病品种、连作、偏施氮肥和过分密植等都会导致病害发生严重,因而病害防治时药剂用量和施药次数也会相应增加,在不断增强的药剂选择压下,就会加速抗药群体形成。尤其是在温室或大棚栽培条件下,由于环境温湿条件适宜某些病害常年发生,而且封闭的空间内一旦抗药性菌株出现,也很难与外界交换稀释,能迅速形成抗药群体。
3.3.2 是否合理用药 科学合理地使用杀菌剂,既可达到良好的防治效果,又可阻止或延缓抗药性产生。因此,田间是否科学合理使用杀菌剂用于植物病害防治,也是影响病原菌抗药性群体形成的主要因素。建议在病害发生、流行等关键时期用药,减少用药次数;避免在较大范围内使用同类或同种药剂。此外,提倡不同作用机制的杀菌剂混用或轮用。另外,需关注药剂的持效期对于病原菌抗药性的影响。
4 植物病原菌抗药性风险评估
抗药性风险 (resistance risk) 是指因有害生物群体产生抗药性而对农业生产造成不良后果的可能性。根据农药的类别、靶标生物的特性、产生抗性的概率以及抗性产生可能导致的后果可将抗药性风险分成高、中、低3 个级别。
抗药性风险评估 (resistance risk assessment) 则是预测一种新的药剂在田间推广使用后产生抗药性的可能性,以及抗性产生对药剂防治效果和药剂使用周期的影响。目前,我国已经制定了农药抗性风险评估总则和系列病原菌抗药性风险评估标准,在新农药登记之前,在室内可通过药剂驯化或紫外诱变等方法获得病原菌的抗性突变体。结合抗性突变频率、突变体的生物学性状及其对不同作用机制药剂的交互抗药性情况,初步评估某种“病原-药剂”组合发生抗药性的风险[17-18]。室内抗药性风险评估主要包括以下内容。
4.1 药剂特性及敏感基线的建立
明确相关药剂的作用方式、作用机制及其活性和持效期。从未使用相关药剂的多个代表性地区采集分离100 株以上供试菌株,测定其对该杀菌剂的敏感性 (抑制中浓度EC50值或最小完全抑制浓度MIC 值)。野生敏感群体的敏感性频率分布一般呈单峰曲线,其对药剂的EC50值或MIC 值平均值可作为靶标菌对该药剂的敏感基线。
4.2 靶标病原菌产生抗药性的潜能
采用紫外诱变或药剂驯化的方法在室内进行抗性突变体的诱导。靶标病原菌产生抗药性的潜能以抗药性突变频率 (fungicide resistance mutation frequency) 表示,产生抗药性的水平以抗性指数(resistance factor) 表示。抗药性突变频率是指供试靶标病原菌群体中发生与抗药性相关突变的菌株所占的百分比例。抗性指数是指抗药性菌株对该药剂的敏感性 (以EC50或MIC 表示) 与其亲本菌株敏感性或与敏感基线的平均EC50或MIC 的比值。
4.3 交互抗药性
测定相关药剂对敏感菌株和抗性菌株的EC50值,分析该药剂是否与生产上常用药剂之间具有正交互抗药性 (positive cross-resistance) 或负交互抗药性 (negative cross-resistance)。如果病原菌对某一杀菌剂产生抗药性时,也对其他未接触过的杀菌剂表现抗药性,则具有正交互抗药性,也称交互抗药性 (cross-resistance)。如果病原菌对某一种杀菌剂产生抗药性,而对其他未接触过的杀菌剂表现为更加敏感,则具有负交互抗药性。交互抗性分析通常依据Spearman rank correlation 的分析方法,当P>0.05 时,表示两种药剂无交互抗性;当P<0.05 时,|ρ|>0.8 表示两种药剂有强的正或负交互抗性,0.5≤|ρ|<0.8 表示两种药剂有交互抗性,0.3≤|ρ|<0.5 表示存在交互抗性的概率很低,|ρ|<0.3 表示两种药剂无交互抗药性。在上述交互抗药性结果分析中,还需结合抗性表型综合判断以避免特殊情况。
4.4 抗药性菌株的适合度和抗性风险级别分析
测定比较抗药性菌株和敏感菌株 (包括亲本菌株) 的生物学性状差异,包括菌丝生长速率、温度敏感性、繁殖能力、孢子萌发能力及致病力等,分析适合度综合指数。如果抗性群体的适合度与敏感群体 (包括亲本菌株) 相当,则待评估药剂具有一定的抗性风险,若明显高于或低于敏感群体(包括亲本菌株),则相关药剂田间使用后靶标菌对其产生抗药性的风险可能较高或较低。
综合抗药性菌株的突变频率、抗性指数和生物学性状和交互抗药性测定结果,并结合抗药性遗传规律和药剂特性等,综合分析药剂在田间推广使用后产生抗药性的风险,一般分为低等、中等和高等抗性风险。由于抗药性发生受到气候环境条件、农业栽培措施,以及病原菌自身的扩散流行特点的影响[9],所以对于室内抗药性风险评估结果表现为中、高风险的药剂,也仍然具有开发应用价值。例如,葡萄霜霉病菌和黄瓜霜霉病菌对羧酸酰胺类(CAA) 杀菌剂氟吗啉、烯酰吗啉的室内抗性风险评估表现出较高的抗药性风险,但通过合理用药,其在田间使用多年后仍可用于霜霉病的防治[19]。同样,在室内风险评估中表现为中等、高等抗性风险的SDHI 类杀菌剂和QoI 类杀菌剂等,通过制定合理的抗性管理策略,依然在生产上具有广阔的应用前景。因此,杀菌剂的实际抗性风险,需在室内和田间试验相结合的基础上进行综合评估和科学管理。
5 植物病原菌抗药性机制
病原物只要发生单基因或少数寡基因突变就可以导致病原物靶标蛋白结构的改变,从而降低其与药剂的亲和性,这是最常见的抗药性机制;植物病原真菌对杀菌剂抗药性还可由靶标蛋白编码基因过表达引起。另外,有的病原物可通过修饰细胞壁或生物膜的结构,阻止药剂到达靶标位点,减少对药剂的吸收,或者增加对药剂的排泄或代谢解毒,减少药剂在细胞内的积累等表现抗药性[20-21]。
已有研究表明,目前植物病原菌对杀菌剂产生抗药性的机制主要包括以下几种。
5.1 靶标蛋白的关键氨基酸位点突变
靶标蛋白的关键氨基酸位点突变导致靶标蛋白与药剂的亲和性下降,结合力减弱。对于单作用位点的选择性杀菌剂而言,其抗性机制主要由靶标蛋白编码基因的点突变导致,其次由靶标蛋白编码基因的过量表达引起。例如,QoI 类杀菌剂上市两年后,即在田间检测到了小麦白粉病菌对其产生抗性的亚群体[22]。研究发现,与QoI 类杀菌剂抗性产生密切相关的是药剂的靶标蛋白CYTB上G143A 的点突变[23]。G143A 或G143S 的突变也在水稻稻瘟病菌[24]、黄瓜白粉病菌[25]、小麦白粉病菌[26]、瓜类霜霉病菌[27]、葡萄霜霉病菌[28]、香蕉叶斑病菌[29]和苹果黑星病菌[30]等多种病原菌的抗药性菌株中被检测到,并可引起病原菌对QoI类杀菌剂的高水平抗性。同样,甾醇脱甲基抑制剂 (DMI)的靶标蛋白CYP51 发生点突变导致植物病原真菌对DMI 类杀菌剂产生抗性已有广泛报道[31]。例如,在小麦白粉菌[32]、赤霉菌[33]、水稻稻瘟菌[34]、恶苗菌[35-36]、蔬菜灰霉菌[37]和桃褐腐菌[38]CYP51 发生的Y136F 或Y123H 点突变,可以导致病原菌对DMI 类杀菌剂产生抗性。在灰霉病菌中,苯并咪唑类杀菌剂的抗性与β-微管蛋白上的E198A/V/K、F200Y 有关,与此同时,E198K 和F200Y 也可以引起灰霉病菌对微管蛋白抑制剂乙霉威的抗性[39-41]。虽然新一代开发的SDHI 类杀菌剂扩展了杀菌谱,但是随着药剂的连续使用,SDHI 类杀菌剂的抗性发展也随之发生。抗性产生主要与琥珀酸脱氢酶上不同亚基的点突变相关,根据已有报道,多数病原菌的点突变发生在SdhB、SdhC 和SdhD 亚基上[42]。水稻纹枯菌[43]、稻瘟菌[44]、小麦赤霉菌[45-47]、瓜菜灰霉菌[48-50]、早疫菌[51-52]、靶斑菌[53-55]等对SDHI 类杀菌剂的高水平抗药性与SdhB 亚基上P199I、S201L、H248Y突变、SdhC 亚基上A73V、H140R、S141R 和SdhD 亚基上P101T、P109L、H122N、G126V、D133N 的单点突变或多点连锁突变有关;其中,SdhB 亚基上H248Y 点突变出现频率最高。黄瓜霜霉[56]、辣椒疫霉[57-58]、马铃薯晚疫[59]、大豆疫霉[60]和瓜类疫霉[61]等病原卵菌对双炔酰菌胺、烯酰吗啉、丁吡吗啉、氟吗啉等CAA 类杀菌剂的高水平抗药性与纤维素合酶CesA3 亚基上G1105A/V/W、V1109L、F1073L 点突变有关 (图1);对苯酰菌胺、噻唑菌胺的高水平抗药性与β-微管蛋白上C165Y、C239S/L 点突变有关[62-63];对新型焜还原位点抑制剂(QiI)氰霜唑和醌还原位点和氧化位点抑制剂(QioI)唑嘧菌胺的高水平抗性与CYTB 上S33L 或D228N 点突变有关[64];对OSBPI 类杀菌剂的高水平抗性与氧化固醇结合蛋白ORP1 上G770V 等14 种点突变相关 (图2)[15,65]。
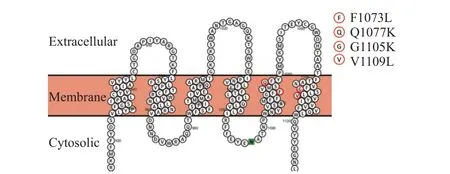
图1 辣椒疫霉菌PsCesA3 上4 种导致CAA 类杀菌剂抗性的点突变[58]Fig. 1 Four point mutations of PsCesA3 causing resistance to CAA fungicides in Phytophthora capsici [58]

图2 致病疫霉PiORP1 上的14 种点突变可导致病原菌对OSPBI 类杀菌剂的高水平抗性Fig. 2 A total of 14 point mutations of PiORP1 causing high-level resistance to OSBPI fungicides in Phytophthora infestans
实际生产中,不同病原菌-杀菌剂组合,其抗药性进化和流行受到了多种遗传动力的影响。例如Chen 等研究表明马铃薯晚疫病菌对甲霜灵的抗性主要由基因变异引起,其抗性相关基因 RPA190在进化中受到正选择作用,且在进化过程中至少出现了两种独立的进化途径(图3)[66];Brunner 等研究表明小麦壳针孢叶枯病菌对三唑类杀菌剂的抗性受到 CYP51 基因变异的作用,且基因重组在近年的欧洲群体抗药中也发挥了作用[67];此外,Cai 等研究表明 大豆疫霉 对 氟吗啉 的抗性发展存在微进化现象,即 在低剂量药剂驯化压力下,疫霉CesA3 蛋白会产生 I1112V 突变(Type I 型),如进一步增加药剂选择压力, 为适应更高剂量CAA类杀菌剂的胁迫,Type I 型低抗突变体将会向Type II~V 型 的高抗突变体进化,发现 病原菌CesA3 蛋白 上除I1112V 突变外,又分别增加了V1110L、G1105A、G1105S 和Q1077H 突变位点(图4)[60]。分析表明,田间 若使用低剂量的氟吗啉防治大豆疫病,病原菌更易产生低抗突变体,进而在药剂的选择压下,将会促进多种类型 高抗突变体 产生,最终导致氟吗啉防效明显下降或失去防效。因此,基于该研究结果,建议在田间通过使用有效高剂量的氟吗啉防治大豆疫病,以有效延缓抗药性产生的科学用药措施。
图3 马铃薯晚疫病菌对甲霜灵的抗性进化途径Fig. 3 Evolutionary network of metalaxyl resistance in Phytophthora infestans

图4 大豆疫霉在氟吗啉使用压力下对CAA 类杀菌剂的抗性及其CesA3 点突变的微进化过程[60]Fig. 4 Stepwise evolution of the CesA3 protein and CAA resistance in Phytophthora sojae exposed to flumorph[60]
5.2 靶标基因的过量表达
已有的研究发现植物病原真菌对杀菌剂抗药性还可由靶标蛋白编码基因过表达引起,其中由CYP51基因过表达导致形成过量的14α-脱甲基酶,进而引起病原菌对DMI 类杀菌剂产生抗药性较为常见。例如,水稻恶苗病菌、番茄灰霉病菌对咪鲜胺、苯醚甲环唑、戊唑醇等药剂的田间抗性菌株中CYP51基因存在过量表达[34,68-70]。指状青霉菌对DMI 类杀菌剂的所有抗性菌株的CYP51序列上游存在一个简单的126 bp 序列的5 次串联重复,而该序列在所有的敏感菌株中只有一次重复,并且抗性菌株CYP51基因组成型表达水平比敏感菌株高100 倍。因此,推测126 bp 序列片段能起到转录增强子的作用,增强了CYP51基因的表达水平,从而导致病原菌对DMI 类杀菌剂产生抗性[71]。另外,有学者研究发现,苹果黑星病菌对腈菌唑的田间抗性菌株中,CYP51基因均未发生点突变,但发现绝大部分抗性菌株的CYP51基因表达水平比亲本菌株高。其中,少量表达水平上升的抗性菌株的CYP51基因上游插入一个553 bp的片段[37],说明除了片段插入引起表达量上升可导致抗性产生外,还有其他机制调控了病原菌对DMI 类杀菌剂的抗性。此外,近期研究发现,灰霉病菌等植物病原菌对DMI 类杀菌剂的抗药性可同时由靶标蛋白点突变和编码基因的过量表达引起[36,72]。
5.3 运输体外排机制
运输体是一类位于病原菌细胞膜上的蛋白结构,可以阻止病原菌细胞内的毒性物质富集达到致死浓度[73]。ABC (ATP-binding cassette) 和MFS(major facilitator superfamily) 复合体蛋白是最具代表性的保护病原菌免受杀菌剂抑制或杀死的运输体[74-75]。已有大量研究报道了ABC 运输体在病原菌多药抗性 (multi-drug resistance) 中发挥着重要作用。在构巢曲霉中第一次检测到由atrB基因编码的ABC 运输体与QoI 类杀菌剂抗性存在相关性,发现该基因过表达可以保护病原菌免受几乎所有供试杀菌剂的抑制作用[75]。灰葡萄孢中报道了14个ABC 转运蛋白,其中3 个蛋白BcatrB、BcatrD、BcatrK 与多药抗性表型相关[76-77]。MFS 转运蛋白在病原菌的多药抗性中也发挥着重要作用,在小麦叶枯病菌的多药抗性相关研究中发现,Mgmfs1基因的启动子序列可发生519 bp 的插入突变,致使该基因编码的转运蛋白过量表达,从而导致其产生多药抗性[78]。另外,鉴定到了2 个MFS 转运蛋白Bcmfs1 和Bcmfs2 在灰葡萄孢的多药抗性表型中发挥作用[79-80]。值得注意的是,该运输机制引起抗性的病原菌往往表现出多药抗性的现象。
5.4 代谢解毒机制
有的病原菌能够将杀菌剂代谢成为没有杀菌毒性的化合物,从而对药剂产生抗性。已有研究报道,立枯丝核菌抗性突变体能够将抑霉唑代谢成为没有活性的化合物[81]。有的抗性菌株丧失了将杀菌剂代谢成具有较高活性化合物的能力,如三唑酮在敏感菌株中被代谢成三唑醇才能起到更好的杀菌活性,而在抗性菌株中这种代谢作用被阻止[82]。近期的研究发现,以立枯丝核菌和辣椒疫霉为代表的病原真菌和卵菌可通过解毒代谢,对解偶联剂氟啶胺和新型杀菌剂双苯菌胺 (SYP-14288)产生高水平抗性[83-84]。解偶联剂双苯菌胺可通过诱导立枯丝核菌P450和GST基因过表达来增强病原菌的解毒代谢进而引发多药抗性;而辣椒疫霉则通过P450 参与的解毒代谢和P-gp基因过表达介导的药剂外排,从而表现出对解偶联剂双苯菌胺的抗性[84-85]。另外,水稻稻瘟病菌也可通过上调表达P450 基因引起对新型嘧啶胺类杀菌剂的抗性[86]。
5.5 补偿作用或旁路氧化途径
旁路氧化途径最初发现于植物体内,后来在病原菌中发现其是病原菌对QoI 类杀菌剂产生抗药性的原因之一。交替氧化酶 (alternative oxidase,AOX) 是该过程的关键酶,能接受辅酶Q (CoQ)传来的电子直接传递给氧生成水,而不经过复合物Ⅲ和复合物Ⅳ[87-89]。QoI 类杀菌剂因AOX 酶被诱导表达而产生抗药性也有报道,在室内通过紫外诱变获得的抗嘧菌酯的小麦叶枯病菌,其抗性倍数约为10,加入2 mmol/L 的AOX 酶抑制剂水杨肟酸 (SHAM) 后可使其恢复对嘧菌酯的敏感性,表明抗性突变体的AOX 酶被诱导表达是病原菌对嘧菌酯产生抗性的原因[90]。另外,QoI 类杀菌剂可以诱导水稻稻瘟病菌AOX 酶过量表达从而启动旁路氧化途径,病原菌表现出抗药性。AOX 酶过量表达不能在后代稳定遗传,转代培养10 代或加入100 μg/mL 水杨肟酸后,突变体重新表现为敏感[91]。因此,QoI 类杀菌剂诱导AOX 酶的过量表达也是该类杀菌剂产生抗性的原因之一。
此外,随着杀菌剂的大量使用,目前已有双重或多重抗性的菌株陆续报道,该类菌株有别于多药抗性菌株,其抗性机制主要是由于两种或两种以上不同作用机制的杀菌剂靶标蛋白同时或先后发生位点突变而引起的抗性,称为多重抗药性(multiple resistance)。例如,已有研究报道了对MBC 和DMI 类药剂表现双重抗性的部分桃褐腐病菌是由β-微管蛋白上E198A 的点突变和CYP51的过量表达引起[92]。灰霉病菌对5 种不同作用机制药剂表现的多重抗性,分别由其靶标蛋白的点突变引起[93]。
6 植物病原菌抗药性检测和监测方法
由于病原菌抗药性不容易被肉眼识别,必须通过精密测定才能鉴别和诊断,因此,自1970 年代选择性杀菌剂被广泛应用以来,快速、灵敏的病原物抗药性诊断检测方法和技术一直是各国植物病理学领域研究开发的重点之一。
6.1 病原菌抗药性检测和监测
抗药性检测 (resistance detection) 是指通过常规的生测手段或分子生物学技术判断病原群体中是否存在抗性菌株及抗药菌株的出现频率。通常是对用药水平较高的地方临时采集标本进行测定。抗药性监测 (resistance monitoring) 是测定田间植物病原群体对使用药剂的敏感性变化,主要是在各地定点连年系统测定,观察抗药群体的发生发展动态。
6.2 抗性监测的目的和意义
1) 明确病原菌抗药性群体的发生动态,预测抗药性的发展趋势。 2) 证实田间药剂防治效果下降是否与病原菌抗药性的产生有关。 3) 评估抗药性风险管理措施的有效性。 4) 指导田间科学交替或轮换用药,及时指导抗药性治理策略的修改和完善。
6.3 常用的抗药性监测方法
目前已经建立了多种常规生测方法和分子检测技术,适用于不同场景下病原菌抗药性监测。主要检测和监测方法和技术介绍如下:
6.3.1 病原菌对药剂敏感性测定的常规生测方法
包括离体测定法和活体测定法。离体测定法主要测定病原菌生长量或孢子萌发率与药剂的效应关系,包括菌落生长速率抑制法、干重法、孢子萌发法、浊度法等;但DMIs 等许多内吸性杀菌剂并不影响孢子萌发,这时应该考虑对芽管形态和菌体发育的作用[94-95]。活体测定方法适合专性寄生菌的抗药性检测,是指将病原菌接种到经杀菌剂处理过的植株或叶片等植物组织上,评估药剂处理剂量与发病程度间的效应关系。
6.3.2 抗性菌株的常规鉴别方法 在测定某种病原菌不同个体对不同浓度杀菌剂的敏感性后,如何进一步鉴别和评估它们的抗药性,常用的标准有3 种:
1) 使用同一质量浓度测定药剂对敏感或抗性菌株的菌落生长抑制率,根据试验结果和活体防治效果,划分抗性菌株的标准[96-97](表1)。

表1 甲霜灵抗性划分标准Table 1 Metalaxyl-resistance division criteria
2) 测定最低抑制浓度MIC (minimum inhibition concentration),采用区分计量法,在含有完全能抑制野生敏感菌株生长的杀菌剂浓度的培养基平板上,涂布病原菌混合孢子或接种其他繁殖体,进行适当培养后,检查病菌的生长情况,计算抗药性菌株的出现频率% (获得的抗药性菌体数量 ×100/用于抗药性监测的病原菌群体数量总和)。该方法相对省时省力,适合在短时间内检测大量菌株群体。
3) 建立敏感基线方法:通过测定某一地区用药前病原群体 (一般需测100 个菌株) 对药剂的敏感性分布,建立敏感基线,获得用药前病原群体对药剂的平均EC50值,也称为病原菌对该药剂敏感基线的平均EC50值。用药后再测定病原群体的敏感性,由此可根据平均EC50之比 (田间抗性菌株的EC50/田间敏感基线的平均EC50) 来评估某一地区病原群体的抗性水平 (resistance level,RL)。
6.3.3 抗性菌株的分子检测方法 以上常规检测方法简便易行,但工作量大、消耗的人力资源和材料较多,检测周期长,从病原菌分离到抗药性鉴定长达一周甚至数周,且在病原菌培养过程中存在杂菌污染,而且这种方法检测灵敏度低,要求抗药性菌株的突变频率在1% 以上。近20 多年来,随着核酸相关分子检测技术的发展,限制性片段长度多态性PCR (PCR-RFLP)、等位特异PCR (AS-PCR)、环介导等温扩增反应 (LAMP) 和定量PCR 等分子检测方法被成功用于病原菌抗药性群体监测。分子检测技术为植物病原菌的抗药性监测提供了快速、灵敏、准确的优势,使病原菌的抗药性早期监测和预警成为可能。例如,研究人员针对多菌灵和乙霉威抗性菌株中β-微管蛋白F200Y 的点突变和E198V/K 的点突变,开发了AS-PCR 和PCR-RFLP 分子检测技术,用于田间抗性菌株的快速检测鉴定[98]。我国科研工作者也针对因病原菌靶标位点突变导致的多种病原菌对内吸性杀菌剂的抗药性,建立了AS-PCR、PCR-RFLP 和LAMP 方法检测田间抗性菌株的技术体系,与传统方法相比,分子检测方法可缩短检测时间、提高工作效率,而且提高了检测的灵敏度,检测频率在10-5~10-4,更适用于检测低频率的抗药性基因,因此也被作为田间抗药性早期诊断的理想方法[99-103]。因此,分子检测技术将在病害的可持续管理系统中发挥愈来愈重要的作用。
1) 等位特异PCR (AS-PCR):由于病原菌靶标基因发生了与抗药性相关位点突变,据此可进行等位特异性引物设计,即正向引物的最后一位碱基即为在抗性菌株中检测到的碱基突变位点,在该引物的倒数第二位处人为引入一个错配碱基,以提高引物的特异性,并结合不同退火温度进行扩增筛选,最终获得在抗性和敏感菌株之间具有识别度的最适退火温度。使用该对引物仅能从抗性菌株中扩增到特异性片段。例如,大豆疫霉β-微管蛋白编码基因第716 位碱基的点突变G716C可导致C239S 的氨基酸突变,这是引起大豆疫霉对苯酰菌胺抗药性的原因[62]。根据此突变位点设计了一对错配引物,在67 ℃的退火温度下,以一对非特异性引物为参照,使用该对引物分别对苯酰菌胺表现抗性和敏感的菌株进行扩增,在抗性突变体中均可以扩增出预期的条带,而在敏感菌株中均没有扩增出预期的条带 (图5A);而使用非特异性引物无论在对苯酰菌胺表现抗性还是敏感的菌株中,均能扩增出预期的条带 (图5B)[99]。

图5 (A) AS-PCR 引物在67 ℃时检测大豆疫霉对苯酰菌胺的敏感菌株和抗性突变体情况; (B) 非特异性引物对在敏感菌株和抗性突变体中的扩增情况[99]Fig. 5 (A) Amplification results of AS-PCR primers for zoxamide-resistant and -sensitive Phytophthora sojae at 67 ℃; (B) Amplification results of non-specific primers on sensitive strains and resistant mutants[99]
2) 限制性片段长度多态性PCR (PCR-RFLP):由于靶标蛋白编码基因上抗药性相关的点突变导致了酶切位点的改变,包括增加、减少或位点替换,从而导致抗性和敏感菌株PCR 扩增片段DNA 酶切产物的片段长度多态性发生了差异性变化。例如,导致的辣椒疫霉对氟噻唑吡乙酮的抗药性的氧化固醇结合蛋白上G769W 的杂合突变,其编码基因上增加了1 个Pf1MI 酶切位点,即抗性菌株中靶标基因上有3 个酶切位点,从而导致Pf1MI 酶对抗性菌株和敏感菌株PCR 产物酶切片段数量发生改变 (图6)[15]。另外,大豆疫霉对苯酰菌胺产生抗药性后,β-微管蛋白上发生了C239S的氨基酸位点突变,导致PmlI 酶切位点被替换为BmgBI 酶切位点,便可以使用PmlI 和BmgBI 分别同时酶切敏感菌株和抗性突变体的β-微管蛋白编码基因产物。这样,敏感菌株的β-微管蛋白基因产物只能被PmlI 酶切成两个片段,而抗性突变体的β-微管蛋白编码基因产物只能被BmgBI 酶切成两个片段[99]。

图6 快速鉴定辣椒疫霉PcORP1 基因核苷酸点突变及其对氟噻唑吡乙酮抗药性的PCR-RFLP 方法[15]Fig. 6 A PCR-RFLP method for rapid identification of nucleotide point mutations in the PcORP1 gene conferring to oxathiapiprolin resistance in Phytophthora capsici [15]
3) 环介导等温扩增反应 (LAMP):该技术针对靶基因的6 个区域设计4 种特异引物,利用一种链置换DNA 聚合酶在等温条件 (65 ℃左右) 保温30~60 min,即可完成核酸扩增反应[100]。在LAMP的反应过程中,DNA 聚合酶发挥聚合作用,改变质子数量进而改变pH 值,阴性反应结果和阳性反应结果显色不同,肉眼可见 (图7)。LAMP 方法的最大特点是实现恒温扩增,不需要循环仪、凝胶成像系统等昂贵的仪器;扩增反应极快,一般在1 h 内完成;通过肉眼即可判定结果;灵敏度高、特异性强;操作简便、快捷,适于病原菌突变基因型的快速鉴定及检测[101-103]。

图7 LAMP 引物组在68 ℃ 45 min 条件下可检测出PcORP1 上G700V 突变的抗性突变体[103]Fig. 7 The LAMP primer set can detect the resistant mutants with G700V mutation in PcORP1 at 68 ℃for 45 min[103]
6.4 病原菌抗药性监测中应注意的问题
6.4.1 敏感基线建立和敏感性测定 建立重要防治对象对常用药剂的敏感基线,是监测田间重要病原菌抗药性的发生和发展动态的基础。某种杀菌剂-病原菌组合的抗性监测,不但要选用适当的方法和条件进行,而且抗药性监测所有方法必须与建立敏感基线所用的方法和条件相同。用于病原菌敏感性测定的药剂应尽可能使用高含量的杀菌剂原药,避免使用市售的制剂,以防止助剂等成分影响测定结果的准确性。
6.4.2 抗药性监测的样本量要求 抗药性群体的田间检测/监测,采集和测定靶标病原菌的标本数量,根据测试目的不同而异。如果病原群体中抗性产生情况未知,供试的菌株数量合理基数应该达100 个以上。如估计自然群体中有1%的菌株产生抗药性,测定这一比例的1%和5%的显著水平,需采集458 个和298 个标本;如估计群体中有10%的菌株具有抗性,只需要采集44 个和28个标本,则可满足这一比例的显著水平。因此,若想在抗药性发生早期通过监测来预警抗药性发生,则要测定大量标本,从田间用药水平高的地区随机采集10~20 个样本进行分离和测定,进一步检测抗性菌株和敏感菌株的致病力,开展杀菌剂防效试验,以明确同等药剂剂量下,杀菌剂对抗性菌株和敏感菌株导致的病害防效上的差异。
7 植物病原菌抗药性风险管理
抗药性风险管理 (resistance risk management)是指针对抗药性风险采取延缓或抑制靶标生物抗药性发展,避免对农业生产造成不良后果的策略和措施。
7.1 病原菌抗药性治理策略制定的目的和一般原则
制定杀菌剂抗性治理策略的目的,就是以科学的方法,最大限度地阻止或延缓病原菌对杀菌剂抗性的发生和抗药病原群体的形成,延长药剂使用周期和货架寿命,确保田间病害化学防治的效果。因此,根据抗药病原群体形成的主要影响因素,针对性地设计抗药性治理策略,这是基本原则。
1) 综合考虑所有与抗药性发生相关的影响因子。病原菌抗药性的产生和抗性群体形成是与病原菌特点、杀菌剂特点、作物抗病状况、栽培环境、生长条件、农事操作措施等多种内在或人为因素综合作用的结果。因此,抗药性的治理应从这些因素出发,建立药剂、病原菌和寄主相互作用的参数,积极利用一切可人为控制的因素,阻止或延缓病原菌对杀菌剂抗药性的产生和发展。
2) 采取有害生物综合治理。利用轮作、抗性品种、生物防治以及其他有利于减轻有害生物发生和危害的非化学防治措施,减少化学农药的使用。同时,重视杀菌剂的科学用药,尽可能地降低化学药剂对病原菌的选择压。
3) 产品标签上标注抗性风险级别。在杀菌剂推广应用之前,进行早期抗药性风险评估,预测病原菌产生抗药性的潜在风险,并在产品标签上标注抗性风险级别。这有助于在田间出现实际抗药性导致药剂防效下降之前,指导生产中及早采用预防性的抗药性治理策略。
4) 防治期间开展病原菌的抗药性监测。建立每一组杀菌剂和防治对象的敏感性基线和抗性监测方法,这是抗药性鉴别和监测的基础。根据监测结果,明确病原菌对杀菌剂抗药性的产生和发展情况,在实践中进一步调整、补充和完善抗性治理策略。
7.2 抗药性治理的短期策略
新药剂一旦开发成功,从进入市场前的潜在风险评估至生产实践中全程应用期间,对于中、高风险的药剂,均应提前采取抗性风险管理措施。同时,我国不同地区的马铃薯晚疫病、黄瓜霜霉病、蕃茄灰霉病、瓜类白粉病、梨黑星病和苹果轮纹病等已对一些重要的内吸杀菌剂,如苯并咪唑类、苯基酰胺类、二甲酰亚胺类、唑类、甲氧基丙烯酸酯类和琥珀酸脱氢酶抑制剂等产生了不同程度的抗药性。因此,病原菌的抗药性治理策略也同时包括了预防性的管理策略和治疗性的治理策略。
杀菌剂抗性治理的短期策略包括以下5 个方面:
1) 建立重要病原菌对常用药剂的敏感性基线,建立有关技术资料数据库。
2) 检测/监测田间重要病原菌抗药性的发生和发展动态,建立抗药性病原群体流行测报系统,指导及时调整和完善抗性治理策略。
3) 了解新药剂的作用机制和病原菌产生抗药性机制,建立病原菌抗药性的高通量分子检测和预警技术。
4) 评估“新药剂-新防治对象”组合产生抗药性的潜在风险等级,及早采取合理的抗性风险管理措施。同时,应防止试验中获得的抗药突变体被人为释放到自然界中。
5) 科学合理用药,降低药剂选择压,延缓抗药性发生或抗药群体的形成,包括选择有效的施药剂量、控制施药次数、选择关键时期用药,并与不同机制药剂合理混用或轮用等。
7.3 抗药性治理的长期策略
杀菌剂抗性治理的长期策略包括以下5 个方面:
1) 研发高活性的选择性杀菌剂。在确保传统的保护性杀菌剂有一定量的生产和应用的同时,根据病原菌与药剂非靶标生物之间的生理生化差异,创制、开发和生产不同类型的安全、高效、专化性杀菌剂,贮备更多的具有新型作用机制的高活性杀菌剂品种,有利于科学合理地安排杀菌剂的混用、轮用和交替使用。同时,随着植物病理学和杀菌剂药理学等领域科学研究的深入,还可能发现更多的对于病原菌生长发育和致病力具有重要作用的关键蛋白,可作为潜在的杀菌剂靶标蛋白,进一步开展以分子靶为导向的高活性靶向农药的创制。同时,需要更加关注植物免疫激活剂 (诱抗剂) 的研究和开发。这类药剂虽然对病原菌没有直接的杀菌或抑菌活性,但可以通过诱导植物产生抗病性,提高植物的免疫能力来抵御病原菌的侵染,从而在田间表现出防病效果。
2) 开发具有负交互抗药性的杀菌剂。使用具有负交互抗性的药剂,延缓抗药性的发展。选择负交互抗性药剂品种时,要有足够的试验数据证明药剂之间具有负交互抗性。例如,对苯并咪唑类杀菌剂有负交互抗性的苯-N-氨基甲酸酯类的乙霉威目前已在全球生产和应用,也成为治理抗药性的一种有效途径[104-105]。然而,并不是所有对多菌灵产生抗性的病原菌都对乙霉威敏感,在E198A、E198Q 和F200Y 共3 类抗性菌株中,仅发生E198A突变的抗性菌株对苯并咪唑类杀菌剂和乙霉威存在负交互抗性。另外,发现在乙霉威和多菌灵的双重选择压力下,易产生对两种药剂的双抗菌株。例如,在我国番茄灰霉病菌中已经检测到了既抗多菌灵又抗乙霉威的抗药群体[106]。
3) 科学复配和轮换用药。在全面了解杀菌剂的生物活性、作用方式、作用机制以及防治靶标的抗性发生状况及其抗药性分子机制的基础上,科学选用杀菌剂有效成分,研制具有延缓病原菌抗药性的混剂配比和制剂产品。例如,具有多作用位点的保护性杀菌剂与单一作用位点的内吸性杀菌剂复配,可增加杀菌剂对病原菌的作用位点,避免短时间内病原菌对内吸性杀菌剂的单一突变发生选择性突变,而导致抗药性的产生。另外,可以选用不同作用位点或抗性机制的内吸性杀菌剂进行复配。例如,戊唑醇和十三吗啉均可抑制麦角甾醇生物合成并对白粉病有效,但其作用靶标不同,戊唑醇影响14α-C 的去甲基,十三吗啉阻止Δ8→Δ7异构反应,两种有效成分复配后,既可提高防效,又有利于延缓抗药性的发生[107]。
4) 综合治理。提倡在病害防治中采用综合防治措施,利用抗性品种、生物防治、生态调控等有利于减轻有害生物发生和危害的非化学防治措施,同时重视杀菌剂的科学用药,尽可能地降低化学药剂对病原菌的选择压力。
5) 回顾修正。及时总结评估抗药性治理策略,不断进行完善,建立具有生产指导性的病原菌抗药性风险管理方法和模型。
随着高选择性和高活性的新型杀菌剂不断涌现,植物病原菌抗药性问题也将长期存在。因此,需进一步加强对新药剂和新防治对象开展抗药性风险评估,制定抗药性管理策略,建立再评价机制。同时,提高各级农业行政管理部门、农药企业、植保推广部门及使用者等对病原菌抗药性的认识和密切合作,科学实施抗药性的风险管理。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

刘西莉,女,二级教授,博士生导师。1991 年毕业于北京农业大学应用化学系并留校工作,先后获得中国农业大学植物病理系硕士、博士学位;2005—2006 年在丹麦哥本哈根大学植物科学系作学术访问学者;2007—2017 年为中国农业大学植物病理系教授;2017 年至今,任西北农林科技大学国家人才发展计划特聘教授。重点围绕“植物病原菌与杀菌剂互作的理论与病害控制技术”进行科学研究,主要研究方向:1)卵菌重要基因功能研究及药物潜在分子靶标发掘;2) 植物病原菌与杀菌剂互作的分子基础;3)植物病原菌抗药性风险评估及抗性治理;4)主要农作物风险性种传、土传病害诊断和防控技术。曾先后荣获国家“科学技术进步二等奖” 3 项,发表科技论文 200 余篇,授权发明专利 37 项,牵头制定了系列“杀菌剂抗性风险评估”行业标准。荣获国家“万人计划”领军人才、农业部“农业科研杰出人才以及创新团队”及科技部 “中青年科技创新领军人才等称号。现任《农药学学报》副主编。
