基于重构NDRV σC 蛋白的间接ELISA抗体检测方法的建立
2022-10-21林伟东孟利佳阴雅洁乔思娜倪维玲侯绍华徐倩倩董世山
武 华,林伟东,孟利佳,阴雅洁,乔思娜,倪维玲,侯绍华,徐倩倩,董世山,5*
(1.河北农业大学 动物医学院,河北 保定 071001;2.上海交通大学 医学院,上海 200025;3.中国农业科学院 北京畜牧兽医研究所,北京 100193; 4.河北创安生物科技有限公司,河北 保定 071001;5.农业部动物疫病病原生物学华北科学观测实验站,河北 保定 071001)
新型鸭呼肠孤病毒(novel duck reovirus,NDRV)为正呼肠孤病毒属(呼肠孤病毒科,刺突呼肠孤病毒亚科),作为一种新出现的病毒,不同于以往的番鸭呼肠孤病毒(muscovy duck reovirus,MDRV)和禽呼肠孤病毒(avrian reovirus,ARV)。MDRV也称鸭正呼肠孤病毒,于1972年首次从法国番鸭中分离出来[1]。但MDRV的经典病毒分离株对北京鸭幼鸭和1日龄鸡并无致病性[2]。2005年后,我国东南地区番鸭主产区陆续发生了一种新的番鸭传染病,以肝脾出血坏死为主。该病的病原体被确认为一种新型的番鸭呼肠孤病毒(new type of MDRV,N-MDRV)[3]。从死亡的北京鸭身上分离出的这种新型的呼肠孤病毒,在试验室感染时未导致死亡或出现明显的临床症状[4]。但在2011 年,我国在北京鸭体内分离出一种可能由N-MDRV演变而来的病毒。这种新分离的病毒对1日龄番鸭具有高致病性,鸭胚在感染后 48~72 h内死亡,死亡胚胎表现出肝脏肿胀。通过电镜观察病原体为球形、带刺的病毒颗粒,与呼肠孤病毒科家族成员的颗粒一致。该分离株被命名为DRV-TH11,我国将该类病毒正式定为NDRV[5]。
与先前所报道的所有 DRV 感染相比,NDRV 感染表现出明显不同的生物学特征,包括更高的毒力和更广泛的宿主物种[6]。目前 NDRV 的进化来源依旧并未有确凿的证据和结论,根据基因组信息显示[7],与MDRV和ARV的基因组相似,除了S1、M2以及S3基因外,NDRV其余7个基因都是与MDRV具有更高的同源性。因此其进化来源更可能是在MDRV的骨架上,部分基因与ARV或其他病毒发生交换重组而产生的新病毒。其中包括S1基因中新产生的P18蛋白[8],类似于ARV中的核质穿梭蛋白P17[9-11],提示这可能是导致NDRV扩大宿主范围的原因。同样在 S1 基因中编码的外衣壳蛋白 σC 具有极重要生物学功能,可诱导机体产生中和抗体,但它在 MDRV 和 ARV 中的同源性低,表明 NDRV 中的 σC 蛋白已产生高度变异[12]。基于 σC 编码基因核苷酸序列的系统发育树,可将NDRV与MDRV和ARV进行鲜明分类[13],因此,利用 σC 差异性和其在NDRV中的特异性,可用于检测 NDRV 感染。且由于 σC 蛋白为 NDRV 的外衣壳蛋白[14],在机体受病毒感染后的免疫应答中,更容易诱导机体产生特异性抗体。
现阶段我国大部分水禽养殖地区都已出现 NDRV 感染,但感染 NDRV 的成年鸭群初期并无明显症状[15],且容易造成垂直传播,而目前也没有相应成型的商品化试剂盒可用于检测NDRV抗体,给临床诊断带来困难。本课题组先前的研究以包涵体形式的 σC 蛋白作为研究对象[16],本研究优化其基因序列和改善表达条件后,收获大量可溶性表达的 σC 蛋白,并利用其建立更高灵敏性和特异性的间接ELISA(indirect ELISA,iELISA)方法用于 NDRV 检测。与全病毒 iELISA 共同检测大量质控血清后发现,其符合率为100%,且 σC 蛋白包被板弥补了全病毒包被板检测样品D值低的缺点。
1 材料与方法
1.1 毒株、载体、菌体及血清NDRV流行株、pET-32a(+)由河北农业大学保存;Trans BL21 感受态细胞购自北京全式金生物技术有限公司;NDRV 质控阳性血清为免疫后的鸭血清由河北农业大学保存;DRV、ARV、DTMUV、IBV阳性血清均由河北农业大学保存。
1.2 主要试剂Easy pure Viral DNA/RNA Kit 购自北京全式金生物技术有限公司;Gel Extraction Kit 胶回收试剂盒、Plasmid Mini Kit Ⅰ质粒提取试剂盒均购自 OMEGA 公司;蛋白Marker、QuickCutTMBamHⅠ、QuickCutTMXhoⅠ均购自 TaKaRa 公司;BSA 试剂盒购自碧云天公司;HRP山羊抗鸭IgG 购自 Abbkine 公司;抗体稀释液、双组份 TMB 显色液购自 Solarbio 公司;血清由河北农业大学保存。
1.3 重组蛋白的表达和纯化根据 GenBank 登记的 NDRV(MT598196)基因组序列,搜索 S1 中的 σC 基因序列,通过 DNAStar软件对其进行分析,并根据大肠杆菌密码子偏嗜性规律对基因片段进行密码子优化,在基因片段两端分别加上BamHⅠ和XhoⅠ限制性内切酶识别位点,优化后的基因片段交由金斯瑞生物科技有限公司进行合成。利用BamHⅠ和XhoⅠ将合成的基因片段定向克隆入原核表达载体pET-32a(+)相应位点之间,获得重组质粒pET-32a-NDRV-σC。重组质粒转化入Trans BL21 感受态细胞中,将含有 pET-32a-NDRV-σC 的菌液接种到含有 Amp+的LB液体培养基中,37℃ 180 r/min 振荡培养至D450值0.6~0.8,而后分别加入IPTG至终浓度0.10,0.25,0.50,1.00 mmol/L 16℃诱导15 h。分别收集菌液进行超声破碎后,12 000 r/min 离心5 min,弃上清,用40 μL PBS 重悬沉淀,加入8 μL 5×loading buffer,煮沸10 min 后进行 SDS-PAGE 电泳,观察蛋白表达情况。根据蛋白纯化试剂盒说明书对表达的蛋白过 His 柱纯化后,再进行阴离子交换柱进一步纯化。将纯化好的蛋白送上海启研生物科技有限公司做质谱分析鉴定。
1.4 NDRV iELISA方法的建立采用方阵滴定法分别确定最佳抗原包被浓度和样品稀释度,再优化二抗工作浓度和显色反应时间等,最后根据D450值和P/N值建立iELISA方法。
1.4.1阴阳临界值的确定 NDRV 84 份质控阳性血清、180份质控阴性血清按照最佳样品稀释度稀释后进行i ELISA 检测,测定D450值,计算阳性百分比(P%=待检样品D450值/阳性对照平均值D450值×100%)。使用 GraphPad Prism 8.0软件对检测结果进行统计分析,使用非参数法构建 ROC 曲线,以特异性和灵敏性最高值时作为此方法的阴阳性临界值,并确定该方法的特异性和灵敏性。
1.4.2特异性检测 使用本研究建立的iELISA方法分别检测DRV、ARV、DTMUV、IBV的阳性血清,同时以 NDRV 的阳性血清做阳性对照,每个样品做3个重复孔,从而验证此方法的特异性。
1.4.3重复性检测 制作3批试剂盒(分别命名为20210501,20210511,20210521),使用质控阳性血清(P1、P2、P3)和质控阴性血清(N1、N2、N3、N4、N5)分别测定试剂盒批内和批间重复性。
1.4.4全病毒包被板与 σC 蛋白包被板比较性试验 由于目前市场没有检测 NDRV的试剂盒来进行比较,因此使用实验室先前建立的NDRV iELISA检测方法[16](利用差速离心纯化后的 NDRV作为包被抗原)和本研究建立的检测方法进行比较。通过分别检测84份质控阳性血清和180份质控阴性血清,比较两种检测方法的差异性。
2 结果
2.1 重组蛋白的表达纯化收集诱导后的菌体,用 PBS 进行重悬后超声破碎,离心后分别取上清和沉淀制样,在终浓度 0.25 mmol/L IPTG的条件下,16℃ 诱导15 h后,σC 蛋白在上清获得最大的表达量,出现明显的蛋白条带,大小约为 37 kDa,与预期相近。而后大量表达并进行纯化,SDS-PAGE 结果显示,利用镍柱亲和层析纯化后去除了大量杂蛋白。经阴阳离子交换柱进一步纯化后成功获得大小约为 37 kDa,纯度大于 90% 的 σC 目的蛋白(图1),经 BSA 蛋白定量后,每升菌液可纯化出约32 mg 蛋白。纯化后的蛋白进行质谱鉴定后确定为 σC 蛋白。表明通过对翻译过程和诱导条件的优化,可以实现 σC 蛋白可溶性表达,利用该类纯化方法可成功获得纯度良好的 σC 蛋白。

M.蛋白Marker;1.上清中的 σC 蛋白;2.沉淀中的 σC 蛋白;3.穿透;4.5% Eloution Buffer;5.Eloution Buffer滤液;6.Eloution Buffer;7.穿透;8.阴阳离子交换柱纯化后的 σC 蛋白
2.2 NDRV iELISA方法的建立通过方阵滴定法对各组的研究,最终确定的最佳试验条件为:抗原包被质量浓度0.5 μg/孔,最佳样品稀释度1∶320。优化后的最佳二抗工作浓度1∶10 000,底物反应时间30 min。
2.3 阴阳临界值的确定对84份质控阳性血清和和180份质控阴性血清进行检测,结果显示阳性血清和阴性血清分布在2个明显不同的范围之内(图2)。使用GraphPad Prism 8.0 软件分析检测结果并绘制灵敏性和特异性相关的ROC曲线(图3)。通过 Youden 指数选择灵敏性和特异性最佳的P值作为阴阳临界值。本研究中,曲线下面积为1.00,P=0.076,此时的特异性和灵敏性均为100%。
A.丰度分布特征;B.从头测序验证
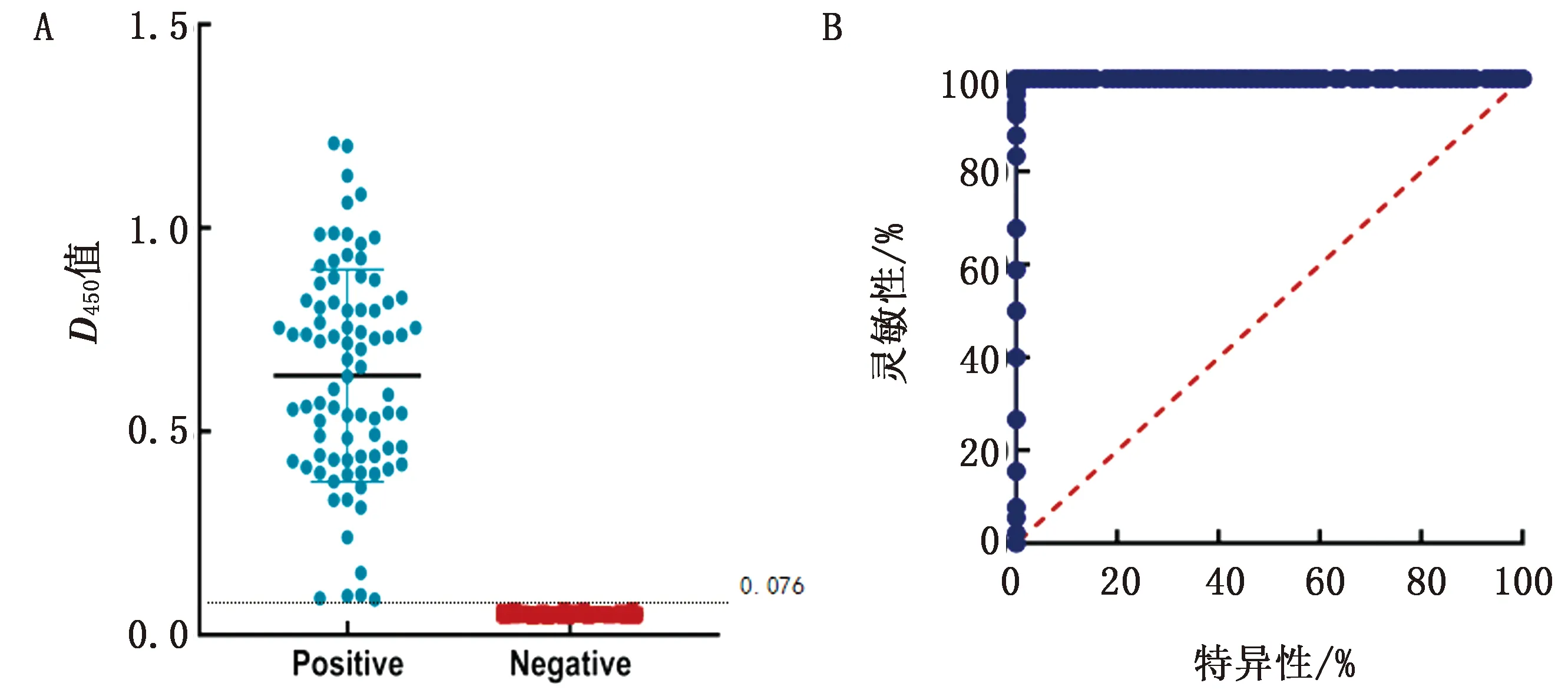
A.样品D450值的点状分布;B.ROC曲线
2.4 特异性试验采用本研究建立的 iELISA 方法分别检测 DRV、ARV、DTMUV、IBV 的阳性血清,与NDRV 阳性血清做阴阳性对照,每个样品重复检测3次,结果显示本研究建立的 iELISA方法检测 DRV、ARV、DTMUV、IBV 阳性血清时均显示为阴性(表1),说明此方法具有良好的特异性。
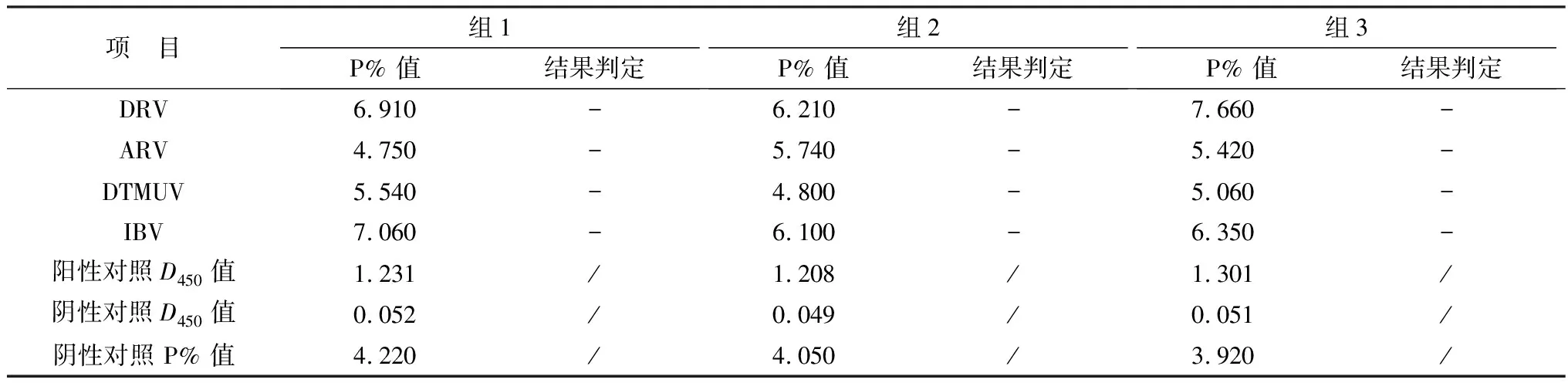
表1 特异性试验检测
2.5 重复性试验本研究建立的 iELISA方法批内变异系数最高为8.56%,批间变异系数最高为6.27%,均小于10%,说明建立的方法具有良好的重复性(表2,3)。

表2 批内重复性结果

表3 批间重复性结果
2.6 全病毒包被板与 σC 蛋白包被板比较在检测的84份阳性质控血清与180份阴性质控血清中,全病毒包被板检测出阳性 84份,阴性 180份;σC 蛋白包被板检测出阳性84份,阴性180份,两种包被板检测符合率为100%(表4)。其中,全病毒包被比 σC 蛋白包被时检测到的D450值低,前者弱阳性的P/N为 1.2,而后者弱阳性的P/N为 4.1。

表4 全病毒包被板与 σC 蛋白包被板比较结果
2.7 iELISA方法的临床应用本实验室保存的50份经RT-PCR检测的临床样本中,其中从肝脏中扩增出NDRV的有38份,12份为阴性。
将这50份样品所对应的血清,用本研究建立的iELISA方法进行检测,结果显示35份为阳性,15份为阴性。与先前RT-PCR的检测结果比较,两种检测方法符合率为90%(表5)。

表5 iELISA方法的临床应用结果
3 讨论
由于感染 NDRV 的鸭群早期不会出现特异性症状,常用的实验室诊断技术,如RT-PCR、荧光定量RT-PCR、RT-LMAP和免疫荧光(IFA)等方法操作复杂、设备昂贵并不适用于基层应用,因此迫切需要一种快速、灵敏的检测方法[17-18]。ELISA 试剂盒操作简单,特异性和灵敏性良好,同时能检测大批量样品的优点适用于大型水禽养殖业,但现阶段中国暂无成型的NDRV ELISA试剂盒。本研究建立的iELISA方法,操作简单、特异性和灵敏性均表现良好,为 NDRV 临床诊断及疫苗免疫抗体监测提供科学有效的血清学检测方法。
iELISA 方法对多种疾病的诊断均表现出良好的特异性和灵敏性,将其用于 NDRV 上也有较好的效果。近年来有许多学者建立了关于 NDRV 的iELISA 检测方法。随着对 NDRV 分子生物学研究深入,通过表达 NDRV 相关蛋白来建立 ELISA 检测方法成为研究趋势,其中对 σB 和 σC 蛋白的研究最为深入[19-22]。σC 蛋白为病毒的外衣壳蛋白,主要以同源三聚体的结构形式存在,对病毒吸附、增殖和形成合胞体起重要作用,同时能诱导机体产生群特异性中和抗体[23-24]。然而在以往的研究中,关于 σC 蛋白的原核表达都以包涵体的形式存在,导致蛋白在纯化环节操作较为复杂,且在变性复性过程中易失败或蛋白纯化量较低,以包涵体形式存在的蛋白免疫原性比可溶性蛋白差[25]。为了表达出可溶的、免疫原性强的 σC 蛋白,本研究在不改变氨基酸序列的前提下,按照大肠杆菌密码子偏嗜性规律设计合成了 σC 蛋白基因片段。另一方面,σC 蛋白在NDRV病毒内主要以同源三聚体形式成为结构蛋白[26],本身具有形成多聚体的内在条件,同时由于T7启动子的强启动效应[27],过快地表达可能导致蛋白的不正确折叠或形成包涵体。因此本研究选用低温和低诱导剂的办法同步降低表达速率以促进其可溶性的表达。最终在0.25 mmol/L IPTG和16℃诱导15 h后,获得最大可溶性表达的 σC 蛋白,1 L菌液纯化后可收获约32 mg σC 蛋白。σC蛋白被认为是诱导机体产生NDRV中和抗体的最重要蛋白[28],而本研究改善的大量表达可溶性σC 蛋白方法,为NDRV亚单位疫苗的制备提供简便高效的途径。
将 σC 蛋白用于建立iELISA检测方法,经方阵滴定法确定以0.5 μg/孔包被酶标板,且最佳样品稀释度为1∶320,探索最佳阴阳临界值,该值的确定对整个方法的建立和后期样品的检测至关重要[29-30],主要表现在它的变化对应着灵敏性和特异性在检测中互为增减,但二者在检测最佳值具备最高的统一性,因此可以利用统计学方法探索最佳临界值。本研究通过对84份阳性和180份阴性质控血清进行检测,对结果进行统计分析后,绘制了与特异性和灵敏性相关的 ROC 曲线来选择合适的阴阳临界值为0.076,此时的灵敏性和特异性均为100%。由于 NDRV 与 DRV 和ARV都属于同种属病毒,有相似的形态学特征,其中与 ARV血清型最为相似,包括最常见的禽类疾病如 DTMUV、IBV 等的抗血清都可能在检测过程中与其产生交叉反应[31]。本研究中,选取来源明确的多种血清使用建立的 ELISA 方法进行重复检测,结果表明本方法能有效区分多种传染病与 NDRV,充分表明本研究建立的 NDRV iELISA 方法具有良好的特异性。
全病毒作为包被抗原时可以结合病毒不同抗原或抗原表位产生相应的抗体,而单一蛋白作为包被抗原时只能结合相应抗体,因此以全病毒包被板建立间接 ELISA 方法要比蛋白包被板效果好[32]。本研究采用的全病毒包被板是使用经差速离心纯化后的 NDRV 病毒以20 μg/孔进行包被的,检测质控样品后其检测结果与 σC 蛋白包被板检测结果进行比较,全病毒包被板阳性对照D450值比 σC 蛋白包被板值高,但样品检测数值中,σC 蛋白包被板比全病毒包被板高,其全病毒包被板的弱阳性P/N值约为1.2,σC 蛋白包被板的弱阳性P/N值约为4。出现这种差异的原因可能是因为 σC 蛋白为外衣壳蛋白,比其他蛋白更易诱发机体识别,甚至产生更高的抗体,而全病毒包被板可检测到除 σC 蛋白外的其他编码蛋白,或纯化的病毒可能有其他杂质,从而导致抗原与抗体并不能很好地结合。
本研究改善了表达可溶性 σC 蛋白方法,可应用于未来 NDRV亚单位疫苗的制备。并利用其成功建立了检测 NDRV 抗体的iELISA 方法,具有良好的特异性和灵敏性,弥补了全病毒包被板检测样品D值偏低的缺点。为水禽养殖场提供了可靠的 NDRV ELISA 检测方法,也为未来关于NDRV的检测提供了参考。
