猪圆环病毒2,3,4型三重荧光定量PCR检测方法的建立和应用
2022-10-21谢荣辉王雅婷安慧婷张红丽冯肖肖陈伟良董建斐赵灵燕
谢荣辉,王雅婷,安慧婷,黄 靖,张红丽,刘 霞,冯肖肖,陈伟良,董建斐,张 璐,徐 辉,赵灵燕
(浙江省动物疫病预防控制中心,浙江 杭州 310018)
猪圆环病毒(porcine circovirus,PCV)为无囊膜、单链环状DNA病毒,属于环状病毒科环状病毒属成员[1]。目前PCV包括猪圆环病毒1型(porcine circovirus type 1,PCV1)、2型(PCV2)、3型(PCV3)和4型(PCV4)4个血清型别,其中PCV1对猪无致病性[2]。PCV2感染可引起断奶仔猪多系统衰竭综合征、繁殖障碍、呼吸道疾病综合征及皮炎肾病综合征等[3]。PCV3可引起猪只心脏和多系统炎症、皮炎肾病综合征、仔猪消瘦、腹泻及母猪繁殖障碍等[4-5]。PCV4感染可引起猪只呼吸道和肠炎症状及皮炎肾病综合征等[5-6]。目前各种型别PCV在我国均有存在,且部分猪只存在着不同型别PCV共感染现象[7-11]。由于PCV2、PCV3和PCV4引起的临床症状非常相似,因此需建立一种快速、敏感及特异的检测方法来区分各种型别PCV和其他病毒的感染。荧光定量PCR检测技术具有快速和灵敏等优点,已广泛应用于人类和动物传染病病原体检测中。本研究旨在建立一种同时可检测PCV2、PCV3和PCV4三重荧光定量PCR检测方法,为PCV的诊断和防控研究提供技术支持。
1 材料与方法
1.1 样品和病毒株猪口蹄疫病毒(foot and mouth disease virus,FMDV)灭活疫苗、猪瘟病毒(classical swine fever virus,CSFV)活疫苗、猪细小病毒(porcine parvovirus,PPV)灭活疫苗及猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)疫苗为中牧实业股份有限公司产品;PCV2灭活疫苗为浙江诗华诺倍威生物技术有限公司产品。以上疫苗经核酸提取核酸后均可获得相应病毒核酸。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)和猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)由本实验室分离保存;猪伪犬病病毒(pseudorabies virus,PRV)、PCV3、PCV4和PCV1病毒核酸含量高的阳性样品经鉴定后由本实验室保存。
1.2 主要试剂和仪器pGEM-T Easy Vector Systems 购自Promega公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自生工生物工程(上海)股份有限公司;质粒抽提试剂盒Mini BEST Plasmid Purification Kit、DNA凝胶回收试剂盒MiniBEST Agarose Gel DNA Extraction Kit、Ex Taq酶、DL2000 DNA Marker、DH5α感觉态细胞和X-gal均为大连宝生物工程有限公司产品;QuantiNova Multiplex PCR Kit为Qiagen公司;病毒核酸提取试剂盒MagNA pure 96 DNA and viral NA Small Voume Kit为Roche公司产品。荧光定量PCR仪(型号Lightcycler480)为Roche公司产品;PCR仪(型号TProfessional)为德国Biometra公司产品;冷冻高速离心机(型号5430R)为Eppendorf产品;超微量紫外分光光度计(NanoDrop2000)为Thermo公司产品。
1.3 引物的设计与合成根据GenBank中PCV2、PCV3和PCV4的保守序列设计引物和探针(表1)。引物和探针均由生工生物(上海)工程有限公司合成并标记。

表1 PCR检测所用引物和探针
1.4 病毒核酸的提取用病毒核酸提取试剂盒MagNA pure 96 DNA and viral NA Small Voume Kit按照仪器操作说明书方法提取病毒核酸,将获得的病毒核酸保存于-80℃冰箱中备用。
1.5 PCV2、PCV3和PCV4重组质粒的制备根据GenBank中PCV2、PCV3和PCV4基因序列,设计合成引物(表2)分别扩增含PCV2、PCV3和PCV4荧光定量PCR检测基因的核酸片段,具体操作如下:分别以上述病毒核酸为模板进行PCR反应,反应体系50 μL:10×Ex Taq Buffer 5 μL,dNTP 4 μL,Ex Taq(5 U/μL)0.25 μL,上游引物P1(20 μmol/L)1 μL,下游引物P2(20 μmol/L)1 μL,模板 5 μL,无RNA酶水 33.75 μL。反应条件:95℃ 2 min;98℃ 10 s,52℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。将扩增的目的片段回收后克隆于pGEM-T Easy载体中构建含目的基因的重组质粒,构建的重组质粒分别命名为T-PCV2、T-PCV3和T-PCV4,并送上海生工生物工程技术有限公司进行测序鉴定。利用紫外分光光度计测定重组质粒浓度,并计算拷贝数。

表2 PCV2、PCV3和PCV4荧光定量PCR检测引物
1.6 反应体系优化以重组质粒为检测模板,利用矩阵法对探针和引物浓度进行优化。
1.7 特异性试验利用所建立的荧光定量PCR方法对PCV1、PCV2、PCV3、PCV4、CSFV、PEDV、TGEV、FMDV、PPV、PRRSV和PRV核酸进行检测,同时设阴性对照,评价方法的特异性。
1.8 PCV2、PCV3和PCV4三重荧光定PCR检测方法敏感性评价和病毒标准曲线的建立分别将重组质粒T-PCV2、T-PCV3和T-PCV4作10倍倍比稀释,采用本研究所建立的荧光定量PCR方法进行检测,确定最低检出模板拷贝浓度。并对检测结果以反应体系中重组质粒终浓度的对数和Ct值分别为x轴和y轴绘制标准曲线。
1.9 重复性试验分别以反应体系中终浓度为106,105,104,103和102拷贝/μL的重组质粒T-PCV2、T-PCV3和T-PCV4为模板,利用所建立的荧光定量PCR方法进行检测,每个稀释度的同一模板均进行4次批内和批间重复试验,并计算批内及批间的平均值、方差及变异系数。
1.10 临床样品检测猪组织样品用PBS稀释研磨,离心后取上清,提取病毒核酸,利用所建立的荧光定量PCR和普通单重PCR方法(扩增引物见表3)[5,8-9]对采自浙江省部分地区的83份猪组织样品进行检测。

表3 PCV2、PCV3和PCV4普通单重PCR检测引物
2 结果
2.1 反应体系优化采用矩阵法对引物和探针浓度进行优化,PCV2、PCV3和PCV4引物在反应体系中的最佳终浓度分别为0.4,0.4,0.6 μmol/L,PCV2、PCV3和PCV4探针在反应体系中的最佳终浓度分别为0.25,0.25,0.4 μmol/L。反应条件为:95℃ 2 min;95℃ 5 s,60℃ 30 s,45个循环;60℃收集荧光。
2.2 特异性试验对PCV1、PCV2、PCV3、PCV4、CSFV、PEDV、TGEV、FMDV、PPV、PRRSV和PRV的检测结果显示,PCV2、PCV3、PCV4分别在波长618~660,533~580,455~510区间出现了扩增曲线(图1)。而其他病毒核酸和阴性对照在这3个波长区间均无扩增曲线出现,表明建立的PCV2、PCV3和PCV4三重荧光定量PCR检测方法与PCV1、CSFV、PEDV、TGEV、FMDV、PPV、PRRSV和PRV无交叉反应,且PCV2、PCV3和PCV4之间无交叉反应,具有良好的特异性。
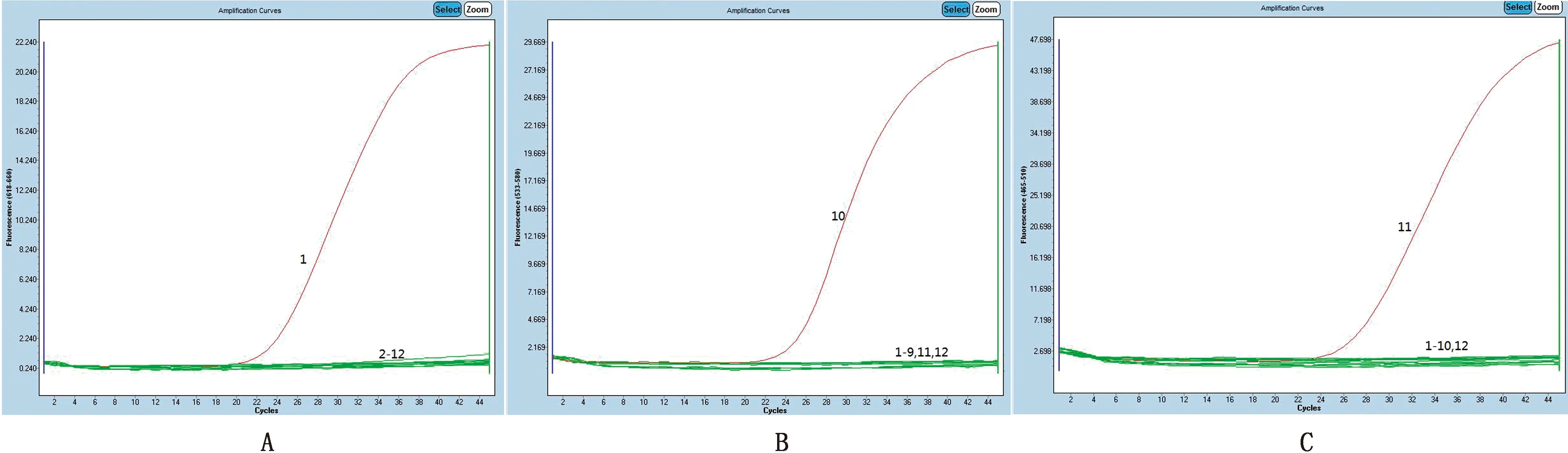
1.PCV2;2.PPV;3.CSFV;4.PRRSV;5.PCV1;6.PRV;7.FMDV;8.PEDV;9.TGEV;10.PCV3;11.PCV4;12.阴性对照
2.3 标准曲线的建立和敏感性评价以不同稀释度的重组质粒(T-PCV2、T-PCV3、T-PCV4)为模板进行荧光定量PCR扩增,得出扩增曲线(图2),并建立荧光定量PCR标准曲线(图3)。结果显示,PCV2、PCV3和PCV4荧光定量PCR标准曲线相关系数R2分别为0.995 9,0.992 8,0.995 8,都具有良好的线性关系。敏感性试验结果表明,PCV2、PCV3最低检测值均为10 拷贝/μL。而PCV4最低检测值为1 拷贝/μL。

1.106拷贝/μL;2.105拷贝/μL;3.104拷贝/μL;4.103拷贝/μL;5.102拷贝/μL;6.10拷贝/μL;7.1拷贝/μL;8.10-1拷贝/μL;9.阴性对照

图3 PCV2(A)、PCV3(B)、PCV4(C)扩增标准曲线
2.4 重复性试验分别以反应体系中终浓度为106,105,104,103,102拷贝/μL的重组质粒(T-PCV2、T-PCV3、T-PCV4)为模板,对每个稀释度的模板分别进行4次批内和批间重复检测,结果显示同一模板不同浓度的批内和批间变异系数均在3%以内,表明所建的荧光定量PCR方法具有良好的重复性和稳定性(表4)。

表4 PCV2、PCV3、PCV4三重荧光定量PCR方法重复性试验
2.5 临床应用评价分别利用本研究建立的PCV2、PCV3和PCV4三重荧光定量PCR检测方法、PCV2普通PCR检测方法、PCV3普通PCR检测方法和PCV4普通PCR检测方法对83份猪组织样品进行检测,检测结果显示建立的PCV2、PCV3和PCV4三重荧光定量PCR检测方法与PCV2、PCV3和PCV4单重PCR检测方法阳性符合率分别为100%,95.82%,94.51%,具有较高的一致性,准确率较高(表5)。

表5 PCRV2、PCRV3、PCRV4三重荧光定量PCR与普通PCR方法检测临床样品结果(n=83)
3 讨论
近年来,PCV新的型别被不断发现,2016年首次报道在猪皮炎和肾综合征中检出PCV3[12],2019年我国学者在湖南患病猪中检出PCV4[6]。研究表明PCV2已在世界范围内流行,给养猪业带来了巨大的经济损失[13-14];PCV3在中国、美国、波兰,巴西、西班牙、意大利和瑞典等国家被报道存在并致病[8,10,12,15-18];PCV4目前也已在我国多个省份存在并流行[2,6,19-21]。多种型别PCV的流行和共同存在,给该类疫病的检测和监测造成了巨大困难,虽然目前国内外学者已建立了PCR、荧光定量PCR及数字PCR方法等核酸检测方法应用于PCV的检测,但大部分只针对1或2种以内PCV,为了更加准确、快速地检测各种PCV,本研究建立了基于TaqMan探针的PCV2、PCV3和PCV4三重荧光定量PCR检测方法,该检测方法可同时对PCV2、PCV3和PCV4进行检测,对PCV2、PCV3和PCV4检测下限分别10,10,1 拷贝/μL,具有较高的灵敏度,优于以前报道的PCR方法和荧光定量PCR检测方法,且具有通量高、快速和操作简便等优点。临床样品检测结果表明PCV2、PCV3和PCV4三重荧光定量PCR检测方法与单重PCR检测方法具有高度的一致性,可应用于临床样品的检测。
利用建立的三重荧光定量PCR检测方法对采自浙江省部分地区的83份组织样品进行检测,结果显示PCV2、PCV3和PCV4单一病毒感染的样品阳性率分别为68.67%,27.71%和20.48%,PCV2和PCV3共同感染的样品阳性率为26.51%,PCV2和PCV4共同感染的阳性率为19.28%,PCV3和PCV4共同感染的样品阳性率为6.02%,PCV2、PCV3和PCV4这3种病毒共同感染的样品阳性率为6.02%。此结果表明浙江省部分地区各种型别PCV在猪群中具有较高的感染率,且存在着不同型别PCV共同感染的现象,这与国内前期报道一致。
