神经脉管浸润联合肿瘤间质比对结直肠癌预后的预测价值
2022-10-21邱佳辉蔡谦谦程非池裘正军
邱佳辉,蔡谦谦,杨 彦,程非池,裘正军#,黄 陈#
1.南京医科大学附属上海一院临床医学院,上海 211166;2.上海交通大学医学院附属第一人民医院胃肠外科,上海 201600
结直肠癌(colorectal cancer,CRC)是全球范围内高发的恶性肿瘤,2020年全球新增CRC患者约193万人,占新增癌症总人数的10%,位居世界第三位;新增CRC 相关死亡患者约93.5 万人,占新增癌症死亡总人数的9.4%,居世界第二位[1]。据中国国家癌症中心2022 年发布的癌症研究报告显示,CRC 的发病率和病死率分别居恶性肿瘤的第二位和第四位[2]。目前国际公认的CRC 分期标准是肿瘤-淋巴结-转移(tumor-node-metastasis,TNM)病理分期系统。根据TNM 分期系统制定治疗计划,仍有许多患者出现肿瘤复发转移,且同一病理分期患者的预后也存在差异。因此,需要有新的指标对TNM 分期系统进行补充和完善,以指导CRC患者的治疗。
脉管浸润(lymphovascular invasion,LVI)是指肿瘤侵犯血管和淋巴管。大量研究表明LVI 与CRC的不良预后有关,文献[3-4]报道CRC中LVI阳性率为5.2%~30.3%。神经浸润(perineural invasion,PNI)是指肿瘤细胞沿着神经纤维方向生长并且包绕神经纤维周长33.3%以上,或肿瘤细胞浸润神经纤维的神经鞘进入神经束膜内。研究表明PNI 是影响CRC 患者预后的独立危险因素,阳性率约为18.2%[5-6]。肿瘤间质比(tumor-stroma ratio,TSR)是指肿瘤组织内肿瘤实质和肿瘤间质的面积比值, 最早由MESKER[7]提出,发现该指标能预测CRC 的预后。我们研究发现LVI阳性、PNI阳性、高TSR的CRC是一类发生率低但预后不良的CRC。本研究探讨了神经脉管浸润联合TSR 评估CRC 预后的作用,并挖掘其在CRC预后预测中的价值。
1 对象与方法
1.1 研究对象
收集2014 年1 月—2018 年12 月在上海交通大学医学院附属第一人民医院(Shanghai General Hospital,SGH)行普外科手术,术后病理标本检查明确诊断是CRC 的患者948 例,对患者的临床信息、病理资料和随访结果等数据进行回顾性分析,同时收集组织芯片(tissue microarray,TMA)队列的106 例CRC病理样本进行验证。
纳入标准:①年龄≥18 周岁,具有自主行为能力。②行根治性手术切除。③手术标本经病理学诊断后确诊为CRC。④患者拥有完整的可供分析使用的临床病理资料和随访数据。排除标准:①术前曾行新辅助治疗或其他抗肿瘤治疗。②既往有CRC 病史或曾经患有其他恶性肿瘤[8]。
1.2 方法
1.2.1 仪器与试剂 苏木精-伊红(hematoxylineosin,H-E)染色试剂购自上海生物试剂公司,石蜡切片机购自德国徕卡公司,KF-PRO-120 数字切片扫描仪购自中国宁波江丰生物信息技术有限公司。
1.2.2 病理切片制作 术中取出的标本用福尔马林溶液固定,之后用石蜡将标本包埋,使用石蜡切片机将标本制成5 μm 厚的切片,再进行H-E 染色,使用数字切片扫描仪扫描切片,生成全视野数字病理切片(whole-slide image,WSI),利用K-Viewer 软件浏览图片[9]。
1.2.3 LVI 评估 LVI 是指H-E 染色切片中发现肿瘤浸润淋巴管或者血管;肿瘤细胞周围有明确的内皮细胞 环 绕[10]。本 研 究948 例 患 者 中LVI 阳 性312 例,LVI阴性636例。
1.2.4 PNI 评估 PNI 是指H-E 染色切片中发现肿瘤侵犯邻近的周围神经(肿瘤细胞沿着神经纤维方向生长并且包绕神经纤维周长33.3%以上),或肿瘤细胞浸润神经纤维的神经鞘进入神经束膜内[11]。PNI 阳性257例;PNI阴性691例。
1.2.5 TSR 评估 在H-E 染色切片中选择肿瘤侵袭最明显的区域,首先放大20 倍使图片可视化,然后选择具有代表性的区域进一步放大至40 倍,选择的区域需确保四周均有肿瘤实质,将肿瘤间质尽可能多的区域作为感兴趣区域(region of interest,ROI),评估TSR 数值(如果评分视野内包含黏液坏死组织,要将黏液坏死组织区域排除),使用MATLAB 开发的算法计算TSR 数值(我们的既往研究[12]证实算法计算的TSR 数值比人工读取的更加准确)。本研究以算法最优值41.3%为cut-off值,根据TSR cut-off值将患者分为“高TSR 组”(TSR>41.3%)和“低TSR 组”(TSR≤41.3%)[12]。高TSR 474例,低TSR 474例。
1.3 随访
所有CRC 患者通过门诊或电话等方式进行随访,术后2年内每3个月进行一次随访,术后3~5年每6个月进行一次随访。总生存时间(overall survival,OS)定义为从手术日至死亡日(全因死亡)或随访结束日,随访结束日期为2019年7月。
1.4 统计学方法
运用SPSS 25.0 软件进行统计学分析。符合正态分布的定量资料采用表示,采用t检验;不满足正态分布的资料用M(Q1,Q3)表示,采用Mann-WhitneyU检验;定性资料用n(%)表示,采用χ2检验、校正χ2检验或Fisher 确切概率法。生存分析采用Kaplan-Meier 法,显著性分析采用Log-rank 检验。采用单因素和多因素COX 回归模型确定影响预后的独立危险因素。P<0.05表示差异有统计学意义。
2 结果
2.1 CRC的分组依据
研究结果发现:随着PNI、LVI 和TSR 等高危因素叠加,CRC 不良预后的风险显著提高(P=0.023,P=0.003,P=0.001;表1);且随着高危因素的累积,患者总体预后越差(HR:3.564>2.604>2.037);患者术后死亡风险随着高危因素的叠加而不断提升(P=0.000,图1)。因此本研究将LVI、PNI、TSR 这3 个指标均呈现阳性者归为高风险组(即LVI 阳性、PNI阳性、高TSR),其余为低风险组。
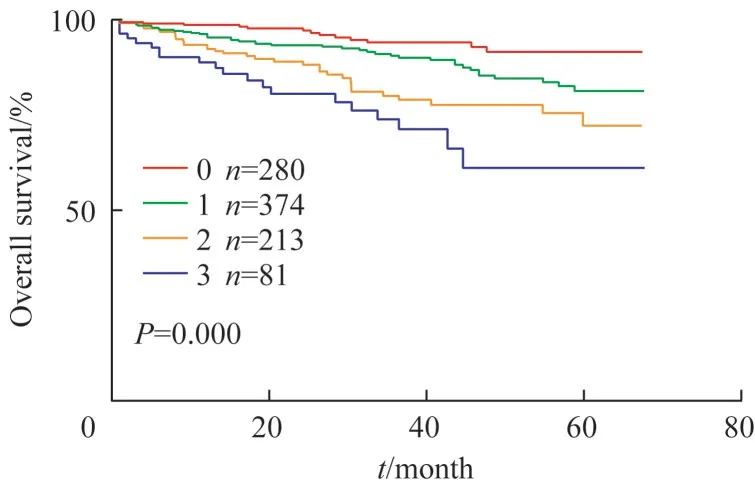
图1 CRC的Kaplan-Meier生存分析曲线Fig 1 Kaplan-Meier survival analysis for CRC
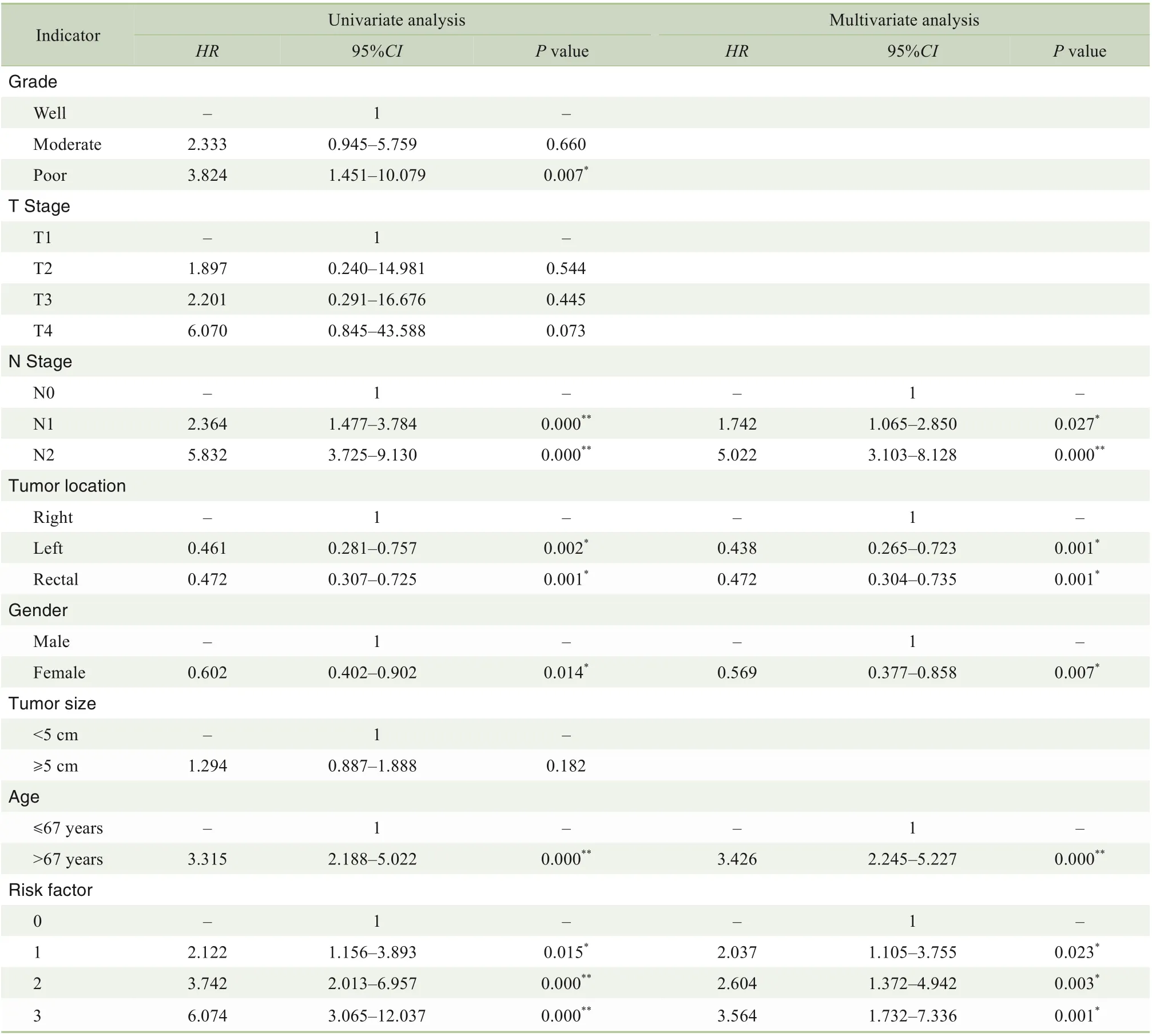
表1 CRC总体生存率影响因素的单因素和多因素COX分析Tab 1 Univariate and multivariate COX analysis of influencing factors for overall survival of CRC
2.2 高风险组CRC的临床病理特征分析
研究入组的948 例患者中,T1 期38 例,T2 期148例,T3期202例,T4期560例;N0期583例,N1期221 例,N2 期144 例;年龄24~89 岁,中位年龄66.0 岁,其中≤67 岁525 例,>67 岁423 例;男性548例,女性400 例;高分化82 例,中分化729 例,低分化137 例;肿瘤长径≥5 cm 358 例,<5 cm 590 例;右半结肠308例,左半结肠257例,直肠383例;LVI阳性312 例,LVI 阴性636 例;PNI 阳性257 例,PNI 阴性691 例;高TSR 474 例,低TSR 474 例;高风险组81例,低风险组867例。其中高风险组患者,肿瘤分化更差(P=0.037);随着TNM 分期的增加患高风险CRC 的危险也随之增高(P=0.000),且当肿瘤浸润程度增加,PNI、LVI 和高TSR 的发生风险也随着增加(P=0.014);当CRC 发生淋巴结转移时,高风险CRC 的发生风险显著增加(P=0.000);男性CRC 患者比女性更易发生神经脉管浸润和高TSR (P=0.009,表2)。

表2 高风险与低风险患者临床病理因素相关分析[n(%)]Tab 2 Correlation analysis of clinicopathological factors between high-risk and low-risk patients[n(%)]

续表
2.3 CRC的风险因素分析
将单因素COX分析结果中的危险因素纳入多因素COX比列风险模型后,我们发现高风险组患者预后显著更差,高风险分组指标是影响CRC预后的独立危险因素(表3)。考虑到回顾性研究中混杂因素对研究结果的干扰,使用SPSS软件进行1∶1的病例匹配,匹配条件:年龄差距小于6岁,T分期、N分期、肿瘤部位、性别、肿瘤大小保持一致。对低风险和高风险组CRC患者进行匹配,筛选出高风险组67例,低风险组67例。COX多因素研究发现,高风险分组指标是CRC预后的独立危险因素,匹配后HR升高(2.380>2.078),说明高风险组较未匹配前有更好的预后预测能力(表4)。对TMA数据进行单因素和多因素COX分析显示,高风险分组指标是影响CRC预后的独立危险因素(表5)。

表3 CRC总体生存率影响因素的单因素和多因素COX 分析(SGH未匹配队列)Tab 3 Univariate and multivariate COX analysis of influencing factors for overall survival of CRC(Unmatched queue of SGH)

表4 CRC总体生存率影响因素的单因素和多因素COX 分析(SGH匹配队列)Tab 4 Univariate and multivariate COX analysis of influencing factors for overall survival of CRC(matched queue of SGH)
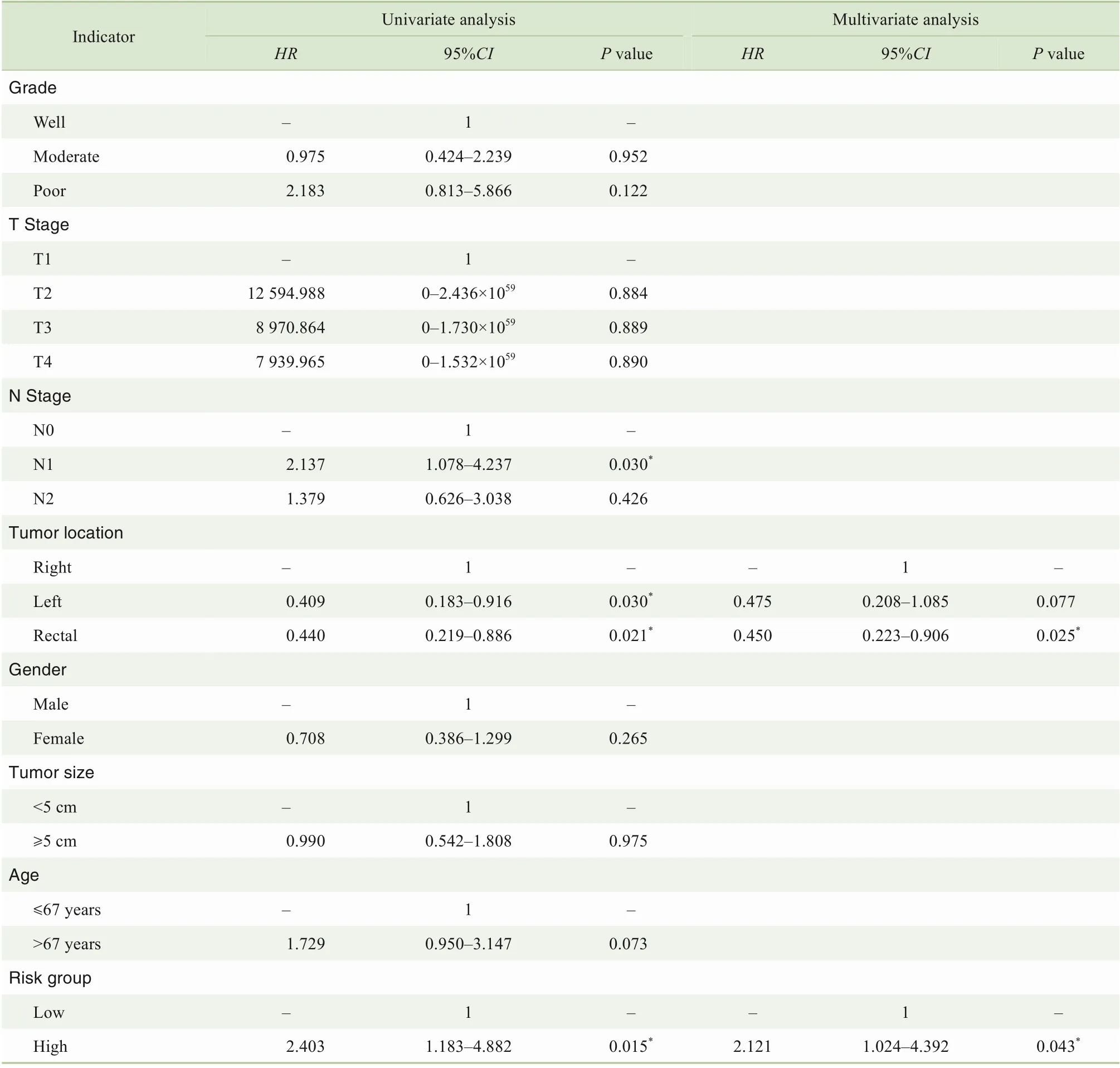
表5 CRC总体生存率影响因素的单因素和多因素COX分析(TMA队列)Tab 5 Univariate and multivariate COX analysis of influencing factors for overall survival of CRC(TMA cohort)
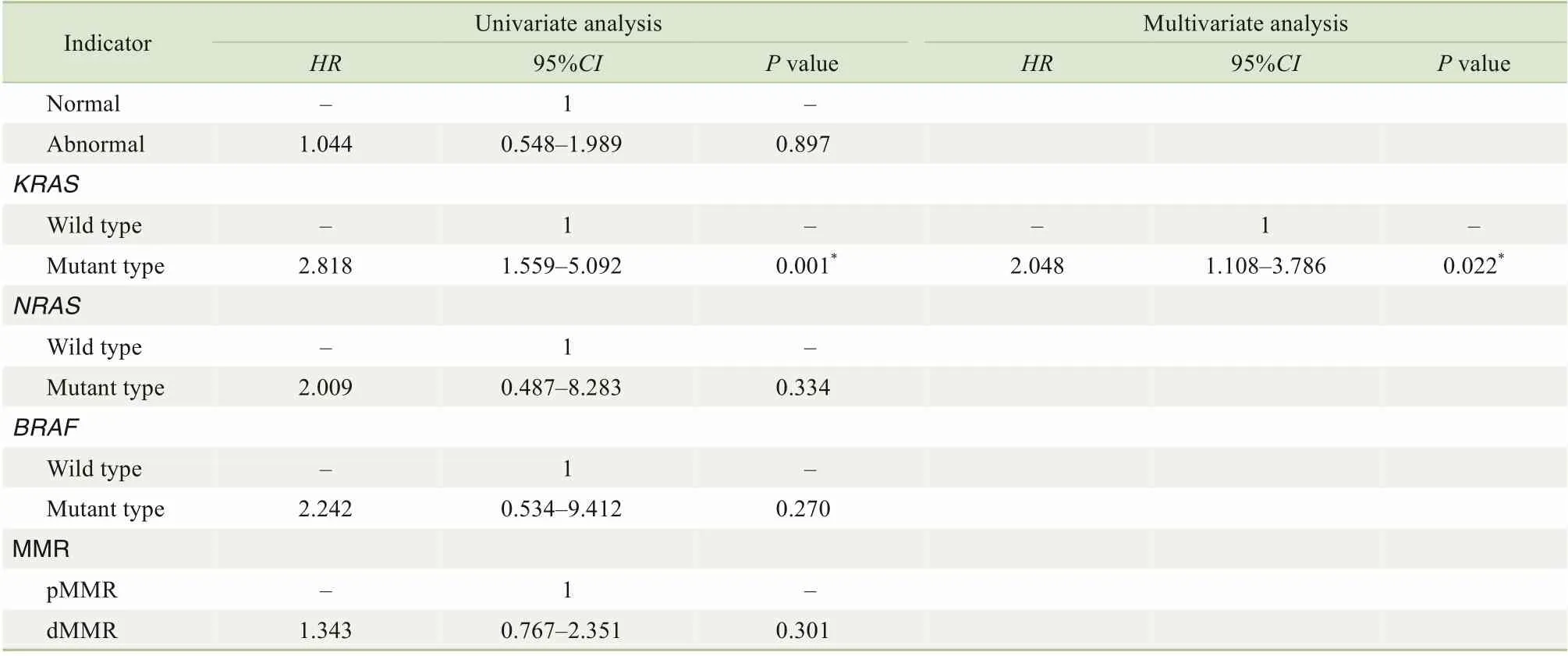
续表
2.4 CRC的生存分析
SGH 队列中显示,高风险组患者81 例,低风险组患者867 例,高风险组比低风险组显示出更差的预后(P=0.000)。经过对SGH 队列的配对后,高风险组患者67 例,低风险组患者67 例,结果仍然显示高风险组患者预后更差(P=0.027),以TMA 数据进行验证发现,高风险CRC 仍然预后不良(P=0.012,图2)。对不同原发部位CRC 的分层分析发现,在不同肿瘤部位中高风险组均表现出不良的预后。左半结肠和右半结肠的生存分析表明高风险组预后不良(P=0.003,P=0.001)。虽然直肠中高风险组未表现出更差的预后(P=0.065),但是生存曲线仍然可以看出高风险组不良预后的表现趋势(图3)。在对Ⅱ、Ⅲ期CRC 患者的分析表明,Ⅱ期高风险CRC 患者的预后不良(P=0.001)。在Ⅲ期患者中也有类似Ⅱ期患者的表现趋势,虽然在生存分析时未表现出明显的差异(P=0.123,图4)。

图2 高风险组与低风险组的Kaplan-Meier生存分析曲线Fig 2 Kaplan-Meier survival analysis for overall survival of high-risk group and low-risk group
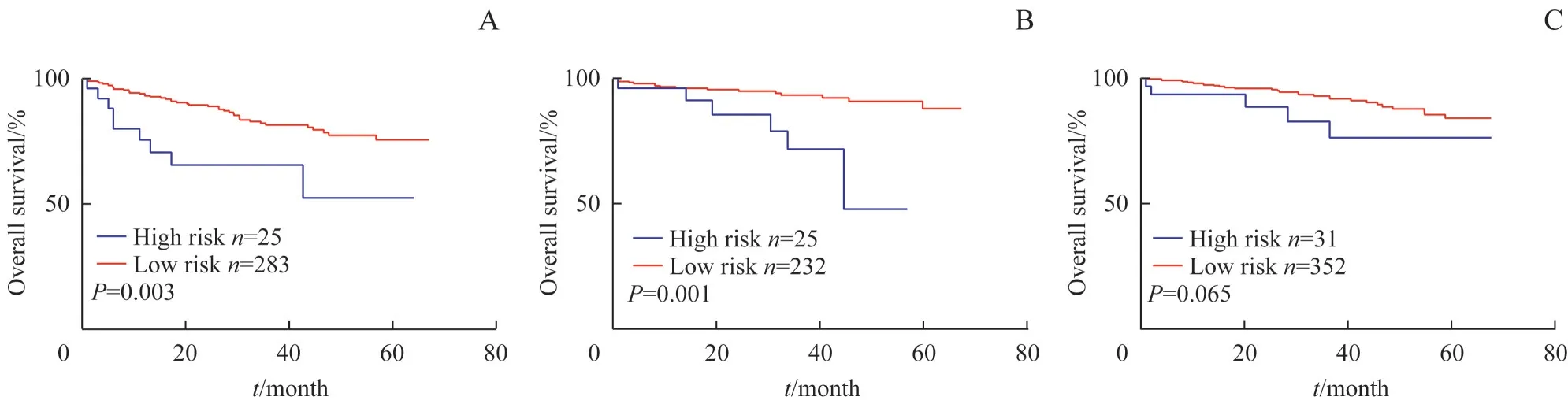
图3 高风险组与低风险组在肿瘤部位中的Kaplan-Meier生存分析曲线Fig 3 Kaplan-Meier survival analysis curves in tumor site between high risk group and low risk group

图4 高风险组与低风险组在TNM分期中的Kaplan-Meier生存分析曲线Fig 4 Kaplan-Meier survival analysis curves in TNM stage between high risk group and low risk group
2.5 高低风险组CRC的指标差异性分析
在对高风险组的术前血清肿瘤标志物(CEA、CA199、 CA125、 CA724、 CA50)、 基 因 突 变(KRAS、NRAS、BRAF)情况及错配修复(mismatch repair,MMR)状态的分布差异研究发现,高风险患者中CA199 升高(>25 U/mL)的患者占比明显高于低风险患者(P=0.001)。CEA 升高患者在高风险组中有比例更高的趋势(P=0.051)。CA50、CA125、CA724 的占比在高风险组和低风险组中无明显差异。对CRC 的KRAS、NRAS、BRAF的基因突变情况的研究发现,与低风险组相比,上述基因突变在高风险组中的发生概率无明显升高或降低改变。错配修复缺陷组(deficient mismatch repair,dMMR)与错配修复正常组(proficient mismatch repair,pMMR)在高风险组和低风险组中的分布未见明显差异(图5)(错配修复蛋白包含MLH1、PMS2、MSH2、MSH6 4种,当出现1 个及以上表达缺失即判定为dMMR 状态,4种均未缺失即判定为pMMR状态[13])。进一步进行生存分析后发现,当CRC 伴有PNI阳性、LVI阳性和高TSR 时,并发生CEA、CA199 升高或KRAS基因突变时,患者表现出更差的预后(P=0.000,图6),术后可能需要精准化、个体化的强效治疗措施,帮助患者获得更佳的生存获益。
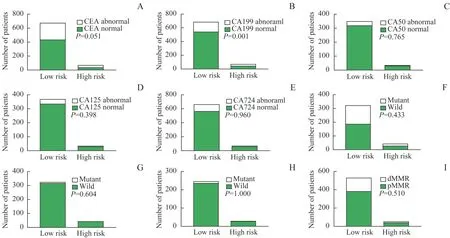
图5 高风险组与低风险组在术前血清肿瘤标志物、基因突变状态、错配修复基因状态分布差异Fig 5 Distributional difference of preoperative serum tumor markers, gene mutation status and mismatch repair gene status for high-risk group and low-risk group

图6 高风险组与低风险组Kaplan-Meier生存分析曲线Fig 6 Kaplan-Meier survival analysis curves for high risk group and low risk group
3 讨论
根据现有的TNM分期标准,我们不难发现在相同TNM分期的CRC患者其预后状况可能差别很大[14]。一些Ⅱ期CRC患者的预后比一些Ⅲ期CRC患者的预后更差,然而现有的TNM分期显然不能筛选出这些患者,从而导致具有某些高危因素的Ⅱ期CRC患者得不到足够的治疗,使得预后不尽如人意[15]。
PNI 阳性、LVI 阳性和高TSR 的CRC 虽然在总的CRC中占比不高,但其恶性程度不容小觑。PNI阳性、LVI阳性和高TSR是CRC的独立预后因素,因此在制定CRC术后的辅助治疗策略时需格外关注,个体化、精准化的强效治疗可能使得此类患者获得更佳的疗效。
ZHANG 等[16]研究发现对于CEA 升高的转移性CRC患者可以耐受较大剂量嵌合抗原受体T细胞疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T),且可控制肿瘤生长。对于PNI 阳性、LVI阳性和高TSR 的高危CRC 患者,当出现CEA 增高且常规化学治疗(化疗)药物治疗不敏感时,能否考虑加用CAR-T 疗法值得进一步探究。挪威学者[17]对545例CRC患者的生存回顾发现CA199是不良的预后指标,且对于CA199 升高联合BRAF突变的CRC 患者其不良预后更加显著。这值得我们思考:具有PNI阳性、LVI 阳性和高TSR 的CRC 患者,当术前发现CA199 升高且BRAF发生突变时,手术是第一位的吗?术前的新辅助化疗是否可以给患者带来额外的生存获益,或者术后早期化疗联合靶向、免疫等治疗是否可以延缓肿瘤复发转移,这需要后续的大样本临床随机试验来加以证实。KARS突变是CRC 中最常见的癌基因突变,通过激活KRAS基因相关蛋白持续刺激下游信号通路,促进CRC 患者的增殖和转移。因此KRAS基因突变的CRC 患者预后较差[18]。对于高风险CRC患者当伴有KRAS基因突变时,是否可以采用化疗联合靶向药物治疗以提高疗效,则有待观察。
在对SGH的948例CRC患者的回顾性研究中,不难看出高风险分组CRC是CRC中不良预后的类型,其总生存率明显低于低风险CRC组(P=0.000),且PNI、LVI和TSR的指标可以从常规病理标本诊断中得出,不需要承担额外的医疗负担,便于临床应用和推广。
CRC 的常规化疗方案是卡培他滨单药或联合奥沙利铂[19]。对于具有高危因素的Ⅱ期CRC 患者,指南推荐卡培他滨联合奥沙利铂的化疗方案可能使患者生存获益;对于无高危因素的Ⅱ期CRC 患者,奥沙利铂的使用无明显生存获益,但可能导致化疗不良反应的增加[20]。因此对于CRC 患者,识别其高危因素并早期加以治疗控制可以使患者的生存获益。对于Ⅲ期CRC 患者,指南推荐是CAPOX 或FOLFOX 方案,但对于部分Ⅲ期CRC 患者而言上述治疗是不够的,部分患者在化疗期间有发生肿瘤复发转移的可能[21]。我们的研究表明PNI、LVI 和TSR 的联合指标是影响CRC 患者预后的独立危险因素,PNI 阳性、LVI 阳性和高TSR 的CRC 患者的预后更差,生存时间短,与某些国外学者的研究[13]一致。我们的研究初步表明PNI、LVI 和TSR 的联合指标对CRC 的生存判断有指示作用,可为临床医师术后治疗方案的制定提供一定的参考,可作为TNM 分期的补充。对于具有高危因素Ⅲ期CRC 患者早期的化疗联合免疫或者靶向治疗,能否使患者生存获益,有待进一步探索。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有实验已通过上海交通大学医学院附属第一人民医院伦理委员会的审核批注(文件号:2020KY052)。所有实验过程均遵照《上海交通大学医学院附属第一人民医院标准/条例》。回顾性研究,豁免签署知情同意书。
All experimental protocols in this study were reviewed and approved by Ethics Committee of Shanghai General Hospital,Shanghai Jiao Tong University School of Medicine (Approval Letter No.2020KY052,dated 08/19/2020),and all experimental protocols were carried out by following the guidelines of Shanghai General Hospital,Shanghai Jiao Tong University School of Medicine.As a retrospective study,consent letters was exempt signed.
作者贡献/Authors'Contributions
邱佳辉、蔡谦谦、杨彦、程非池参与了实验设计;邱佳辉参与了研究实施和数据分析;邱佳辉、裘正军、黄陈参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。
The study was designed by QIU Jiahui,CAI Qianqian,YANG Yan and CHENG Feichi. The study was implemented by QIU Jiahui. The data was analyzed by QIU Jiahui. The manuscript was drafted and revised by QIU Jiahui,QIU Zhengjun and HUANG Chen.All the authors have read the last version of paper and consented for submission.
·Received:2022-03-11
·Accepted:2022-07-21
·Published online:2022-08-28
参·考·文·献
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249.
[2] ZHENG R S,ZHANG S W,ZENG H M,et al. Cancer incidence and mortality in China,2016[J]. J Natl Cancer Cent,2022,2(1):1-9.
[3] YUAN H,DONG Q J,ZHENG B A,et al. Lymphovascular invasion is a high risk factor for stage Ⅰ/Ⅱcolorectal cancer: a systematic review and meta-analysis[J]. Oncotarget,2017,8(28):46565-46579.
[4] JIANG H H, ZHANG Z Y, WANG X Y, et al. Prognostic significance of lymphovascular invasion in colorectal cancer and its association with genomic alterations[J]. World J Gastroenterol,2019,25(20):2489-2502.
[5] KNIJN N,MOGK S C,TEERENSTRA S,et al. Perineural invasion is a strong prognostic factor in colorectal cancer:a systematic review[J].Am J Surg Pathol,2016,40(1):103-112.
[6] CONTE G A, QARI O, FASANO G A, et al. S100 staining adds to the prognostic significance of the combination of perineural invasion and lymphovascular invasion in colorectal cancer[J]. Appl Immunohistochem Mol Morphol,2020,28(5):354-359.
[7] MESKER W E, JUNGGEBURT J M C, SZUHAI K, et al. The carcinoma-stromal ratio of colon carcinoma is an independent factor for survival compared to lymph node status and tumor stage[J]. Cell Oncol,2007,29(5):387-398.
[8] LUO Z, FU Z M, LI T F, et al. Development and validation of the individualized prognostic nomograms in patients with right- and leftsided colon cancer[J]. Front Oncol,2021,11:709835.
[9] 李腾飞,杨彦,黄陈. 肿瘤间质比在Ⅱ、Ⅲ期结直肠癌患者预后评估中的价值[J]. 中华结直肠疾病电子杂志,2021,10(2):158-163.LI T F,YANG Y, HUANG C. The prognostic value of tumor stroma ratio in patients with stageⅡand Ⅲcolorevtal caner[J]. Chin J Colorec Dis(Electronic Edition),2021,10(2):158-163.
[10] NASO J R, YANG H M, SCHAEFFER D F. Variability in synoptic reporting of colorectal cancer pT4a category and lymphovascular invasion[J]. Arch Pathol Lab Med,2021,145(3):343-351.
[11] ALOTAIBI A M, LEE J L, KIM J, et al. Prognostic and oncologic significance of perineural invasion in sporadic colorectal cancer[J].Ann Surg Oncol,2017,24(6):1626-1634.
[12] LI T F,YU Z K,YANG Y,et al. Rapid multi-dynamic algorithm for gray image analysis of the stroma percentage on colorectal cancer[J]. J Cancer,2021,12(15):4561-4573.
[13] LIZARDO D Y, KUANG C Y, HAO S S, et al. Immunotherapy efficacy on mismatch repair-deficient colorectal cancer: from bench to bedside[J]. Biochim Biophys Acta Rev Cancer, 2020, 1874(2):188447.
[14] 蔡建,王磊. 回眸2018:聚焦结直肠癌研究领域[J]. 中华胃肠外科杂志,2019,22(1):9-16.CAI J, WANG L. Focus on colorectal cancer research, 2018[J].Chin J Gastrointest Surg,2019,22(1):9-16.
[15] DIENSTMANN R, MASON M J, SINICROPE F A, et al.Prediction of overall survival in stage Ⅱand Ⅲcolon cancer beyond TNM system: a retrospective, pooled biomarker study[J]. Ann Oncol,2017,28(5):1023-1031.
[16] ZHANG C C,WANG Z,YANG Z,et al. Phase Ⅰescalating-dose trial of CAR-T therapy targeting CEA+metastatic colorectal cancers[J]. Mol Ther,2017,25(5):1248-1258.
[17] THOMSEN M,SKOVLUND E,SORBYE H,et al. Prognostic role of carcinoembryonic antigen and carbohydrate antigen 19-9 in metastatic colorectal cancer:aBRAF-mutant subset with high CA 19-9 level and poor outcome[J]. Br J Cancer,2018,118(12):1609-1616.
[18] ZHU G M, PEI L J, XIA H W, et al. Role of oncogenicKRASin the prognosis, diagnosis and treatment of colorectal cancer[J]. Mol Cancer,2021,20(1):143.
[19] YOTHERS G, O'CONNELL M J,ALLEGRA C J, et al. Oxaliplatin as adjuvant therapy for colon cancer:updated results of NSABP C-07 trial, including survival and subset analyses[J]. J Clin Oncol, 2011,29(28):3768-3774.
[20] BENSON A B, VENOOK A P, AL-HAWARY M M, et al. NCCN guidelines insights: colon cancer, version 2.2018[J]. J Natl Compr Canc Netw,2018,16(4):359-369.
[21] LABIANCA R, NORDLINGER B, BERETTA G D, et al. Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol, 2013, 24(Suppl 6): vi64-vi72.
