AFF4在年轻恒牙牙髓炎中的表达及对牙髓细胞分化的影响
2022-10-19冷春涛刘景袁媛
冷春涛,刘景,袁媛
(新疆医科大学第五附属医院 口腔科,新疆 乌鲁木齐 830011)
儿童恒牙龋齿易引发牙髓炎,为避免患牙发生缺失需要尽早治疗[1]。牙髓组织中包含多能间充质干细胞,其中人牙髓细胞(dental pulp cells, DPCs)包含了可分化为各种类型的牙髓干细胞,还包含成牙本质细胞、成骨细胞、脂肪细胞、软骨细胞和神经细胞[2- 3]。目前关于DPCs分化和牙组织再生调节的分子机制仍不清楚。AF4/FMR2家族成员4(AF4/FMR2 family member 4, AFF4)是一种骨架延伸蛋白,可通过骨形成蛋白(bone morphogenetic protein 2, BMP2)调节人间充质干细胞 (mesenchymal stem cells, MSCs)的成骨分化[4]。但是AFF4在年轻恒牙牙髓炎中的表达特征和对牙髓细胞成骨分化的影响并不十分清楚。本研究假设AFF4与牙髓炎患者牙髓组织缺失有关,并且AFF4在牙髓细胞的牙源性分化过程中是必不可少的。为了验证该假设,我们收集年轻恒牙牙髓炎患者牙髓组织,检测AFF4的表达,并研究AFF4对牙髓细胞增殖、凋亡、分化的影响。
1 材料与方法
1.1 临床组织
牙髓样本取自2019年1月至2020年12月在我院接受恒牙脱落手术的48例8~16岁牙髓炎患者的恒牙组织和48例8~16岁健康自然脱落的恒牙组织,以及15例自然脱落的健康成年人(34~57岁)恒牙组织。所有参与者或其监护人均签署了书面知情同意书,本研究获得了我院伦理委员会的批准(批号20200923)。
1.2 试剂与耗材
DPCs购于赛业生物科技有限公司。α修饰的Eagle培养基(a- MEM)和胎牛血清(FBS)购于美国Gibco公司。AFF4过表达载体(pcDNA3.1- AFF4,pcDNA- AFF4)和空载体(pcDNA- ctrl)均购于上海吉玛公司。Trizol试剂盒与Lipofectamine 3000 试剂均购于美国Invitrogen公司。RIPA缓冲液购于美国Pierce公司, PrimeScript RT Regent Kit和SYBR Premix Ex Taq购于日本TaKaRa公司。辣根过氧化物酶偶联的抗兔 IgG购于美国Jackson Immuno Research公司, SuperSignal试剂购于美国Pierce公司,细胞计数试剂盒(Cell Counting Kit- 8, CCK- 8)试剂购于上海KeyGEN Biotech 公司。兔抗AFF4及骨钙蛋白(osteocalcin, OCN)、骨桥蛋白(osteopontin, OPN)、成骨特异性转录因子(Osteoblast specific transcription factor, OSX)、肌节同源盒2(muscle segment homeobox gene 2, MSX2)、末端无同源盒5(distal- less homeobox 5, DLX5)、runt相关的转录因子2(Runt- associated transcription factor2, RUNX2)、磷酸甘油醛脱氢酶(glyceraldehyde- phosphate dehydrogenase, GAPDH)及分光光度计酶标仪购于美国Bio- Rad公司;Annexin- V- FITC/PI双染试剂盒购于中国江苏凯根生物科技有限公司;DAB试剂盒购于北京ZSGB- BIO公司。茜素红 S 溶液购于北京索莱宝科技有限公司。
1.3 细胞培养与处理
用a- MEM培养基培养DPCs,a- MEM培养基中含有10% FBS、100 U·ml-1青霉素和100 mg·ml-1链霉素,DPCs在37 ℃含有5% CO2的湿润培养箱中培养。根据过表达载体生产商的说明,使用pcDNA- AFF4和Lipofectamine 3000试剂共同转染DPCs细胞,设为pcDNA- AFF4组;用pcDNA- ctrl和Lipofectamine 3000 试剂共同转染DPCs细胞,设为pcDNA- ctrl组。转染后48 h通过实时荧光定量PCR (qRT- PCR)证实表达效率。
1.4 qRT- PCR 检测AFF4、OCN、OPN、OSX、MSX2、RUNX2及DLX5的mRNA表达水平
qRT- PCR根据制造商的说明进行操作,应用Trizol试剂收集DPCs或牙髓组织中的总RNA。采用PrimeScript RT Regent Kit从 1 mg RNA中反转录得到cDNA。使用 SYBR Premix Ex Taq试剂盒在ABI 7500实时PCR系统上进行qPCR,引物序列见表1。选择GAPDH作为内参基因,采用2-ΔΔCt法计算其相对表达量。2-ΔΔCT的计算公式如下:ΔCt= Ct目的基因-Ct内参,记为ΔCt对照,用各组的ΔCt分别减去ΔCt对照平均,求得ΔΔCt值,再计算各组2-ΔΔCT值,即为各组中基因的相对表达量。

表1 引物序列
1.5 蛋白质印迹法检测AFF4、OCN、OPN、OSX、MSX2、RUNX2及DLX5的蛋白表达
收集DPCs或牙髓组织,用冷PBS洗涤两次,然后在补充有蛋白酶抑制剂的RIPA 缓冲液中冰上裂解[5]。将细胞裂解液在4 ℃下15 000×g离心 15 min以去除细胞碎片。将上清液加入含有2% SDS 和 1% 2- 巯基乙醇的上样缓冲液中, 95 ℃加热5 min。使用SDS聚丙烯酰胺凝胶分离蛋白裂解物,并使用湿转移装置转移至PVDF膜。膜在室温下用5%牛奶封闭1 h,与兔抗AFF4(1∶600)、OCN(1∶800)、OPN(1∶500)、OSX(1∶300)、MSX2(1∶600)、RUNX2(1∶500)、DLX5(1∶500)在4 ℃下过夜,然后与辣根过氧化物酶偶联的抗兔IgG孵育4 h。电化学发光系统显示蛋白条带,ImageJ- lab 3.0 分析条带强度。ALP 活性由碱性磷酸酶测定试剂盒(Beyotime biotechghai, China)测定。
1.6 免疫组化染色
牙髓组织用4%福尔马林固定,石蜡包埋,切成3 μm 厚的切片。切片在二甲苯中常规脱蜡并在酒精梯度中再水化。在柠檬酸钠 (pH 6.0) 或 Tris- EDTA 溶液 (pH 8.0) 中加热 10 min回收组织抗原。用 3% H2O2封闭切片,与抗AFF4(1∶400) 进行孵育,在4 ℃过夜。在PBS 中洗涤 3 次后,将切片与二抗在室温下孵育 30 min。应用 DAB 试剂盒(ZSGB- BIO,北京,中国)对载玻片进行染色。经苏木精复染并用中性香脂封固后,使用 Olympus BX- UCB 光场显微镜观察组织切片。在 × 400 放大倍数下捕获 5 个随机场用于强度分析。使用Image- pro Plus软件进行半定量图像分析。在软件中打开图像,校准光密度,在测量菜单中点击计数/大小,选择手动进入分割对话框,其中感兴趣的区域设置为色相0 ~ 30、饱和度0 ~ 255、强度0 ~ 255;统计平均光密度,用其代表染色强度[6- 7]。
1.7 CCK- 8法检测细胞活力
DPCs的增殖能力使用CCK- 8试剂盒进行检测。DPCs(3 × 104个·ml-1)在相应处理后接种在96孔板中,孵育 72 h后将细胞与 10 μl CCK- 8 溶液在37 ℃、5% CO2条件下孵育2 h。使用分光光度计酶标仪(Bio- Rad,Hercules,CA,USA)测量 490 nm 处的光密度(OD)值。
1.8 Annexin V FITC/PI双染法检测细胞凋亡
pcDNA- AFF4组和pcDNA- ctrl组细胞培养24 h后,用不含EDTA的胰蛋白酶消化收集约 1 × 105个细胞,用冷PBS 洗涤两次。 重悬于500 μl 结合缓冲液中,将细胞用5 μl Annexin- V- FITC 和5 μl PI在室温下避光染色15 min。应用FACSAria 流式细胞仪检测细胞凋亡。
1.9 ALP染色及ALP活性检测
两组DPCs在24孔培养基中培养3 d。细胞用冷PBS洗涤3 次,然后用ALP染色液孵育,避光30 min。ALP 活性根据试剂盒制造商提供的说明进行测定。
1.10 茜素红S染色
DPCs用牙源性培养基在24孔培养板中培养3周。用 4% 多聚甲醛固定10 min,在黑暗中用茜素红S溶液对细胞染色10 min。用PBS中的10%氯化十六烷基吡啶对被茜素红S染色的骨结节进行脱色,并通过测量562 nm的吸光度来定量钙浓度。
1.11 统计学处理
采用SPSS 11.5统计软件进行数据分析,计量资料以均数±标准差表示,两组间比较采用t检验,P< 0.05为差异具有统计学意义。
2 结 果
2.1 AFF4在年轻恒牙牙髓炎患者组织中的表达特征
与健康组比较,牙髓炎组中AFF4 mRNA的表达明显下调(P<0.05),免疫组化染色显示AFF4在健康组牙髓组织明显表达,在牙髓炎组中表达明显降低(P<0.05)。年轻恒牙组AFF4 mRNA表达明显高于成年恒牙组(P<0.05)。见图1。
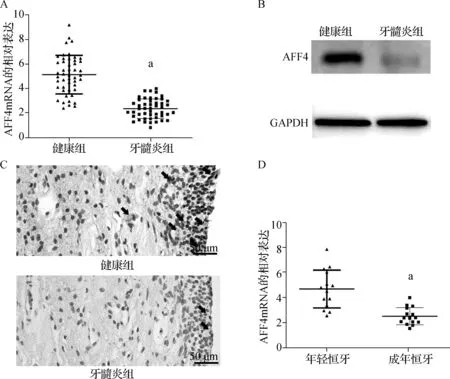
a P<0.05A.qRT- PCR检测年轻健康恒牙和牙髓炎牙髓组织AFF4 mRNA表达;B.蛋白质印迹法检测牙髓组织AFF4 蛋白表达;C.免疫组化染色检测牙髓组织AFF4 蛋白的表达(苏木精染色 ×200),黑色箭头表示AFF4阳性表达区域;D.qRT- PCR检测年轻恒牙和成年恒牙牙髓组织中AFF4 mRNA的表达图1 qRT- PCR、蛋白质印迹法、免疫组化法检测AFF4 在人牙髓组织中的表达
2.2 牙髓组织中AFF4与成骨分化蛋白的相关性
与健康组比较,牙髓炎组中OCN、OPN、OSX、MSX2、DLX5、RUNX2的表达水平均降低,差异有统计学意义(均P<0.05);OCN、OPN、OSX、MSX2、DLX5、RUNX2的表达水平均与AFF4呈正相关(均P<0.05)。见图2。
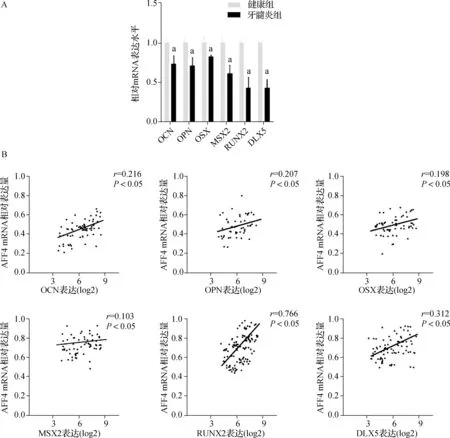
A.qRT- PCR检测健康组和牙髓炎组中OCN、OPN、OSX、MSX2、DLX5、RUNX2 mRNA的表达水平,a与健康组比较,P<0.05;B.AFF4与OCN、OPN、OSX、MSX2、DLX5、RUNX2的相关性分析图2 健康组和牙髓炎组中OCN、OPN、OSX、MSX2、DLX5、RUNX2 mRNA的表达水平及其与AFF4 mRNA表达的相关性
2.3 AFF4过表达对人牙髓细胞增殖能力的影响
与pcDNA- ctrl组比较,pcDNA- AFF4组AFF4蛋白的表达显著上调,差异有统计学意义(P<0.05);与pcDNA- ctrl组比,pcDNA- AFF4组DPCs的增殖率明显增加,差异有统计学意义(P<0.05)。见图3。
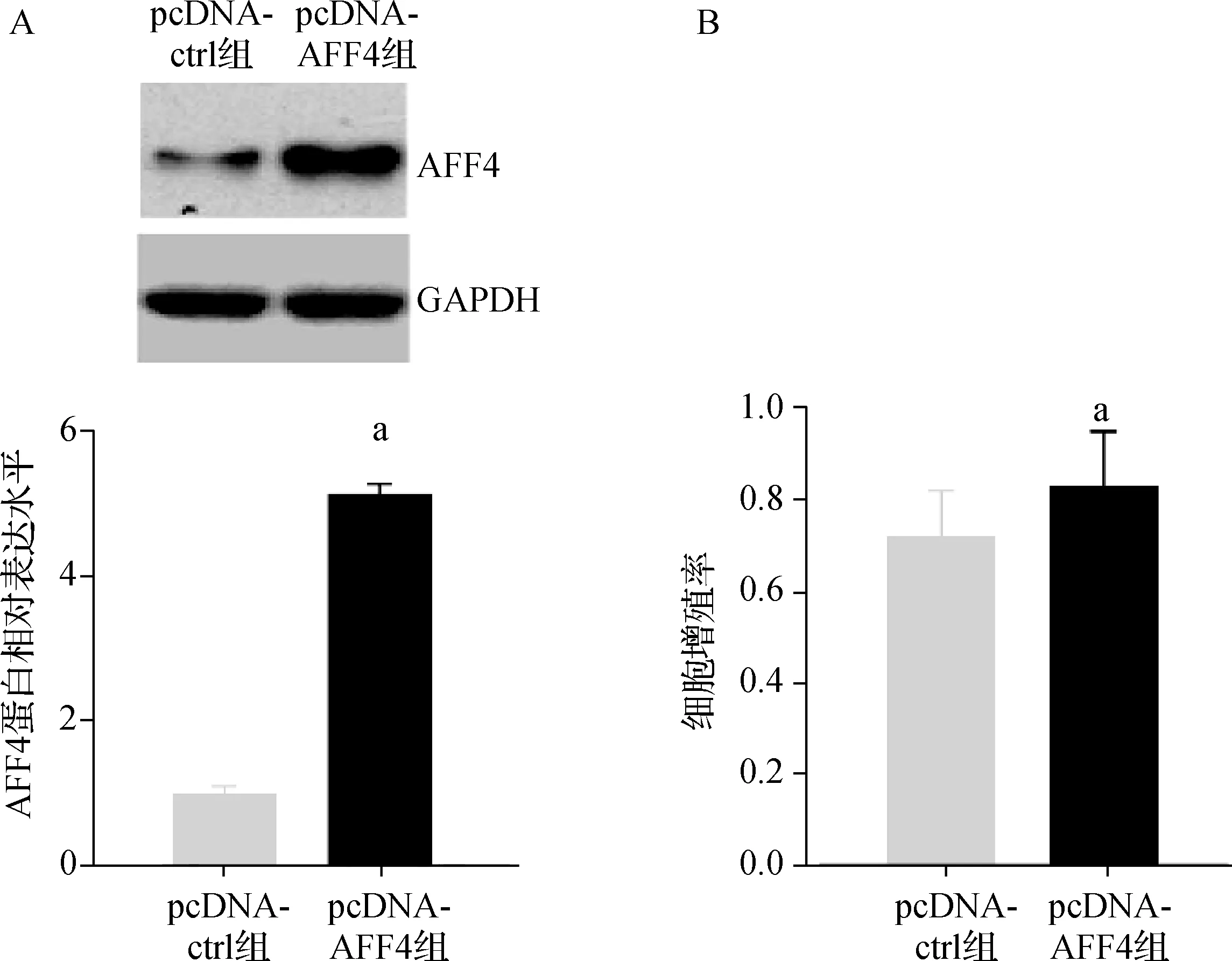
a与pcDNA- ctrl组比较,P<0.05A.蛋白质印迹法检测AFF4的蛋白表达水平;B.CCK- 8检测DPCs增殖率图3 AFF4过表达对DPCs增殖率的影响
2.4 AFF4过表达对DPCs凋亡的影响
与pcDNA- ctrl组相比,pcDNA- AFF4组DPCs凋亡率显著降低,差异有统计学意义(P<0.05),凋亡标志物Caspase 3和Bax/bcl- 2的表达水平均明显降低,差异有统计学意义(P<0.05)。见图4。
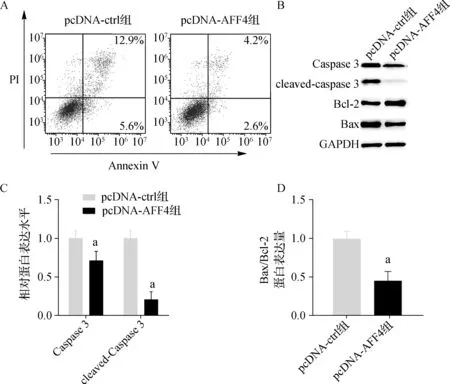
a与pcDNA- ctrl组比较,P<0.05A.流式细胞术检测细胞凋亡率;B~D.蛋白质印迹法检测Caspase 3和Bax/bcl- 2的蛋白表达水平图4 AFF4过表达对DPCs凋亡率的影响
2.5 AFF4过表达对人牙髓细胞成骨分化的影响
ALP(牙源性分化的早期标志物)在AFF4过表达(pcDNA- AFF4组)DPCs中明显增加,差异有统计学意义(P<0.05,图 5A)。茜素红 S 染色结果和定量结果显示,AFF4 过表达后细胞外基质矿化增加(图 5B)。qRT- PCR和蛋白质印迹法结果显示,pcDNA- AFF4组牙源相关基因OCN、OPN、OSX、MSX2、RUNX2、DLX5的mRNA和蛋白表达水平均明显上调(P<0.05,表2、图5C)。
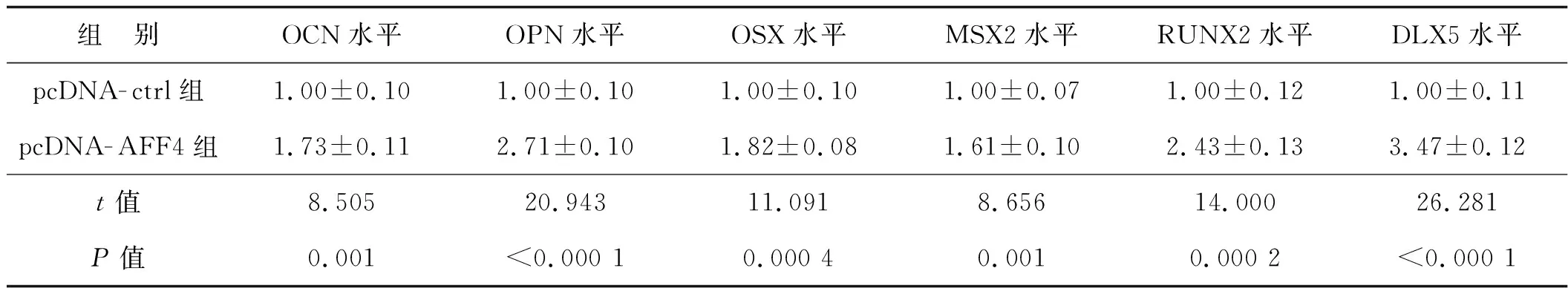
表2 qRT- PCR检测OCN、OPN、OSX、MSX2、RUNX2、DLX5 mRNA相对表达水平
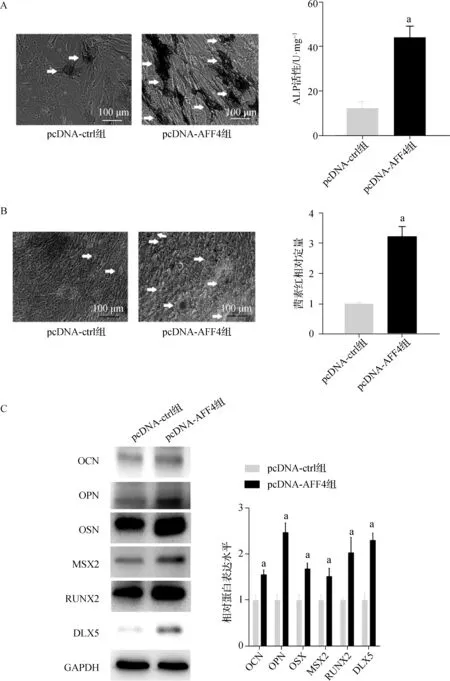
a与pcDNA- ctrl组比较,P<0.05A.ALP检测试剂盒检测ALP活性(×200),白色箭头表示ALP阳性区域;B.茜素红 S染色观察DPCs矿化程度(×200),白色箭头表示茜素红S染色阳性区域;C.蛋白质印迹法检测OCN、OPN、OSX、MSX2、RUNX2、DLX5的蛋白表达水平图5 AFF4过表达对DPCs成骨分化的影响
3 讨 论
牙髓炎是一种影响牙髓组织的最常见的病理性疾病,可导致牙髓坏死并使牙齿丧失活力,牙质变脆易折裂,易缺失,并且失去牙髓免疫防御反应[6,8]。细菌感染和细菌毒素侵袭是导致牙髓炎发展的关键原因,而临床上的常规治疗方法一般为拔牙或根管治疗[9]。近年来,修复缺失的牙齿组织已成为牙髓炎终极治疗目标,此领域的研究已受到广泛关注,其中包括基于干细胞分化的疗法[8]。牙髓被认为是再生治疗的合适来源,因为DPCs能够分化成包括成牙本质细胞、成骨细胞、脂肪细胞、软骨细胞和神经细胞在内的细胞类型[10]。此外,与骨髓基质干细胞等其他来源相比,DPCs更易获取[11]。仍需深入探讨DPCs的成骨分化能力和内在机制。
AFF4作为超延伸复合物(SEC)的支架蛋白,在RNA聚合酶Ⅱ的转录延伸调控中发挥重要作用[12]。AFF4主要作为转录激活剂进行研究,对RNA 延伸有积极作用[13]。据报道,它与白血病、HIV 转录和头颈癌有关[13- 15]。在本研究中,我们发现成年恒牙牙髓组织中AFF4的表达明显低于年轻恒牙牙髓组织,而且年轻恒牙的牙髓炎患者中AFF4表达也低于健康组;另外我们观察到了牙髓炎组OCN、OPN、OSX、MSX2、DLX5、RUNX2的表达均降低,AFF4的表达也降低,AFF4与OCN、OPN、OSX、MSX2、DLX5、RUNX2的表达水平呈正相关。这表明AFF4与牙髓的成骨分化有关。
研究表明AFF4在DPCs的牙源性诱导过程中升高[16]。本研究观察到,AFF4过表达明显促进成骨分化和OCN、OPN、OSX、MSX2、DLX5、RUNX2的表达。研究也证实,AFF4 的过表达增强了DPCs 中成骨分化的水平[16]。这些发现表明 AFF4 是DPCs牙源性分化的关键因素。AFF4 包含一个共同的保守 C 端同源域,该域也存在于其余 AFF 蛋白成员中,并且它具有与 SEC 其他亚基相互作用的 N 端区域。在其家族成员中,AFF4 是人体组织中分布最广的因子,它与多种生命活动有关[17]。为探讨AFF4 对人 DPCs 成骨分化的影响,我们研究了其表达水平,发现AFF4 的表达在年轻恒牙牙髓组织中最高,而且AFF4 过表达促进了DPCs的成骨分化。本研究还发现AFF4能调节DPCs细胞的增殖活性并抑制其凋亡率,表明AFF4可作为调控牙髓炎中牙髓细胞凋亡的靶点。
综上所述,AFF4 在年轻恒牙牙髓炎牙髓组织中低表达,而在年轻恒牙健康牙髓组织中表达水平增加。AFF4 过表达促进 DPCs 的增殖和成骨分化,而且抑制DPCs的凋亡。支架蛋白AFF4 作为一种关键的表观遗传调节因子,在人类 DPCs 的成骨分化过程中发挥着重要作用。本研究可为牙髓疾病及骨修复重建的临床治疗提供重要的实验依据。
