薄壳山核桃原花青素合成关键酶基因的克隆与表达分析
2022-10-19贾展慧贾晓东许梦洋莫正海宣继萍张计育郭忠仁
贾展慧,贾晓东,许梦洋,莫正海,翟 敏,宣继萍,张计育,王 刚,王 涛, 郭忠仁
(江苏省中国科学院植物研究所(南京中山植物园),江苏省农业种质资源保护与利用平台,江苏 南京 210014)
薄壳山核桃(Caryaillinoinensis)是世界上重要的干果树种之一,含有丰富的酚类物质[1]。Villarreal-Lozoya等[2]发现在成熟的薄壳山核桃种仁中主要的酚类物质是鞣花酸和没食子酸,以及少量的儿茶素(catechin, C)和表儿茶素(epicatechin, EC)。在前期的研究中发现,儿茶素、表儿茶素及由两者缩合形成的原花青素(proanthocyanidins,PAs)是薄壳山核桃未成熟期种仁中的主要酚类成分,含量是其他酚类物质的数倍[3]。原花青素又称缩合单宁,是植物体内重要的黄酮类化合物,不仅对植物的生长发育、防护紫外光辐射和防御病虫害等有着重要作用,而且是目前国际上公认的清除人体内自由基有效的天然抗氧化剂,已成为抗氧化、抗衰老和预防氧化相关疾病的研究热点。
原花青素生物合成起始于苯丙氨酸,二氢黄烷酮4-还原酶(dihydroflavonol 4-reductase,DFR)是该途径中合成花青素、儿茶素和原花青素的上游关键酶。该基因可将二氢黄酮醇还原为相应的黄烷-3, 4-二醇(无色花青素,leucoanthocyanidins)。DFR属于NADPH依赖性短链还原酶家族或者是 DFR 亚家族,一般以单基因或小基因家族的形式出现在植物中,最早从玉米(Zeamays)和金鱼草(Antirrhinummajus)中克隆得到[4-5]。由无色花青素合成原花青素属于核心类黄酮途径,经无色花青素还原酶(leucoanthocyanidin reductase, LAR)途径和花青素还原酶(anthocyanidin reductase, ANR)途径通过多酶促反应完成,在许多植物中已有过研究。LAR途径指由LAR还原无色花青素形成2,3-反式黄烷-3-醇(儿茶素),然后缩合成原花青素[6]。LAR是儿茶素形成的关键酶,最早在豆科植物金钱草(Desmodiumuncinatum) 的叶片中克隆得到[7];ANR途径指由花青素合成酶(anthocyanidin synthase,ANS)催化将无色花青素还原成2,3-顺式黄烷-3-醇(表儿茶素),然后聚合成原花青素[8-9]。ANR是表儿茶素形成的关键酶,属于DFR超家族的脱氢酶类[10-11]。首先在拟南芥(Arabidopsisthaliana)中分离得到ANR基因,编码342个氨基酸,与DFR有较高的相似性。多数植物同时具有LAR和ANR基因,能同时合成儿茶素和表儿茶素。
Jia等[3]研究发现薄壳山核桃未成熟种仁的强抗氧化性与高含量的儿茶素类物质呈极显著正相关,但在成熟种仁中,儿茶素类物质含量快速下降,而抗氧化活性并不低。推测可能是由(表)儿茶素形成的原花青素随着种仁发育逐渐积累,成为后期抗氧化性的主要来源。Robbins等[12]报道薄壳山核桃成熟种仁中儿茶素二聚体、三聚体、四至六聚体的含量分别为47.%、21.1%和14.8%,因此原花青素单体(儿茶素类物质)可能是薄壳山核桃酚类物质代谢途径的重要前体物质。目前对于原花青素分支代谢通路,尤其是缩合过程的研究仍不透彻。笔者在薄壳山核桃果实品质形成期种仁的转录组研究中获得了3个编码DFR的unigene序列、2个编码LAR的unigene序列和1个编码ANR的unigene序列[13]。因此,本研究借助转录组结果,拟克隆薄壳山核桃儿茶素合成上游关键基因LAR,表儿茶素合成上游关键基因ANR,及两者共同的上游关键基因DFR,并进行生物信息学分析和表达分析,以期为今后的基因功能研究奠定基础。
1 材料与方法
1.1 材料
供试材料为薄壳山核桃‘波尼’(‘Pawnee’),栽培于南京市六合区南京绿宙薄壳山核桃科技有限公司生产基地(118.91°E,32.33°N),树龄8~12 a,株行距为5.0 m×7.0 m,选取生长发育良好、树势相对一致的植株6株,2株为1个小区,重复3次。2014年于花后95~165 d每10 d每株按东、南、西和北4个方位,每个方位各取健康饱满、无病虫害的果实2个,即每株取果实8个,每个生物学重复包含16个样品,每个采样日期取样48个。取样后放入冰盒,迅速带回实验室。样品-20 ℃冰箱过夜,剖开取种仁。将种仁在液氮中速冻混匀后,-80 ℃冰箱中保存备用。
1.2 试验方法
1.2.1 总RNA提取和cDNA第1链的合成
采用天根生化科技(北京)有限公司RNA simple Total RNA Kit试剂盒提取不同发育期的种仁总RNA,用琼脂糖凝胶电泳和Onedrop光谱仪检测确定总RNA的纯度、浓度和完整性;采用HiScript© Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司)进行反转录,具体操作见试剂盒使用说明书。
将‘波尼’ 115和135 d种仁cDNA 混合后用于薄壳山核桃CiDFR、CiLAR和CiANR基因的克隆。不同发育期的种仁cDNA用于实时荧光定量PCR分析。
1.2.2 基因的克隆与序列分析
借助转录组[12]所获得的unigene序列设计引物:3个编码DRF的unigene序列表达差异显著,挑选其中高表达的1个DRF(comp 47692_c0)设计引物;2个编码LAR的unigene序列无差异表达,挑选其中表达量较高的1个LAR(comp 59380_c0)设计引物。引物由上海英俊(Invitrogen)生物科技有限公司合成。引物序列见表1。
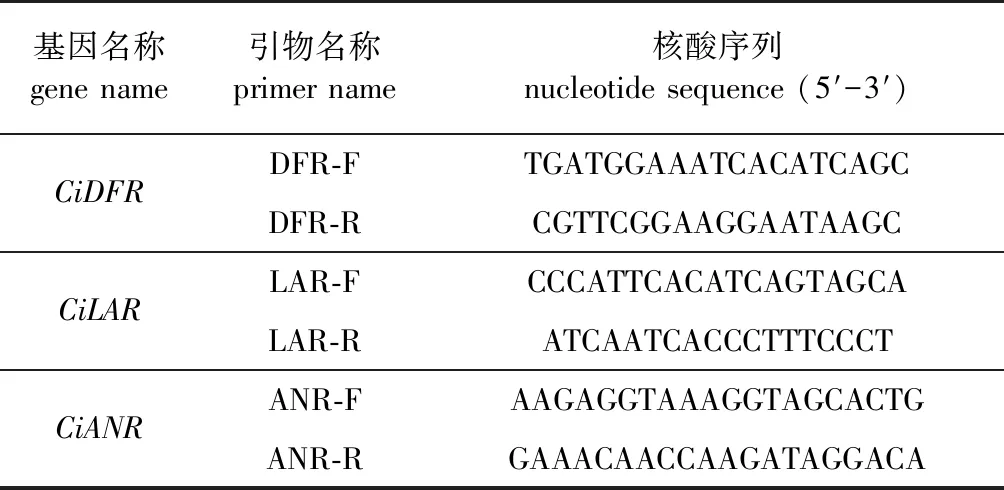
表1 薄壳山核桃引物序列
采用2 ×TaqMaster Mix 试剂(南京诺唯赞生物科技有限公司)进行PCR扩增,反应体系为:2 ×TaqMaster Mix 25 μL,上下游引物各2 μL (10 μmol/L),模板cDNA 5 μL,补足ddH2O至终体积50 μL。
PCR反应程序为:94 ℃预变性5 min,94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s,重复35个循环后再72 ℃延伸10 min。
采用Biospin琼脂糖凝胶DNA回收试剂盒对目的片段进行回收纯化,具体操作见试剂盒使用说明书。取3 μL回收纯化后的DNA产物进行1%(质量分数)琼脂糖凝胶电泳检测,并用紫外分光光度计检测回收DNA产物的质量。回收产物与pMD©18-T载体(TaKaRa, Japan)连接并转化到DH5α感受态细胞(实验室保存),挑取单克隆菌落经PCR验证(反应程序和反应体系同上)后,对PCR产物长度合适的单克隆送南京集思慧远生物公司测序。
1.2.3 生物信息学分析
克隆获得的原花青素生物合成关键酶相关基因的cDNA或氨基酸序列使用不同的网络程序或本地软件进行相关生物信息学分析,即在NCBI数据库中提交克隆序列,并运行BlastN查找同源序列(http://blast.ncbi.nlm.nih.gov/Blast.cgi);再用BioXM查找序列的最大开放阅读框并推导氨基酸序列;而后用pI/Mw tool(http://www.expasy.org/tools/pi_tool.html)、ProtParam(http://expasy.org/tools/protparam.html)和Kyte-Doolittle(http://fasta.bioch.virginia.edu/fasta_www2/fasta_www.cgi?rm=misc1)分析相关蛋白的理化性质,同时将推导的蛋白序列用SMART预测蛋白结构域、GOR预测其二级结构(http://smart.embl-heidelberg.de/);用DNAman 7.0进行多重序列比对,再用MEGA 5.1构建邻接树,均用500次重复进行Bootstrap检验,采用默认的Poisson correction模型和Complete deletion选项。
1.2.4 实时荧光定量PCR分析
采用Beacon designer 7.0软件设计引物序列(表2)。以反转录获得的cDNA稀释15 倍作为模板,荧光定量PCR反应体系为:SYBR GreenReal-time PCR Master Mix (2x) 10 μL,PCR上游引物(10 μmol/L) 1.0 μL,PCR下游引物(10 μmol/L) 1.0 μL,cDNA模板2.0 μL,加入ddH2O补足到20 μL。Real-time PCR反应程序为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,40个循环,72 ℃单点检测信号。PCR反应结束后进行熔解曲线分析:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,连续检测信号。相对表达量的计算采用2-ΔΔCt法。利用SPSS 17.0软件分析数据,P<0.05。
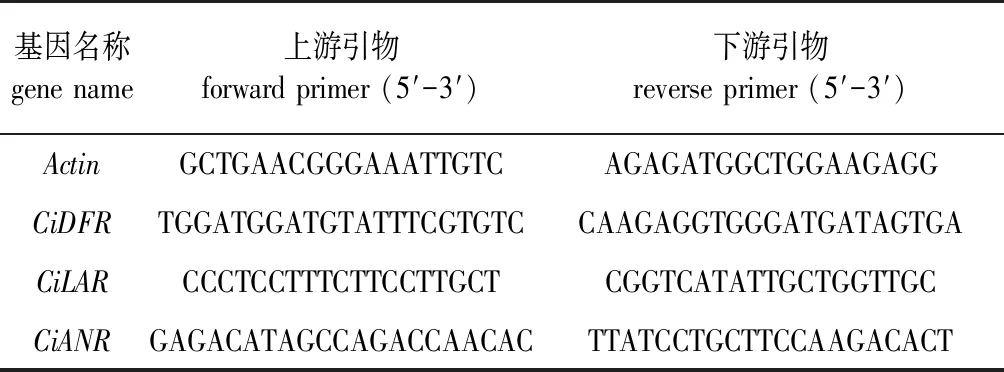
表2 RT-qPCR 使用的引物
1.2.5 酚类代谢相关关键基因表达量与酚类代谢物含量的关联分析
采用SPSS 19.0软件进行相关性分析,之后采用MeV软件绘制热图。绘制热图的数据包括:前期研究中测定的‘波尼’10个发育时期中的总酚含量、缩合单宁、总黄酮含量、儿茶素、表儿茶素、鞣花酸、没食子酸、EGCG的含量和抗氧化性的动态变化[3],以及CiDFR、CiLAR和CiANR基因在‘波尼’8个发育时期的表达量。
2 结果与分析
2.1 薄壳山核桃CiDFR基因的克隆和序列分析
通过PCR扩增得到了长度大约为1 200 bp的目的基因片段,测序结果为1 148 bp,其中包含1个开放阅读框(ORF)长度为1 020 bp,编码339个氨基酸。推导蛋白的分子质量为37.97 ku,等电点(pI)为5.91,疏水指数为-0.234,说明该蛋白偏亲水性。该序列在GenBank数据库中的登录号为BankIt2133004 Seq3 MH613770。
薄壳山核桃CiDFR的氨基酸序列在NCBI上与其他植物的DFR氨基酸序列进行多重比对(图1A)发现,薄壳山核桃CiDFR与核桃(Juglansregia)、欧洲栓皮栎(Quercussuber)和枣(Ziziphusjujuba)等植物的同源性均大于80%。

CiDFR.薄壳山核桃Carya illinoensis;JrDFR. 核桃Juglans regia(XP_018821154.1);QsDFR.欧洲栓皮栎Quercus suber(XP_023872027.1);LfDFR.枫香Liquidambar formosana(AGT28278.1);VvDFR.葡萄Vitis vinifera(NP_001268144.1);ZjDRF.枣Ziziphus jujuba(XP_015884708.1);DzDFR.榴莲Durio zibethinus(XP_022769017.1);PbDFR.苹果梨Pyrus×bretschneideri(XP_009365091.1);MdDFR.苹果Malus domestica(AAO39816.1);PaDFR.欧洲甜樱桃Prunus avium(AJO67977.1);CmDFR. 英国山楂Crataegus monogyna(AAX16491.1); FaDFR.草莓Fragaria×ananassa(AHL46451.1);CoDFR.黄麻Corchorus capsalaris(OMO75166.1);TcDFR.可可Theobroma cacao(EOY14811.1);PlDFR.芍药Paeonia lactiflora(AFI71899.1)。红色与绿色下划线分别为NADP(H)结合位点和底物特异性结合基序。两个下拉箭头表示保守位点。Red and green underlines represent the NADP(H)-binding site and the substrate specificity site。The two drop-down arrows indicate conserved sites.图1 CiDFR氨基酸序列多重比对与系统进行分析Fig.1 Multiple sequence alignment and phylogenetic tree constracting of amino acid homology of CiDFR in pecan
利用在线InterProScan程序检索EBI的InterPro数据库,发现该蛋白在N端存在一个由21个氨基酸组成的且高度保守的NAD (P)结合位点‘VTGASGFIGSWLIMRLLEHGY’[14],其中富含甘氨酸(G)的NAD (P)结合位点区域(‘TGXXGXX’)允许NAD(P)进入,对结构域稳定性起着关键作用。另外还存在一个由26个氨基酸构成的底物特异性结合的氨基酸基序“TVNVEEHQKPVYDESCWSDVEFCRAK”[15],这段序列可以决定DRF底物的特异性,其中第103位的天冬酰胺(N) 和第114 位的谷氨酸(E) 直接影响DFR的底物特异性。进一步搜索NCBI的CDD数据库,该基因在8~302 aa处含有FR_SDR_e结构域,在1~329 aa处含有PLN02650结构域。另外该蛋白还包含WcaG、HpnA、Epimerase等结构域,其中WcaG为核苷二磷酸糖表异构酶的保守结构域,主要在细胞壁和膜酯等的合成中发挥作用,Epimerase为NAD依赖表异构酶/脱氢酶家族共有的保守结构域,说明此蛋白属于二氢黄酮醇还原酶家族。
利用MEGA 5.1对薄壳山核桃及高同源性植物进行进化树构建发现,薄壳山核桃与核桃亲缘关系最近,其次是欧洲栓皮栎和枣,然后是蔷薇科的苹果(Malusdomestica)、草莓(Fragaria×ananassa)和甜樱桃(Prunusavium)等植物(图1B)。
2.2 薄壳山核桃CiLAR基因的克隆和序列分析
薄壳山核桃CiLAR序列长度为1 390 bp,包含1个长度为1 050 bp的开放阅读框(ORF),编码349个氨基酸。推导蛋白的分子质量为38.51 ku,等电点(pI)为5.77。平均亲水性(GRAVY)值为-0.061,说明该蛋白是一种亲水蛋白。该序列在GenBank数据库中的登录号为BankIt2133004 Seq4 MH613771。
氨基酸序列多重比对结果(图2A)表明,薄壳山核桃CiLAR的氨基酸序列与核桃的同源性最高,其次为欧洲栓皮栎、杨梅(Morellarubra)和榴莲(Duriozibethinus)等。通过比较不同物种的LAR氨基酸序列,结合NCBI的CDD数据库,发现薄壳山核桃CiLAR蛋白中包含典型的苯(基)香豆素苄基醚还原酶(PCBER, phenylcoumaran benzylic ether reductase)的结构域,属于短链脱氢/还原酶(SDR superfamily, short-chain dehvdrogenaselreductase)超家族成员。利用MEGA 5.1将薄壳山核桃LAR氨基酸序列与在NCBI中比对到的同源性最高的其他14种植物的LAR氨基酸序列构建进化树发现,与DFR情况一致,薄壳山核桃与核桃、欧洲栓皮栎、杨梅的LAR进化关系较近,与草莓、西洋梨(Pyruscommunis)、桃(Prunuspersica)和梅(Prunusmume)等蔷薇科的植物的LAR进化关系较远(图2B),说明同科植物基因在进化中相对保守,而不同科属植物间的基因及氨基酸差异较大。
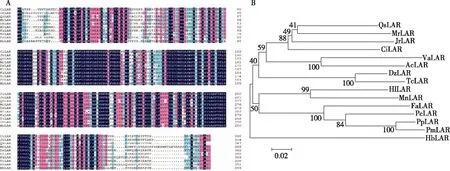
CiLAR.薄壳山核桃Carya illinoinensis;JrLAR.核桃Juglans regia(XP_018836086.1);QsLAR.欧洲栓皮栎Quercus suber(XP_023925115.1);MrLAR.杨梅Morella rubra ((AIX02997.1);DzLAR.榴莲Durio zibethinus(XP_022777001.1);HlLAR.啤酒花Humulus lupulus(AEV89964.1);FaLAR.草莓Fragaria×ananassa(ABH07785.2);TcLAR.可可Theobroma cacao(XP_017971349.1);PcLAR.西洋梨Pyrus communis(ABB77696.1);HbLAR.橡胶Hevea brasiliensis(XP_021682051.1);PpLAR. 桃Prunus persica(XP_007222274.1);MnLAR. 桑树Morus alba(XP_024019396.1);VaLAR.兔眼蓝莓Vaccinium ashei(BAM42674.1);AcLAR.中华猕猴桃Actinidia chinensis var. chinensis(PSS13414.1);PmLAR.梅Prunus mume(XP_008243165.1)。图2 CiLAR氨基酸序列多重比对与系统进行分析Fig.2 Multiple sequence alignment and phylogenetic tree constructed of amino acid homology of CiLAR in pecan
2.3 薄壳山核桃CiANR基因的克隆和序列分析
薄壳山核桃CiANR序列长度为1 104 bp,包含1个长度为1 014 bp的ORF,编码337个氨基酸。推导蛋白的分子质量为36.35 ku,等电点(pI)为6.10。GRAVY值为0.064,说明该蛋白是一种疏水蛋白。该序列在GenBank数据库中的登录号为BankIt2133004 Seq5 MH613772。
通过NCBI的BLASTp分析发现,薄壳山核桃CiANR的氨基酸序列与核桃的同源性最高,其他同源性较高的植物有欧洲栓皮栎、樱桃李(Prunuscerasifera)、桃等,同源性均大于80%,多重比对结果见图3A。通过NCBI的CDD数据库预测保守结构域,发现该蛋白中也包含有与DFR类似的FR_SDR_e、WcaG、HpnA和Epimerase等保守结构域,同时还含有PLN00198(原花青素还原酶)的结构域。利用MEGA 5.1对薄壳山核桃和高同源性植物进行进化树构建发现,薄壳山核桃与核桃的进化关系最近,而与茶(Camelliasinensis)、美丽葡萄(Vitisbellula)和葡萄(Vitisvinifera)的进化关系较远(图3B)。

CiANR.薄壳山核桃Carya illinoensis;;JrANR.核桃Juglans regia(XP_018805546.1);QsANR.欧洲栓皮栎Quercus suber(XP_023876696.1);PcANR.红叶李Prunus cerasifera(AKV89239.1);PpANR.桃Prunus persica(XP_007213813.1);VbANR.美丽葡萄Vitis bellula(AFG28175.1);MrANR.杨梅Morella rubra(AIX02996.1);PaANR.欧洲甜樱桃Prunus avium(XP_021828308.1);VvANR.葡萄Vitis vinifera(NP_001267885.1);PnANR.黑杨Populus nigra(ART94427.1);PmANR. 梅Prunus mume(XP_008224881.1);GhANR.棉花Gossypium hirsutum(ABM64802.1);MdANR.苹果Malus domestica(NP_001280930.1);TcANR.可可Theobroma cacao(XP_007025907.2);CsANR. 茶Camellia sinensis(ADF43751.1)。图3 CiANR氨基酸序列多重比对与系统进化树分析Fig.3 Multiple sequence alignment and phylogenetic tree constructed of amino acid homology of CiANR in pecan
2.4 薄壳山核桃CiDFR、CiLAR和CiANR基因的表达特性
利用克隆得到的基因序列设计引物,采用荧光定量PCR检测各基因在薄壳山核桃种仁发育中后期(95~165 d)各采样点的表达量见图4。
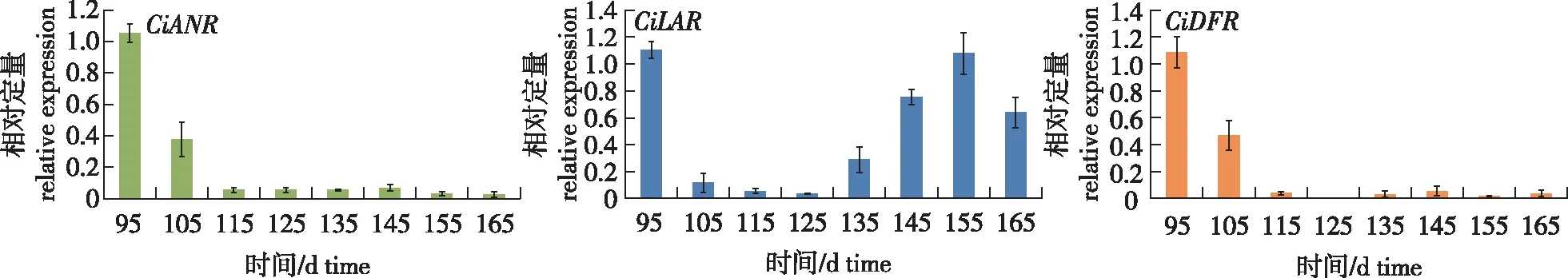
图4 薄壳山核桃CiDFR、CiLAR和CiANR基因相对表达量Fig.4 Changes of relative expression of CiDFR, CiLAR and CiANR gene in pecan
从结果(图4)中可看出,CiDFR与CiANR基因在种仁发育中期(95~105 d)表达量较高,之后快速下降至较低值。而CiLAR基因在95 d表达量较高,之后快速降低,在种仁发育后期(135~155 d)表达量又逐渐升高,在155 d回到峰值。
2.5 原花青素生物合成关键酶相关基因表达量与酚类代谢物含量的关联分析
以8个发育时期的原花青素生物合成关键酶基因表达量与酚类代谢物含量数据为对象,进行相关性热图的绘制(图5)。从热图中可看出,DFR与ANR显著正相关,而LAR与DFR、ANR均不显著相关。DFR和ANR均与TPC、儿茶素、表儿茶素、没食子酸、EGCG和DPPH显著正相关,而LAR除与ABTS显著正相关外,与CT、TFC和鞣花酸为负相关,与其他变量均为正相关。综上可看出,DFR、ANR表达量与酚类代谢物含量变化相关性较强,而LAR相关性较弱,即DFR、ANR表达量高时酚类物质含量也较高,DFR、ANR表达量低时酚类物质含量也较低。

DFR. CiDFR在qRT-PCR中的表达量 relative expression values by RT-qPCR of CiDFR;LAR.CiLAR在qRT-PCR中的表达量relative expression values by qRT-PCR of CiLAR;ANR.CiANR在qRT-PCR中的表达量relative expression values by qRT-PCR of CiANR;TPC.总酚含量total phenolic content;CT.缩合单宁condensed tannin;TFC.总黄酮含量total flavone content;C.儿茶素catechin;EC.表儿茶素epicatechin;EA.鞣花酸ellagic acid;GC.没食子酸gallic acid;EGCG.表没食子酸儿茶素没食子酸酯epigallocatechin gallate。图5 薄壳山核桃酚类代谢相关关键基因表达量与酚类代谢物含量的相关性热图Fig.5 Heat map of the expression values of key candidate genes involved in phenolic synthesis of pecan with phenolic content
3 讨 论
笔者前期通过对薄壳山核桃转录组数据的分析,筛选出可能影响薄壳山核桃原花青素生物合成的关键候选基因DFR、LAR和ANRunigene片段[12]。本研究克隆获得了薄壳山核桃CiDFR、CiDFR和CiDFR基因cDNA片段,并对其进行了生物信息学分析和种仁发育过程中的表达分析。
DFR是原花青素生物合成途径的上游关键酶,可将二氢黄烷醇还原为无色花色素。无色花色素是花色素苷、儿茶素和原花色素合成的共同前体,因此,DFR决定了花青素和原花青素通路的量,对植物体中儿茶素合成起关键作用。在本试验中,通过PCR扩增获得了编码339个氨基酸的CiDFR开放阅读框,经生物信息学分析发现该基因序列包含保守的NAD (P)结合位点和底物特异性结合位点,属于二氢还原酶基因家族。DRF在还原型辅酶Ⅱ(NADPH)的辅助下,可选择性地催化3种二氢黄酮醇(DHK、DHQ和DHM)形成相应的不稳定无色花青素。早期的研究发现DFR基因保守的底物特异性区域中,第134位氨基酸和第145位的氨基酸会直接影响到DFR的底物特异性。大多数植物的DFR在第l34位是天冬酰胺(N)或天冬氨酸(D),在145位大多是谷氨酸(E),能有效地把DHK还原为天竺葵色素。而一些植物的DFR,如矮牵牛(Petuniahybrida)和兰花(Cymbidiumhybrida),在134位和145位分别是天冬氨酸(D)和谷氨酰胺(Q),可催化DHQ和DHM,但不能以DHK为底物[16-17]。在本试验中,CiDFR的第103位为天冬酰胺(N),第114 位为谷氨酸(E),推测它们与其他植物的第134位和第145位相对应,能以DHK为底物。但Petit等[18]对葡萄DFR酶的晶体结构分析认为,DFR对底物的识别不能完全依赖于DFR酶的134位氨基酸。因此,后期还需要对其进行一系列酶活性分析进一步确定。
DFR作为原花青素和花青素合成途径的关键酶在茶(Camelliaspp.)以及一些观赏植物,尤其是观花植物中得到了大量研究。当DFR功能遭到破坏后,植物体花青素和原花青素的含量明显下降,而转入DFR基因后花青素和原花青素的含量明显上升[19-20]。不同发育阶段植物DFR基因的特性表达具有一定的差异。DFR基因在白茶(Camelliasinensiscv. Fuding-dabaicha)萎凋32 h表达量最高,而后表达量逐渐降低[21];葡萄风信子(Muscaribotryoides)的2个DFR基因,MaDFR2a和MaDFR2b都在花中优势表达,并在完全着色的花蕾(S3)时期表达量达到峰值,此后随着花色变淡,表达量逐渐降低[22];菊花(Chrysanthemumspp.)DFR基因在舌状花初显、伸长及花瓣伸长时表达量增高,而后随着花序的开放表达量逐渐下降[23];桂花(Qsmanthusfragrans)OfDFR基因的表达量随花期呈现先上后下降的趋势,初花期表达量最高,随后显著下降,盛花期表达水平降低[24]。在本研究中发现,薄壳山核桃CiDFR基因在种仁发育中期(95~105 d)表达量高,之后显著下降。这与前期转录组研究中编码该DFR的unigene在种仁发育中期表达量最高相一致,说明了CiDFR在薄壳山核桃酚类代谢中非常活跃,发挥重要作用。
LAR基因以单拷贝或多拷贝存在,而翻译后的LAR酶属于短链脱氢酶/还原酶家族和PIP家族[25]。笔者克隆获得的CiLAR蛋白中包含典型的苯(基)香豆素苄基醚还原酶的结构域,证明属于短链脱氢/还原酶超家族成员。LAR直接催化无色花青素(黄烷-3,4-二醇)转化为儿茶素(C)和没食子儿茶素(GC)[6],其表达量的高低与儿茶素的含量直接相关。Li等[26]将玉米(Zeamays)中的 Lc(leafcolour)转录因子转入苹果植株中发现转基因植物中LAR的表达量升高,且儿茶素大量积累。在转LAR基因烟草中,外源LAR基因的过量表达并没有使原花青素和儿茶素积累增加[27]。在模式植物拟南芥中未发现LAR,并只能合成表儿茶素[28-29]。大量研究表明,LAR基因具有很强的组织和时空表达的特异性。对金荞麦(Fagopyrumdibotrys)根茎不同生长发育阶段中LAR基因的表达量和类黄酮含量进行检测发现,LAR与类黄酮的积累有关,但在营养生长阶段LAR的表达量和类黄酮的积累与在生殖生长阶段表现却不同[30]。在葡萄种子和果皮中,儿茶素的含量与LAR基因表达量会随着果实的发育呈现一致的规律性变化[31]。在笔者的研究中,CiDFR在薄壳山核桃种仁发育过程中呈现升高—降低—升高的趋势,并与儿茶素和没食子酸呈现显著正相关,进一步说明LAR与儿茶素的合成紧密相关。
表儿茶素和表没食子儿茶素(epicatechin gallate, EGC)分别是花青素还原酶(ANR)的直接产物。本研究预测的CiANR保守结构域与CiDFR基本类似,说明ANR与DFR结构与功能类似,这与拟南芥中的结果一致[10-11]。Xie等[32]将蒺藜苜蓿(Medicagotruncatula)的MtANR基因和PAP1基因转入烟草体内进行共表达,烟草叶片中两个基因均有表达,儿茶素和表儿茶素含量增加。超量表达茶树CsANR基因,转基因烟草体内黄烷增加而花青素减少,花色变白[33],说明表儿茶素与花青素的合成存在竞争关系,ANR的高表达会导致花青素含量减少而表儿茶素或原花青素含量增加。此外,ANR基因在不同时期表达量也有差异。葡萄的花和果实在发育的过程中,VvANR基因表达量呈现升高趋势,原花青素积累,但在果实成熟的时候几乎检测不到VvANR基因的表达[34]。在转录层面上,CiANR的表达趋势与CiDFR一致,其在种仁发育中期(95~105 d)表达量到达峰值,之后急剧下降。
CiDFR与CiANR基因在儿茶素代谢过程中的密切相关性经关联分析也得到了印证,两者与酚类代谢物含量变化相关性较强,而CiLAR基因与酚类代谢物含量变化的相关性较弱。在金花茶(Camelliapetelotii)的研究中表明,DFR与LAR在儿茶素代谢过程中密切相关,并且在不同苯丙氨酸添加量处理下,DFR与LAR表达量变化均与总儿茶素含量变化呈显著正相关关系[35]。而本研究的结果与之不同,CiLAR与CiDFR的相关性较差,与种仁中儿茶素的变化趋势也不一致。种仁中儿茶素的含量在酚类物质中最多,且在种仁发育中期最高,之后快速降低至较低值[3]。CiLAR基因的表达量在种仁发育的中期(95 d)及后期(155 d)均出现一个高峰,前者可能与儿茶素的大量合成有关,而后者说明CiLAR基因极有可能除了在儿茶素的合成途径中发挥作用外,还在其他酚类物质的合成过程中发挥重要作用,这有待今后进行进一步研究。
