用水浸—分步沉淀法从不锈钢酸洗污泥中回收镍铁铬
2022-10-19施春红左向萌王晓臣
施春红,周 朔,左向萌,王晓臣,王 程
(1.北京科技大学 能源与环境工程学院,北京 100083;2.工业典型污染物资源化处理北京市重点实验室,北京 100083)
不锈钢酸洗污泥中含有多种重金属元素,属于危险废物[1-3],若处理不当会破坏生态环境,并造成资源浪费[4-6]。将污泥中的金属元素通过浸出转移至溶液中,再通过沉淀分离,可以实现酸洗污泥的无害化与资源化[7-10]。
目前,从固体废物中浸出金属的方法有酸浸、氨浸、微生物浸出和水浸[11-15]。相比较而言,水浸法常用于从碳热还原[16]和钠化焙烧[17]、酸化焙烧[18-21]后的焙砂中浸出有价金属[15-21],直接用水浸出金属的研究较少。试验根据污泥特性,研究了以水浸法从不锈钢酸洗污泥中浸出金属,并对浸出液中的金属离子采用分步沉淀方式加以回收,以期为从不锈钢酸洗污泥中回收有价金属提供一种可供选择的绿色环保方法。
1 试验部分
1.1 试验原料
不锈钢酸洗污泥:南京某公司不锈钢硫酸酸洗废液经浓缩结晶产生的污泥,化学成分见表1,物相组成如图1所示。
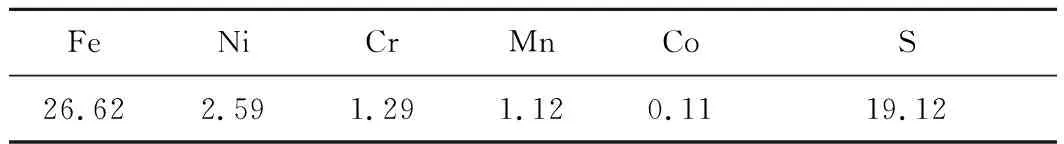
表1 不锈钢酸洗污泥的主要化学成分 %
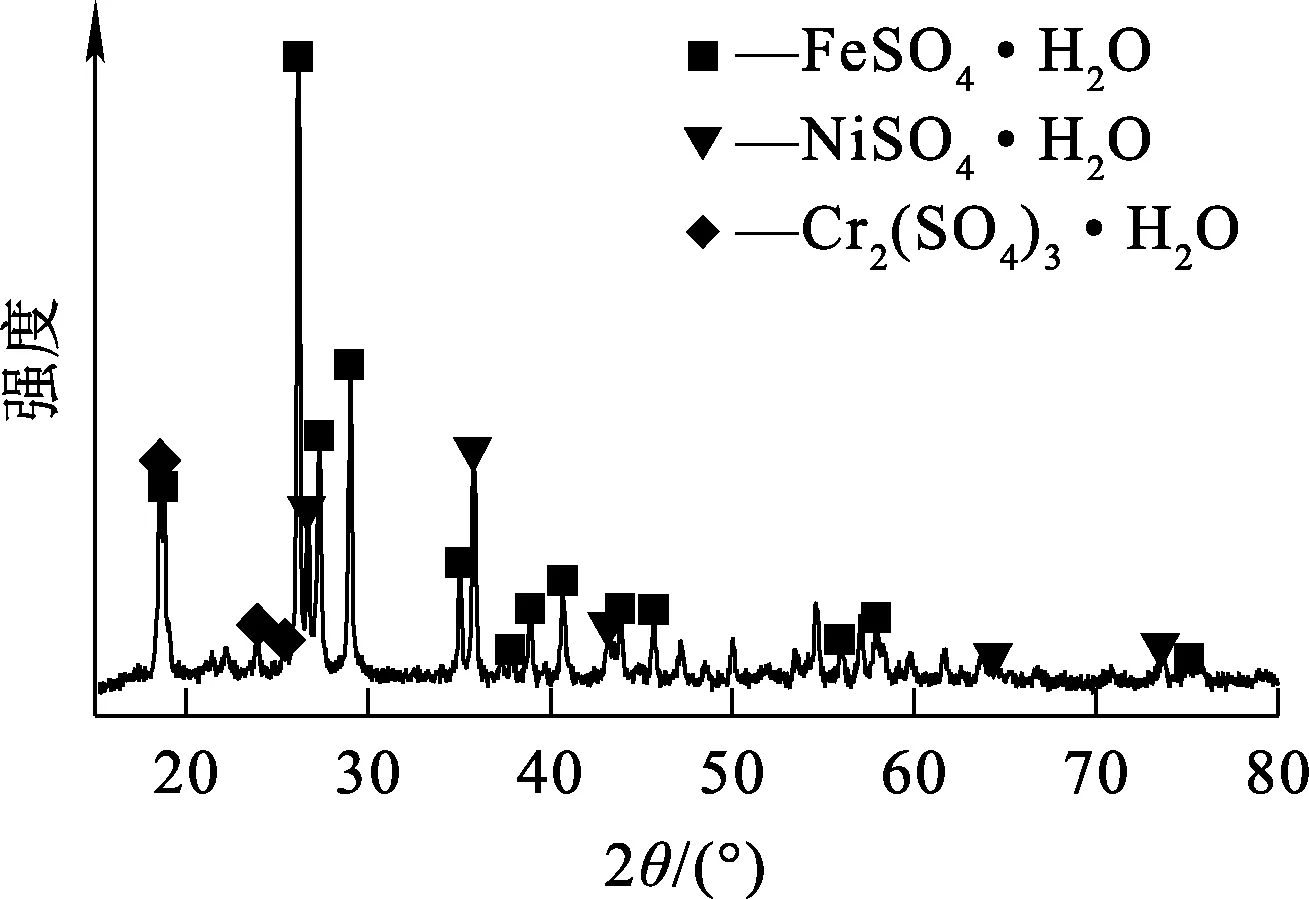
图1 不锈钢酸洗污泥的XRD图谱
试剂:水,去离子水;硫化钠,麦克林试剂有限公司;氨水、草酸、硫酸,国药集团化学试剂有限公司;氢氧化钠,北京通广精细化工公司。所有试剂均为分析纯。
1.2 分析方法与仪器
溶液中的金属离子浓度由电感耦合等离子体发射光谱仪测定。
主要仪器:ICP-OES,ICP-7000型,美国赛默飞世尔科技公司;磁力搅拌器,84-1A6S型,上海司乐仪器有限公司;超声波清洗器,KQ3200DE型,昆山市超声仪器有限公司;pH计,PHS-2F型,上海雷磁仪器有限公司;离心机,H1750R型,湖南湘仪实验室仪器开发有限公司。
1.3 试验原理与方法
对于Fe2+0.4 mol/L、Cr3+0.01 mol/L、Ni2+0.02 mol/L的溶液,25 ℃、常压条件下,Fe-H2O、Ni-H2O、Cr-H2O体系的φ-pH关系曲线如图2所示[22-26]。
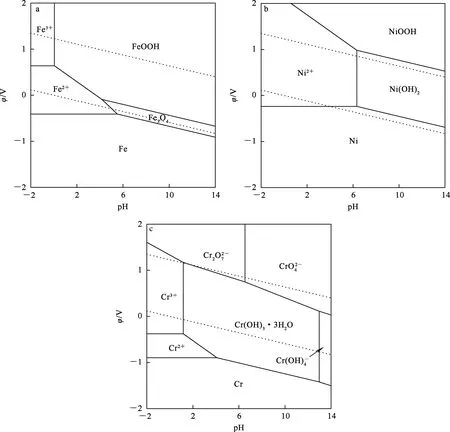
图2 Fe-H2O(a)、Ni-H2O(b)、Cr-H2O(c)体系的φ-pH关系曲线
不锈钢酸洗污泥的浸出:取一定质量不锈钢酸洗污泥于烧杯中,加入水,利用恒温磁力搅拌器/超声清洗器充分混合,反应后通过离心机固液分离,再通过0.45 μm滤膜过滤后以ICP分析其中有价金属质量浓度,计算金属元素浸出率。计算公式如下:
(1)
式中:r—金属元素浸出率,%;ρ—浸出液中金属离子质量浓度,mg/L;V—浸出液体积,mL;m—酸洗污泥质量,g;w—金属元素在酸洗污泥中的质量分数,%。
浸出液中镍、铁、铬的分步沉淀:浸出液中的主要金属元素以Ni2+、Fe2+、Cr3+形式存在,根据金属硫化物在溶液中的溶度积的差异,可先沉淀分离出镍;再通过Fe2+与草酸生成草酸亚铁沉淀分离除铁;最后用NaOH调节溶液pH使铬生成氢氧化铬沉淀,实现镍、铁、铬的分离。
相应条件下,镍、铁、铬的沉淀反应如下:
硫化物沉淀镍[27],

(2)
草酸沉淀铁[28],

(3)
氢氧化钠沉淀铬[29],

(4)
镍、铁、铬沉淀率按式(5)、(6)、(7)计算。
(5)
(6)
(7)
式中:η1、η2、η3—镍、铁、铬离子沉淀率,%;ρ1—原始浸出液中Ni2+质量浓度,mg/L;ρ2—除镍后浸出液中剩余Ni2+质量浓度,mg/L;ρ3—除镍后浸出液中Fe2+质量浓度,mg/L;ρ4—除铁后浸出液中剩余Fe2+质量浓度,mg/L;ρ5—除铁后浸出液中Cr3+质量浓度,mg/L;ρ6—除铬后浸出液中剩余 Cr3+质量浓度,mg/L。
2 试验结果与讨论
2.1 不锈钢酸洗污泥的浸出
2.1.1 浸出方式对金属浸出率的影响
温度25 ℃,固液质量体积比1/10,不锈钢酸洗污泥质量2 g,浸出时间60 min,采用搅拌和超声辅助浸出,浸出方式对金属浸出率的影响试验结果如图3所示。
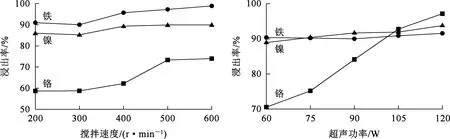
图3 浸出方式对金属浸出率的影响
由图3看出:随搅拌速度增大,铁、镍、铬浸出率提高;搅拌速度增大至500 r/min时,铁、镍、铬浸出率分别达97%、90%、73%,并趋于稳定;随超声功率增大,铁、镍浸出率无明显变化,均在90%左右;超声功率为120 W时,铬浸出率提高至97%。超声波在液体介质中会产生空化气泡,在空化气泡不断生长至破裂过程中会产生局部高温高压,进而促进相界面更新,强化传质过程,从而提高有价金属浸出率[30]。因此,采用超声辅助浸出可以有效提高金属元素浸出率。综合考虑,确定超声功率以120 W为宜。
2.1.2 浸出时间对金属浸出率的影响
温度25 ℃,固液质量体积比1/10,不锈钢酸洗污泥质量2 g,超声功率120 W,浸出时间对金属浸出率的影响试验结果如图4所示。可以看出:随浸出时间延长,金属浸出率不断升高;浸出60 min时,铁、镍、铬浸出率分别达91%、97%、90%,并趋于稳定。随浸出时间延长,液固两相间的传质更充分,水溶性物质溶解反应更趋于完全,金属浸出更完全[31]。综合考虑,确定浸出时间以60 min为宜。
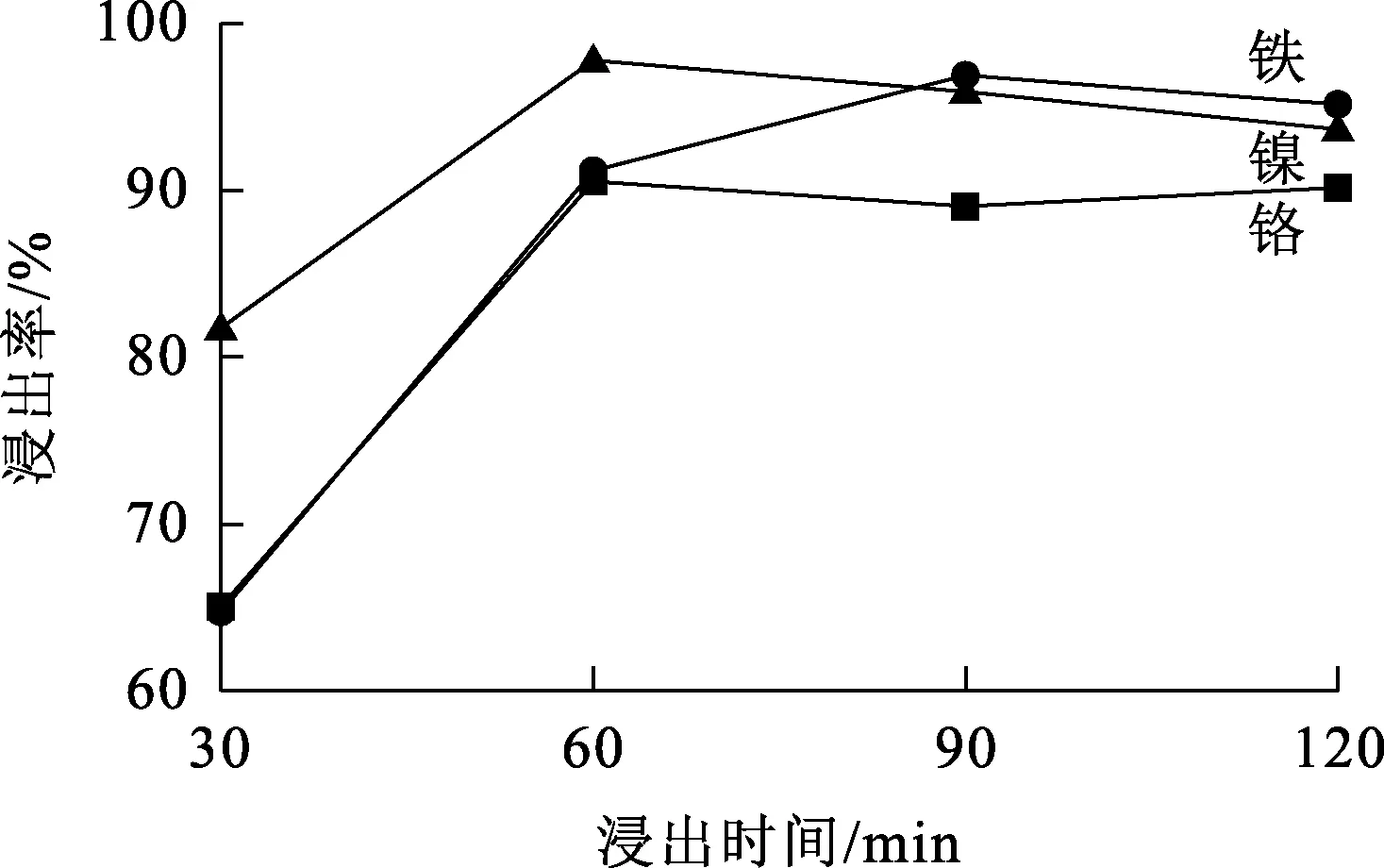
图4 浸出时间对金属浸出率的影响
2.1.3 固液质量体积比对金属浸出率的影响
温度25 ℃,不锈钢酸洗污泥质量2 g,浸出时间60 min,超声功率120 W,固液质量体积比对金属浸出率的影响试验结果如图5所示。
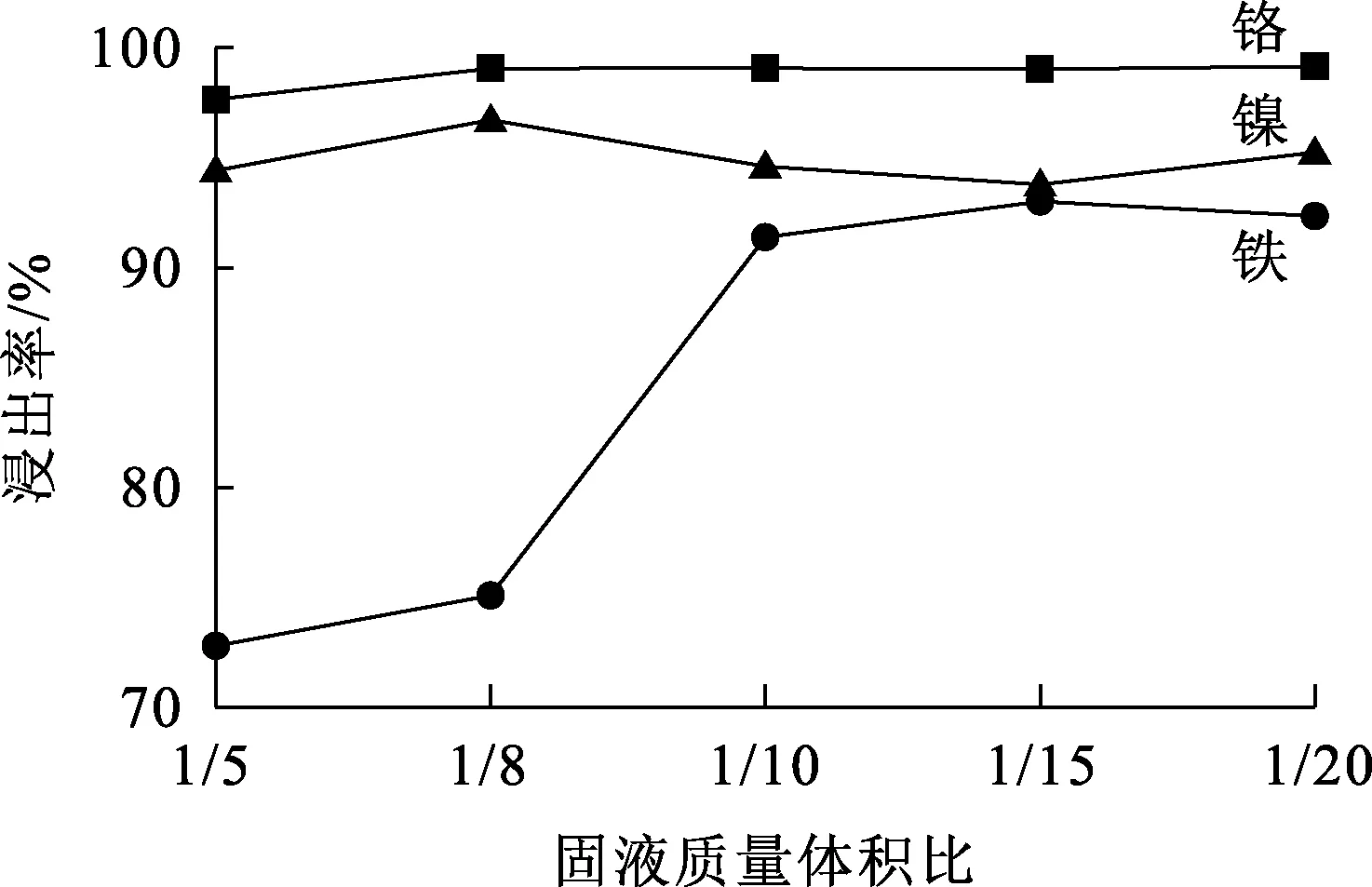
图5 固液质量体积比对金属浸出率的影响
由图5看出:随固液质量体积比降低,铬、镍浸出率变化不大,均在90%以上,铁浸出率明显提高;固液质量体积比降至1/10时,铁浸出率升至91%。固液质量体积比较大时,体系黏稠度相对较大,液相传质能力较差,反应不完全;随固液质量体积比降低,固液两相接触面积增大,传质能力增大,液固两相之间的反应更充分[32-33],更有利于金属浸出。考虑到固液质量体积比越低,浸出液中金属元素浓度越低,不利于后续沉淀回收,因此确定适宜固液质量体积比为1/10。此条件下,镍、铁、铬浸出率分别为94%、91%、99%。
2.1.4 浸出渣形貌分析
在试验确定的最佳条件下进行浸出,浸出前、后污泥的SEM-EDS分析图谱及EDS分析结果分别见图6和表2。可以看出:污泥浸出前后,形貌发生明显变化,浸出前为片层组成的花朵状,浸出后转变为棒状组成的块状;颗粒粒径浸出前约15.15 μm,浸出后约6.85 μm;金属元素较浸出前分布更均匀,且元素含量大幅减少。
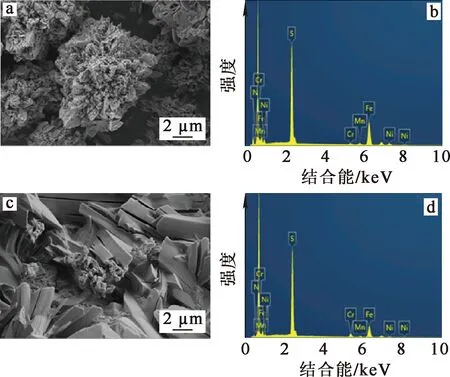
a、c—浸出前、后的SEM图像;b、d—浸出前、后的EDS图谱。图6 不锈钢酸洗污泥水浸前、后的SEM-EDS分析结果
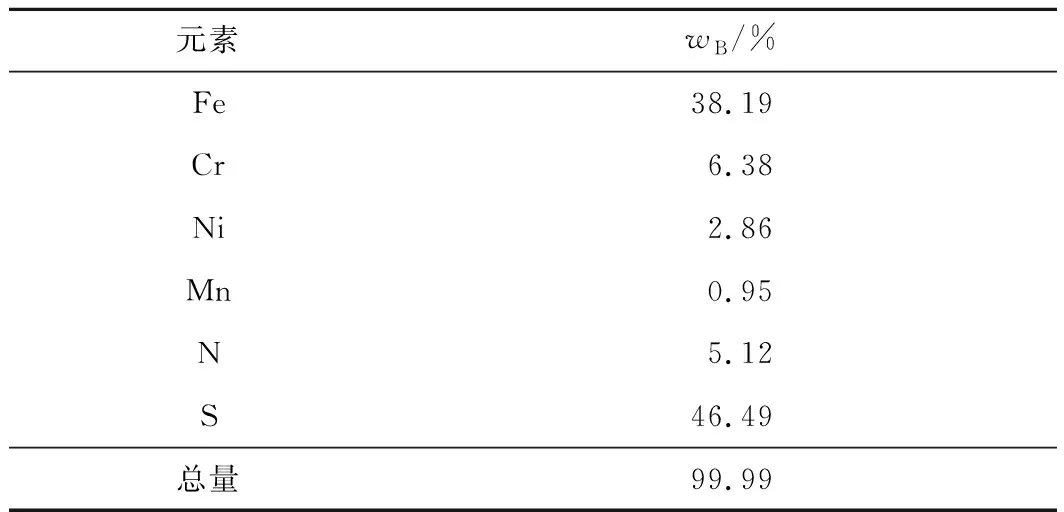
表2 不锈钢酸洗污泥水浸后EDS分析结果
2.2 浸出液中 镍、铁、铬的分步沉淀
上述优化条件下水浸不锈钢酸洗污泥,所得浸出液中Ni2+、Fe2+、Cr3+质量浓度分别为2.43、24.22、1.28 g/L,浸出液pH约为1。
镍与铁的硫化物溶度积存在较大差异[34],据此可优先沉淀镍。沉镍后溶液中含有Cr3+、Fe2+。Fe2+可与草酸反应生成草酸亚铁沉淀,而Cr3+不与草酸发生沉淀反应,据此可将二者分离[35]。最后体系中加入氢氧化钠调节pH,可将Cr3+转成氢氧化铬沉淀。
2.2.1 镍的沉淀分离
2.2.1.1 硫化钠用量对镍沉淀率的影响
温度40 ℃,反应时间30 min,硫化钠用量对镍沉淀率的影响试验结果如图7所示。可以看出:随硫化钠用量增加,镍沉淀率逐渐升高;硫化钠用量为理论量的4倍时,镍沉淀率达90%以上,铁、铬损失率在10%左右;继续增加硫化钠用量,镍沉淀率无较大提升,但铁和铬损失率升高。这是因为部分铁、铬离子会夹杂在硫化镍中一起沉淀下来[36],因此,确定硫化钠用量以理论量的4倍为宜。
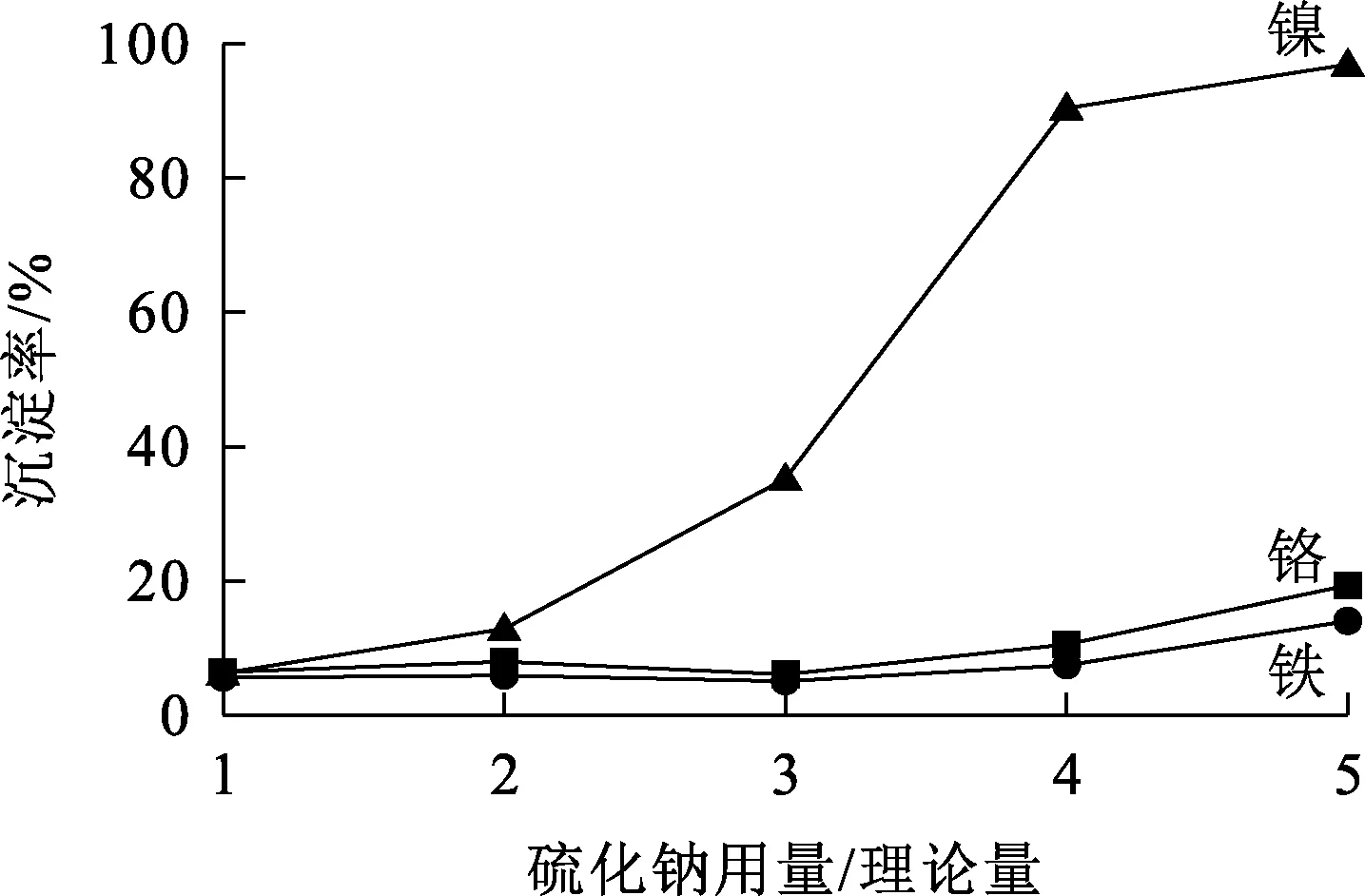
图7 硫化钠用量对镍沉淀率的影响
2.2.1.2 反应时间对镍沉淀率的影响
温度40 ℃,硫化钠用量为理论量的4倍,反应时间对镍沉淀率的影响试验结果如图8所示。
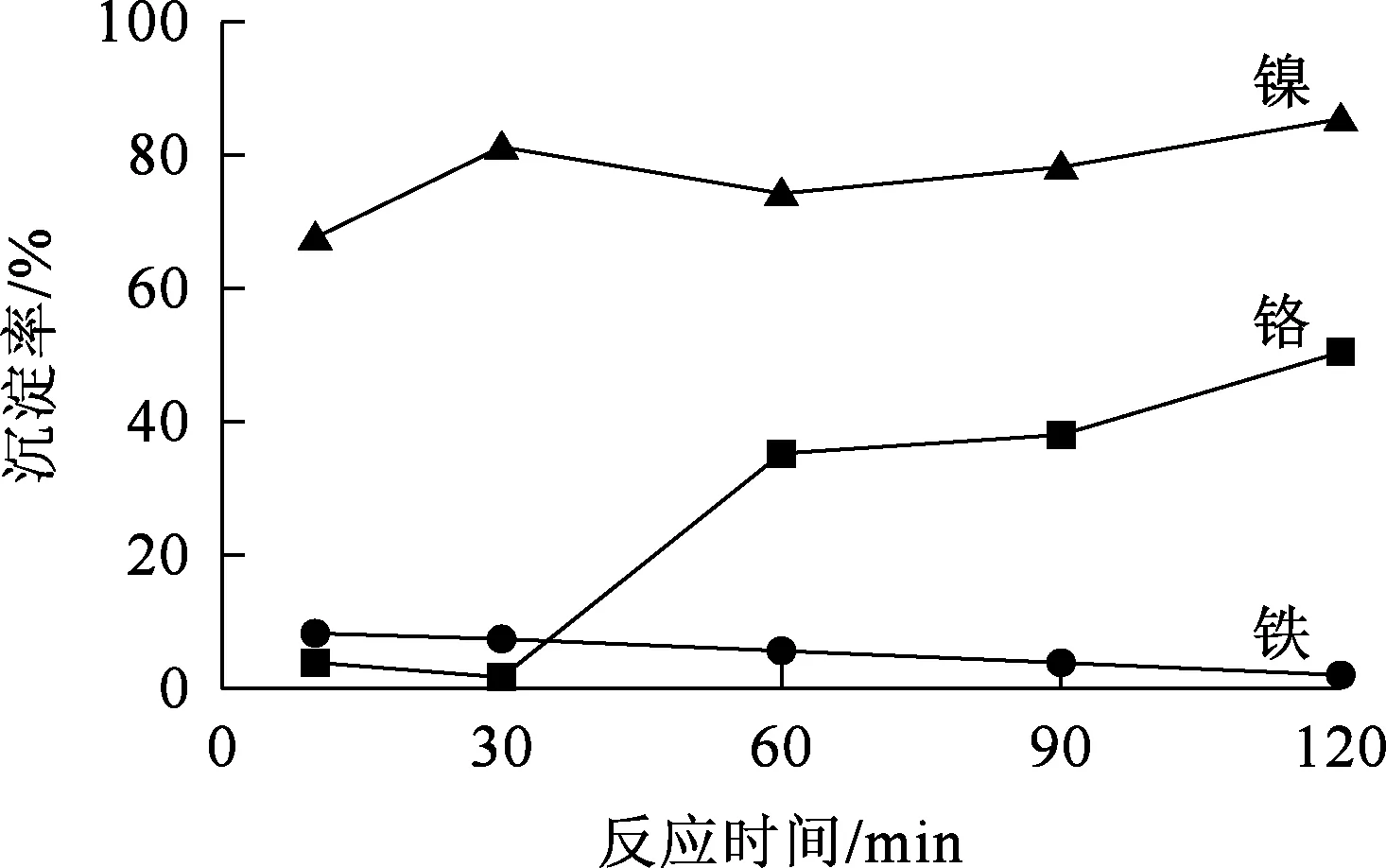
图8 反应时间对镍沉淀率的影响
由图8看出:随反应进行,镍沉淀率逐渐升高;反应30 min后,镍沉淀率略有降低但总体趋于稳定,而铬损失率大幅提高。反应时间延长,固液接触更充分,镍离子与硫离子反应也更完全;但大量沉淀的生成抑制了离子的运动,使镍的沉淀反应受到影响[27],而铬的沉淀反应却加剧,造成损失加大。综合考虑,确定反应时间以30 min为宜。
2.2.1.3 反应温度对镍沉淀率的影响
反应时间30 min,硫化钠用量为理论量的4倍,反应温度对镍沉淀率的影响试验结果如图9所示。可以看出:随反应温度升高,镍沉淀率升高,铁、铬损失率变化不大;温度高于40 ℃,镍沉淀率趋于稳定,而铬损失率仍维持在10%左右。镍离子沉淀率随温度升高而升高,是因为在非氧化还原反应中,温度越高反应速度越快[37]。综合考虑,确定反应温度以40 ℃为宜。

图9 反应温度对镍沉淀率的影响
2.2.1.4 镍沉淀渣的形貌及组成
镍沉淀渣的SEM图像和部分区域EDS扫描元素映射图像如图10所示,EDS分析结果见表3。可以看出:镍沉淀渣为聚集状颗粒,颗粒与颗粒之间紧密团聚,单个颗粒粒径约400 nm。渣中镍得到富集。

图10 镍沉淀渣的SEM图像(a、b)和EDS元素图像(c~h)

表3 镍沉淀渣的EDS分析结果
2.2.2 铁的沉淀分离
浸出液分离Ni2+后,添加草酸沉淀Fe2+。室温下,草酸与Cr3+形成配合物的速度较慢,与Fe2+形成沉淀的速度很快[38]。草酸沉淀铁的反应温度设定为25 ℃。
2.2.2.1 草酸用量对铁沉淀率的影响
温度25 ℃,反应时间60 min,草酸用量对铁沉淀率的影响试验结果如图11所示。
图11 草酸用量对铁沉淀率的影响
由图11看出:随草酸用量增加,铁沉淀率升高;草酸用量增至理论量的1.2倍时,铁沉淀率达最大并趋于稳定。草酸用量低于理论量时,反应物之间相互作用不充分,反应不完全,随草酸用量增加,其与铁的反应更充分,铁几乎完全沉淀;铬几乎不沉淀。综合考虑,确定草酸用量以理论量的1.2倍为宜。
2.2.2.2 反应时间对铁沉淀率的影响
温度25 ℃,草酸用量为理论量的1.2倍,反应时间对铁沉淀率的影响试验结果如图12所示。

图12 反应时间对铁沉淀率的影响
由图12看出:反应时间对铁的沉淀影响不大,反应10 min时,铁沉淀率已达90%以上,继续反应,铁沉淀率逐渐平稳;反应60 min时,铬损失率略有降低。从铬回收角度考虑,确定反应时间以60 min为宜。
2.2.2.3 溶液pH对铁沉淀率的影响
溶液初始pH=2.6,温度25 ℃,草酸用量为理论量的1.2倍,反应时间60 min,用1 mol/L硫酸和1 mol/L氨水溶液调节溶液pH,溶液pH对铁沉淀率的影响试验结果如图13所示。
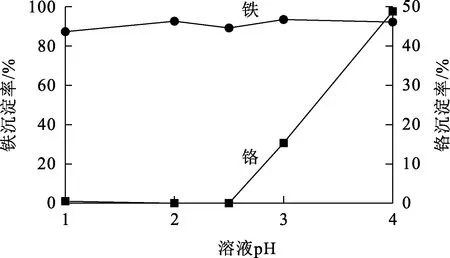
图13 溶液pH对铁沉淀率的影响
由图13看出:溶液pH对铁沉淀率影响不大;溶液pH高于2.5,铬损失率提高明显。铁在沉淀过程中对铬有共吸附作用,且随pH增大,铬会以氢氧化铬形式逐渐析出,造成铬的损失[36]。综合考虑,确定在沉淀铁时,不必调节溶液pH。
2.2.2.4 铁沉淀渣的形貌及组成
铁沉淀渣的SEM图像和部分区域EDS扫描元素映射图像如图14所示,EDS分析结果见表4。

图14 铁沉淀渣SEM图像(a、b)和EDS元素图像(c~h)

表4 铁沉淀渣的EDS分析结果
由图14和表4看出:在最佳条件下对铁进行沉淀,产生的草酸亚铁沉淀的形貌为规则的长方体形,其粒径在5 μm左右,草酸亚铁沉淀的纯度达91%。
2.2.3 铬的沉淀分离
除铁后,溶液中的铬有两种形式,分别为Cr3+和草酸与铬的阴离子配合物。可用氢氧化钠沉淀铬。氢氧化铬属于两性氢氧化物,在强碱性条件下会溶解(pH>9.5),因此控制溶液pH很重要[39]。
2.2.3.1 溶液pH和反应时间对铬沉淀率的影响
除铁后的溶液中,滴加1.5 mol/L NaOH溶液调pH,溶液pH和反应时间对铬沉淀率的影响试验结果如图15所示。
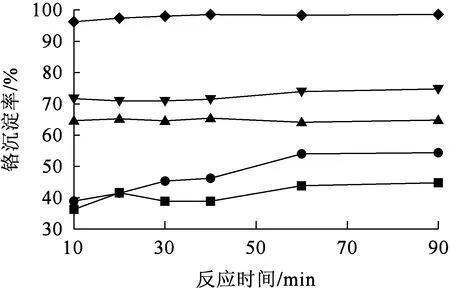
—◆—pH=9; —●—pH=5; —▼—pH=8;—■—pH=3; —▲—pH=7。图15 溶液pH和反应时间对铬沉淀率的影响
由图15看出:溶液pH为3、5时,随反应进行,铬沉淀率变化较大;溶液pH大于7后,随反应进行,铬沉淀率变化不大。相同反应时间条件下,随溶液pH升高,铬沉淀率提高。溶液pH较低时,Cr3+生成氢氧化物沉淀不完全,随pH升高沉淀趋于完全[39]。综合考虑,确定铬沉淀时,溶液适宜pH=9,最佳反应时间为30 min。
2.2.3.2 铬沉淀渣的形貌及组成分析
铬沉淀渣的SEM图像和部分区域EDS扫描元素映射图像如图16所示,EDS分析结果见表5。可以看出:铬沉淀物为块状,铬有明显富集。

图16 铬沉淀渣的SEM图像(a、b)和EDS元素图像(c~h)
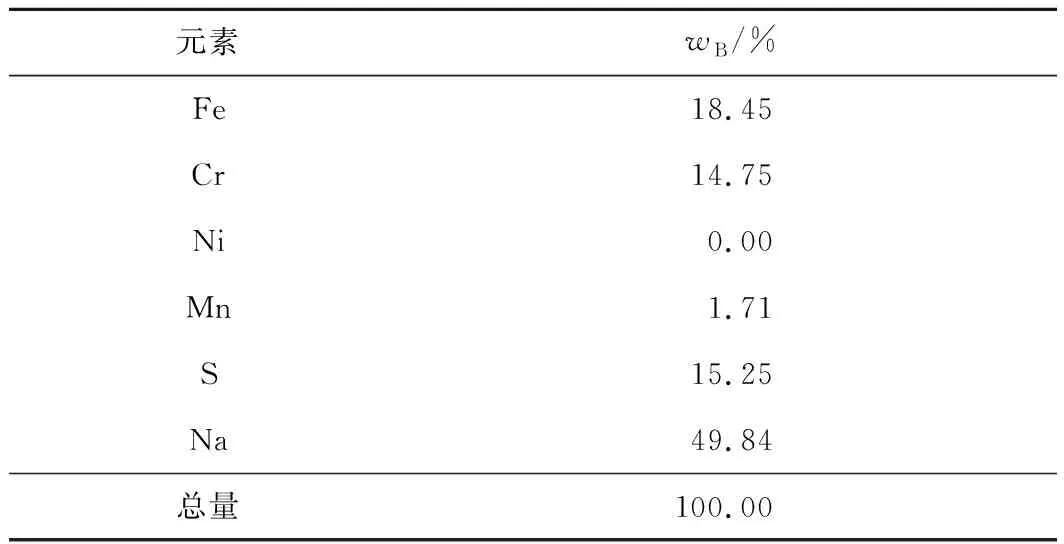
表5 铬沉淀渣的EDS分析结果
3 结论
采用水浸法从不锈钢酸洗污泥中浸出镍、铁、铬金属元素是可行的。适宜条件下,镍、铁、铬元素浸出率均在90%以上。浸出液中的金属离子可通过分步沉淀法分离,适宜条件下,镍、铁、铬沉淀率分别为90%、97%、98%,分离效果较好。水浸—分步沉淀法操作简单,且成本很低。
