富马酸替诺福韦酯治疗的慢性乙型肝炎患者3年血清HBV DNA和HBsAg的动态变化
2022-10-19党双锁刘怡欣王怡恺刘晨瑞李亚萍吴凤萍
鲁 瑞, 党双锁, 刘怡欣, 王怡恺, 刘晨瑞, 李亚萍, 吴凤萍, 李 梅
西安交通大学第二附属医院 感染科, 西安 710004
富马酸替诺福韦酯(TDF)具有强效、极低耐药、安全性高、给药方便、价格便宜等特点,是目前国内外指南推荐的一线抗HBV药物[1-2]。本研究拟观察CHB患者使用TDF抗病毒治疗3年HBV DNA和HBsAg的动态变化。
1 资料与方法
1.1 研究对象 选取2015年1月—2020年8月就诊于西安交通大学第二附属医院的单用TDF治疗的CHB患者。纳入标准:(1)符合《慢性乙型肝炎防治指南(2019年版)》[1]中的CHB诊断标准;(2)年龄≥18岁;(3)单用TDF(富马酸替诺福韦二吡呋酯片,齐鲁制药有限公司)抗病毒治疗≥3年;(4)病历资料完整。排除标准:(1)既往使用过其他核苷(酸)类似物(NUC)或干扰素治疗;(2)合并其他病因导致的肝损伤(如酒精性肝病、药物性肝损伤、自身免疫性肝病);(3)合并其他嗜肝病毒感染;(4)伴有肝硬化、肝癌或其他系统肿瘤;(5)使用免疫抑制剂。按照基线HBeAg水平分为HBeAg阴性组和HBeAg阳性组。
1.2 观察指标 观察HBeAg阳性及HBeAg阴性患者在治疗基线、1年、2年、3年各时间点的HBV DNA定量及HBsAg水平,分析其动态变化情况,并比较两组患者在上述时间点HBsAg水平分布情况。
1.3 检测方法 采用荧光定量PCR法检测血清HBV DNA定量,使用罗氏公司全自动AmpliPrep/COBAS TaqMan 48系统检测仪及配套试剂,最低检测下限为20 IU/mL;当患者HBV DNA<20 IU/mL时,定义为HBV DNA检测不到即阴转,并按19 IU/mL来计算HBV DNA对数值;采用化学发光法检测血清HBV标志物,使用美国雅培Architect i2000化学发光免疫分析仪及其配套试剂,HBsAg最低检测下限为0.05 IU/mL。本院HBsAg定量检测上限为25 000.00 IU/mL,即当患者HBsAg>25 000.00 IU/mL时,均按照25 000.00 IU/mL录入数据并统计分析。

2 结果
2.1 基线特征 共纳入CHB患者157例,年龄19~70岁,平均年龄(38.8±10.6)岁,男女比例1.09∶1。HBeAg阳性患者73例(46.5%),HBeAg阴性患者84例(53.5%),其中包括1例治疗前即为HBsAg阴性且高HBV DNA定量患者。HBeAg阳性患者更年轻,HBV DNA定量及HBsAg水平显著高于HBeAg阴性患者(P值均<0.001)。其他基线指标两组比较差异均无统计学意义(P值均>0.05)(表1)。

表1 患者的基线特征
2.2 HBV DNA的动态变化 HBeAg阳性组基线HBV DNA定量为(5.7±2.3)log10IU/mL,HBeAg阴性组基线HBV DNA定量为(3.9±1.5)log10IU/mL。TDF抗病毒治疗1年时,HBeAg阳性和HBeAg阴性患者的HBV DNA定量分别为(2.1±1.4)log10IU/mL和(1.5±0.5)log10IU/mL,HBV DNA转阴率分别为65.8%和81.0%,差异具有统计学意义(χ2=4.676,P<0.05)。TDF治疗2年时,HBeAg阳性和HBeAg阴性患者的HBV DNA定量分别为(1.6±0.9)log10IU/mL和(1.3±0.2)log10IU/mL,HBV DNA阴转率差异有统计学意义(P<0.05)。TDF治疗3年,HBV DNA阴转率差异无统计学意义(P>0.05)(图1)。
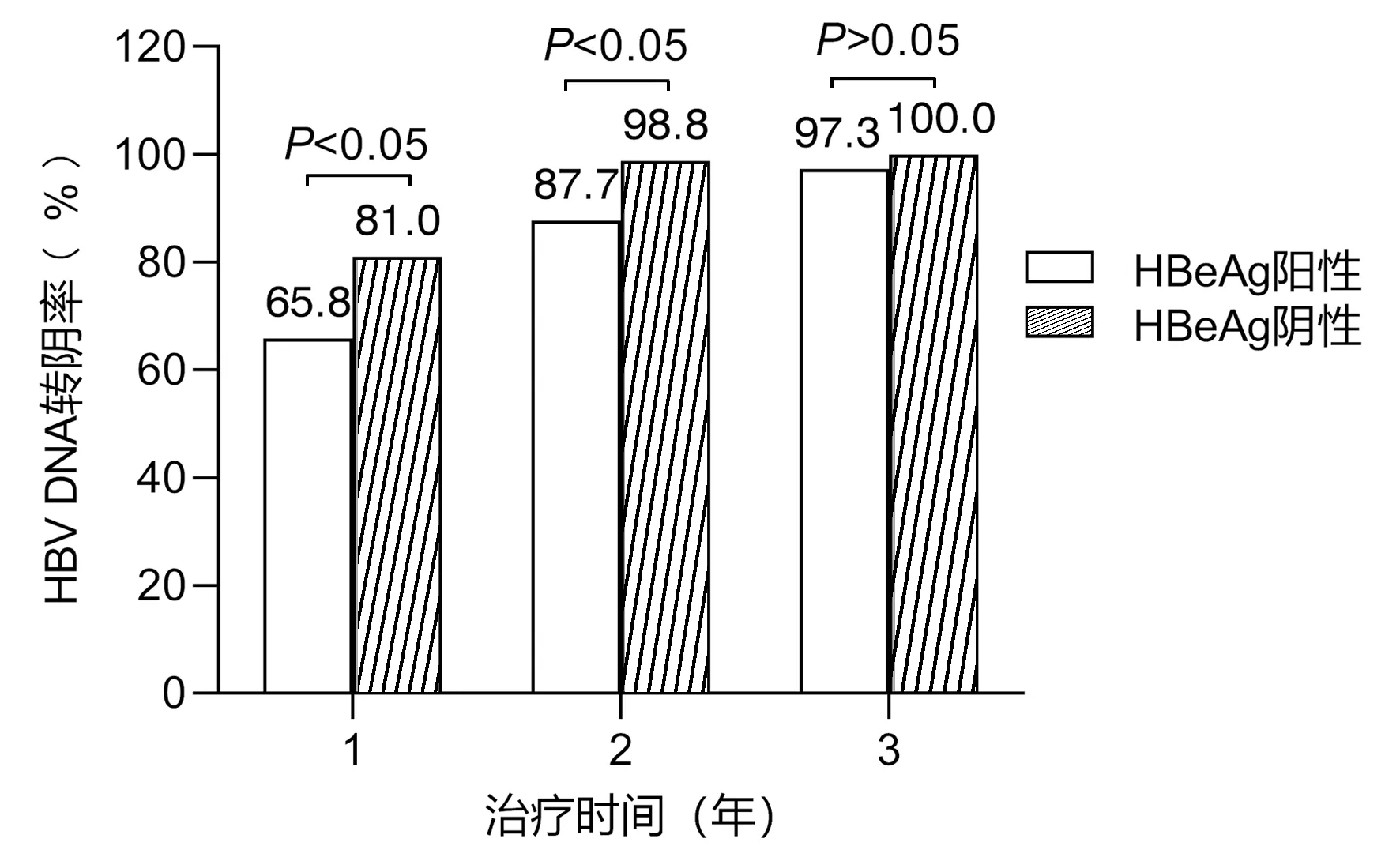
图1 各治疗时间点上HBV DNA阴转率
2.3 HBsAg的动态变化 随着TDF抗病毒时间的延长,HBsAg水平在HBeAg阳性和HBeAg阴性患者中均呈下降趋势,组内比较差异均有统计学意义(F值分别为26.850和8.096,P值均<0.001)。且在各时间点上,HBeAg阳性患者HBsAg水平显著高于HBeAg阴性患者(F=25.456,P<0.001)(表2)。
对基线HBsAg水平进行分层,不同基线HBsAg水平的HBeAg阳性和HBeAg阴性患者在TDF治疗期间,HBsAg水平均呈现不断下降趋势(P值均<0.05)(表3、4)。
HBeAg阳性患者在TDF治疗过程中,中位HBsAg水平在第1年时下降1 856.5(158.4~12 103.1)IU/mL,第2年时下降879.8(130.5~2 382.5)IU/mL,第3年时下降479.9(95.0~1 662.4)IU/mL,差异有统计学意义(F=10.972,P<0.001)。HBeAg阴性患者在TDF治疗过程中,中位HBsAg水平在第1年时下降130.3(-0.6~482.2)IU/mL,第2年时下降159.0(8.2~346.6)IU/mL,第3年时下降78.9(4.7~284.0)IU/mL,差异无统计学意义(F=0.513,P>0.05)。HBeAg阳性患者HBsAg水平下降显著高于HBeAg阴性患者,差异有统计学意义(F=17.251,P<0.001)(图2)。

图2 HBsAg水平动态变化

表2 各时间点HBeAg阳性和HBeAg阴性患者HBsAg水平

表3 不同基线HBsAg水平的HBeAg阳性患者HBsAg水平的3年动态变化

表4 不同基线HBsAg水平的HBeAg阴性患者HBsAg水平的3年动态变化
2.4 治疗不同时间点HBsAg水平的分布情况 TDF治疗过程中,HBsAg水平在<1500 IU/mL以内的各区段累积百分比逐渐上升。TDF治疗第1、2、3年,HBsAg的阴转率分别为0.6%(1/157)、0.6%(1/157)、1.3%(2/157),差异无统计学意义(χ2=0.504,P=0.777)。TDF治疗第1、2、3年,HBsAg<100 IU/mL的患者占比分别为8.3%(13/157)、11.5%(18/157)、14.0%(22/157),差异无统计学意义(χ2=2.594,P=0.273)。TDF治疗第1、2、3年,HBsAg<1000 IU/mL的患者占比分别为32.5%(51/157)、40.1%(63/157)、45.2%(71/157),差异无统计学意义(χ2=5.412,P=0.067)。TDF治疗第1、2、3年,HBsAg<1500 IU/mL的患者占比分别为43.9%(69/157)、50.3%(79/157)、59.2%(93/157),差异有统计学意义(χ2=7.410,P=0.025)。
TDF治疗1、2、3年,HBeAg阴性患者HBsAg<100 IU/mL、<1000 IU/mL、<1500 IU/mL的患者比例均高于HBeAg阳性患者,差异有统计学意义(P值均<0.05)(表5)。

表5 各时间点HBeAg阳性和HBeAg阴性不同区段HBsAg的患者分布
3 讨论
根据目前关于TDF的临床研究报道,其可强效持续抑制病毒复制,具有高耐药屏障。本研究通过对西安交通大学第二附属医院157例使用TDF抗病毒治疗的CHB患者进行真实世界的回顾性分析,发现整体上患者的血清HBV DNA定量和HBsAg水平在TDF治疗中呈逐渐下降趋势,与既往研究[3-4]结果一致。但在HBeAg阳性患者中,TDF治疗3年有2.7%的患者尚未实现HBV DNA阴转,HBV DNA处于低水平复制状态。既往有针对恩替卡韦(ETV)和TDF的真实世界研究[5]认为无论HBeAg状态如何,ETV和TDF治疗的初治CHB患者完全病毒学应答率通常在90%以上。随着检测技术的创新和发展,HBV DNA检测下限逐渐被突破,既往认为“HBV DNA阴性”的部分患者被证实有低水平的HBV复制,这部分低病毒血症(low-level viremia,LLV)状态患者检出率逐渐提高。LLV定义为抗病毒治疗48周后可持续或间歇检测到低水平的HBV DNA,即>检测下限但<2000 IU/mL[6],国内认为检测下限为10 IU/mL或者20 IU/mL[7],美国肝病学会制定的检测下限为10 IU/mL[8]。有学者[9]认为LLV可能和NUC不能完全阻断DNA链的合成有关。此外,随着用药时间的延长,近年来已有文献[10]报道TDF耐药的现象,持续的病毒血症可能与HBV耐药相关突变、基线HBeAg阳性状态、初始高病毒定量等因素有关[11]。LLV状态的CHB患者继续原方案治疗短期内有病毒学突破和耐药风险,长期存在肝病进展风险[6]。对于这部分患者的管理,有专家建议治疗过程中尽可能的提高患者依从性,定期行高灵敏度HBV DNA检测,积极调整抗病毒治疗方案,以获得更高的完全病毒学应答率及更好的长期预后[7]。针对此类患者需排查是否存在不规范用药,并考虑病毒基因型检测、耐药相关突变基因检测以及更换抗病毒方案或者联合抗病毒治疗。
进一步分析显示,HBeAg阳性患者相较HBeAg阴性患者年龄更轻,这与此前研究结果类似[12],但不排除与研究样本量较小有关,拟在后续研究中继续扩大样本量进一步分析。HBeAg阳性患者基线及各个治疗时间点上HBV DNA定量和HBsAg水平显著高于HBeAg阴性患者,这可能与慢性HBV感染的自然史有关[13]。在慢性HBV感染中,HBeAg阳性慢性感染期属于早期阶段,机体对病毒处于免疫耐受状态(免疫耐受期),表现为高HBV DNA定量和高HBsAg水平。随着病毒不断复制,宿主对病毒的免疫耐受状态打破,免疫系统识别并攻击HBV,进入免疫清除期,HBsAg和HBV DNA水平逐渐下降,病程逐渐由HBeAg阳性阶段转换为HBeAg阴性阶段,进入免疫控制期及HBeAg阴性肝炎期[14]。
本团队此前研究[4]发现,CHB患者使用ETV抗病毒治疗,血清HBsAg水平的下降呈现出“快速下降期”和“缓慢下降期”两个阶段,本研究中仅在HBeAg阳性患者中有类似发现。TDF治疗中,HBeAg阳性患者第1年HBsAg水平下降明显快于第2年和第3年,可见HBeAg阳性患者HBsAg水平的下降呈现先快后慢;而在HBeAg阴性患者中HBsAg水平虽然整体上呈现逐渐下降,但前后下降速度无明显变化。表明TDF和ETV在降低HBsAg方面并不一致,其机制有待进一步探讨。治疗全程HBeAg阳性患者HBsAg水平下降速度显著快于HBeAg阴性患者,与Zoutendijk等[15]的研究结果相似。HBsAg的分泌机制或许可以解释NUC治疗过程中HBsAg下降呈现出的“先快后慢”的现象:血清HBsAg不仅来自具有转录活性cccDNA的信使RNA,而且还来源于整合的HBV DNA序列[16]。这些HBsAg或与病毒核衣壳结合以含有HBV DNA的病毒粒子包膜的形式分泌到血液循环中,或以无病毒核衣壳的空HBsAg亚病毒粒子的形式直接分泌到血液循环中。当血清HBsAg水平很高时,相当大比例的HBsAg可能来自含HBV DNA的病毒粒子[17],在NUC治疗期间,强效快速的抑制病毒复制将导致含有HBV DNA的病毒粒子急剧减少,继而引起HBsAg快速减少,因此表现为TDF治疗第一年,HBsAg水平下降速度最快。随着时间的推移及病毒定量的降低,血清中HBsAg相对更多是来自cccDNA或整合的HBV DNA序列,以及空HBsAg颗粒的分泌,但这些途径受NUC治疗的影响很小[18]。这可以解释本研究在随后几年的TDF治疗中,HBsAg下降速度明显放缓。
然而,作为逆转录酶抑制剂,即使ETV、TDF或富马酸丙酚替诺福韦酯(TAF)等一线NUC,均不能直接抑制cccDNA的转录活性,很难获得HBsAg的清除[19],本研究中使用TDF治疗3年,仅有1例(1.2%)患者实现HBsAg清除。这就意味着为实现HBsAg清除而有必要另辟他径,即与其他机制药物联合使用,如免疫制剂、干扰素等。近年来,慢性乙型肝炎临床治愈(功能性治愈)专家共识[20]和指南[1]中,肯定了聚乙二醇干扰素α(PEG-IFNα)在降低HBsAg和实现HBsAg清除方面的良好疗效,并将HBsAg<1500 IU/mL作为PEG-IFNα治疗的优势人群,对于获得低HBsAg水平和低HBV DNA定量的NUC经治患者,序贯或联合PEG-IFNα可显著增加HBsAg阴转率和血清学转换率。TDF治疗3年,HBsAg<1500 IU/mL的HBeAg阳性和HBeAg阴性患者比例高达47.9%和69.0%,这为PEG-IFNα的使用带来更多的潜在优势患者,从而进一步实现临床治愈[21-23]。
总之,TDF作为一线抗HBV药物,治疗期间HBV DNA定量和HBsAg水平均不断下降,其疗效值得肯定。CHB患者使用TDF治疗3年,近一半患者可以达到HBsAg<1500 IU/mL从而成为未来临床治愈的优势人群。对于长期使用TDF但仍未获得HBV DNA阴转的患者需密切观察。
伦理学声明:本研究方案于2020年5月18日经由西安交通大学第二附属医院伦理委员会审批,批号:2020-922。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:鲁瑞、李梅负责课题设计,资料分析,撰写论文;刘晨瑞、刘怡欣、吴凤萍、鲁瑞、王怡恺参与收集数据,修改论文;党双锁、李梅负责拟定写作思路,指导撰写文章并最后定稿。
