青藤碱对有机锡损伤肝HL02细胞的保护作用及其机制
2022-10-14段治宇王效蕊梁婷婷李青山梁泰刚
段治宇,王效蕊,梁婷婷,李青山,3,梁泰刚
(1.山西医科大学药学院,山西 晋中 030600;2.山西省中医院,山西 太原 030012;3.山西中医药大学,山西 晋中 030619)
近几十年来,有机锡化合物在工农业生产中被广泛应用,如船体防污漆及木材防腐剂等。在使用过程中,该类化合物会不可避免地向环境中排放[1]。然而,大多数有机锡化合物具有高生物毒性,这些化合物可通过小肠或皮肤等途径进入人体。特别是三取代体最易被吸收,并主要分布在肝、肾和脑部[2]。其中,作为三丁基氯化锡在人体内的主要的降解产物,二氯二丁基锡对人体产生的危害同样引起人们的重视。
肝脏作为人体的主要代谢部位,在分子解毒的过程中可能会生成过量的有毒活性氧。这会对肝细胞造成氧化损伤,严重时会损害这一关键器官的功能[3]。而抗氧化剂的使用可保护肝脏免受自由基介导的损伤。有研究发现,一些具有抗氧化作用的天然活性产物对肝损伤的治疗具有显著效果[4 - 5]。
青藤碱(sinomenine,SIN)是从防己科植物青藤的干燥藤茎中提取的生物碱,具有抗炎、抗肿瘤等多种药理作用[6]。此外,SIN具有抗氧化作用[7]。本课题组前期研究证实了SIN可以保护H2O2导致的肝HL02细胞损伤。
本研究通过建立二氯二丁基锡诱导的HL02细胞损伤模型观察SIN对细胞的保护作用及对凋亡相关信号通路的影响,旨在进一步阐明SIN发挥保护作用的机制,为深入探讨其潜在药用价值研究提供实验依据。
1 材料和方法
1.1 仪器光学倒置显微镜(OPTECBDS200-PH,重庆Optec Instrument公司);酶标仪(Thermo Scientific);台式低速离心机(TD5A-WS,长沙湘仪有限公司);高速冷冻离心机(TGL-16gR,上海安亭科学仪器厂);荧光倒置显微镜(IX-51,Olympus);流式细胞仪(BD-C6,USA);实时定量PCR仪(Step One,Applied Biosystems)。
1.2 细胞株HL02细胞株来自中国科学院细胞库。
1.3 主要试剂二氯二丁基锡(货号205494)购自美国Sigma公司;青藤碱(纯度>97%,货号S302249)购自上海aladdin公司;吖啶橙(AO,货号0360-50G)、溴化乙锭(EB,货号0492-5G)均购自美国Amerisco公司;活性氧(ROS)检测试剂盒(货号C1300-1-2)购自北京ApplyGEN公司;双染凋亡检测试剂盒(货号KGA106)购自江苏keyGEN BioTECH公司;RNA提取试剂盒(货号9753Q)购自北京Takara Bio公司;兔抗cleaved caspase-3(货号9664)、caspase-9抗体(货号9502)均购自美国Cell Signaling公司。RPMI 1640培养基(货号31870082)、胎牛血清(FBS,货号10100147)、青链霉素双抗混合液(货号15070063)购自美国Invitrogen Life公司;引物合成自生工生物工程有限公司。
1.4 细胞培养将HL02细胞接种于无菌培养瓶中,加入含10% FBS的RPMI 1640培养液,将其置于37 ℃,5% CO2培养箱中培养。
1.5 方法
1.5.1 MTT法测定细胞活力
1.5.1.1 SIN毒性实验 取对数生长期的HL02细胞,均匀添加进96孔板内,孵育过夜后,分别加入2、4、8、16、32、64、128、256、512 μmol·L-1SIN,24 h后加入10 μL 5 g·L-1MTT。培养4 h后弃去上清液,添加100 μL DMSO,使用酶标仪(570 nm)测量吸光度(OD)值。计算细胞生存率。
1.5.1.2 DBT毒性实验 将HL02细胞孵育过夜后分别加入0.25、1、4、16、32 μmol·L-1DBT孵育24 h。按相同方法计算细胞生存率。
1.5.1.3 SIN保护活性实验 HL02细胞经SIN(4、8、16 μmol·L-1)培养24 h后加入3 μmol·L-1DBT孵育6 h,测定OD值。计算细胞生存率。
1.5.2形态学观察 HL02细胞经过DBT以及SIN处理后,使用倒置显微镜(×40)观察,拍照。
1.5.3AO/EB染色法 HL02细胞经过DBT以及SIN处理后,添加1 g·L-1AO和EB溶液,暗处孵育15 min,用冷的PBS洗涤3次,荧光显微镜下观察后拍照。
1.5.4Annexin V-FITC/PI双染法 使用DBT及不同浓度的SIN处理HL02细胞,收集细胞,避光染色。检测细胞凋亡率。
1.5.5ROS含量测定 HL02细胞经DBT及不同浓度的SIN处理后,加入到10 μmol·L-1DCFH-DA溶液中,37 ℃孵育半小时,反复清洗3次后检测荧光强度。结果用实验组与对照组的平均荧光强度表示。
1.5.6线粒体膜电位检测 将JC-1、超纯水和染色缓冲液按1 ∶160 ∶40比例配置工作液。取1 mL工作液加入处理后的HL02细胞样品中,37 ℃孵育20 min,PBS清洗重悬,检测荧光强度。
1.5.7实时荧光定量PCR 处理后的HL02细胞提取总RNA,并使用酶标仪测量RNA浓度和纯度。之后,按照反转录试剂盒的程序获得到cDNA。基因的相对含量表示为2-ΔΔCt。引物序列如Tab 1所示,内参基因是GAPDH。
1.5.8蛋白印记 收集处理后的HL02细胞,加入裂解液,12 000 r·min-1离心20 min,取上清液,定量,等量等体积蛋白加到上样孔中进行电泳分离。随后用5%脱脂牛奶封闭1.5 h,一抗在4℃孵育12 h后,二抗室温培养1 h,显影,曝光。
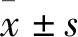

Tab 1 Primer sequence
2 结果
2.1 SIN对DBT诱导HL02细胞毒性的保护效果结果如Fig 1所示,HL02细胞在不同浓度的SIN(2~512 μmol·L-1)中培养12 h后,浓度低于128 μmol·L-1的SIN未对HL02细胞的增殖显示抑制效果。经过DBT单独处理,细胞活力呈浓度依赖性降低,IC50值为2.96 μmol·L-1。相比对照组,DBT处理组的细胞存活率明显下降,而使用SIN预处理可以显著提升细胞存活率,差异有统计学意义(P<0.01)。形态学观察结果显示,DBT处理组HL02细胞变小呈圆珠状,而不同浓度SIN预处理后形态改变的细胞逐渐减少。
2.2 SIN对DBT诱导HL02细胞凋亡的影响结果如Fig 2所示,HL02细胞经DBT处理后核染色质为桔红色并呈固缩状,而不同浓度SIN的预处理后,上述现象逐渐减少。模型组中细胞凋亡率为(25.37±0.87)%,而不同浓度SIN预处理后,细胞凋亡率分别降为对照组(22.30±0.50)%、(18.30±1.04)%、(13.07±1.82)%,与单独使用DBT处理相比较,SIN组凋亡率明显下降,差异有统计学意义(P<0.05)。
2.3 SIN对DBT诱导HL02细胞内ROS含量及MMP的影响实验结果显示(Fig 3),模型组中细胞内ROS为对照组的(1.99±0.07)倍,而经过不同浓度SIN预处理后,细胞内ROS含量降低至对照组的(1.75±0.04)、(1.46±0.04)、(1.25±0.04)倍。同时,单独使用DBT处理降低MMP至对照组的(0.41±0.04)倍。而经不同浓度的SIN预处理后加入DBT,电位差明显发生改变,分别增长为对照组的(0.54±0.03)、(0.71±0.05)、(0.83±0.04)倍。
2.4 SIN对凋亡相关基因表达的影响采用qRT-PCR技术检测Bad、Bax、Bcl-2、Bcl-xL、cytochome c、

Fig 1 The protective effect of SIN on DBT-induced cytotoxicity of HL02 A:Toxicity of SIN on HL02 cells;B:Toxicity of DBT on HL02 cells;C:The protective effect of SIN on the decline of HL02 cell viability induced by DBT;D:Cell morphology observation results.#P<0.05,##P<0.01 vs control;**P<0.01 vs model.
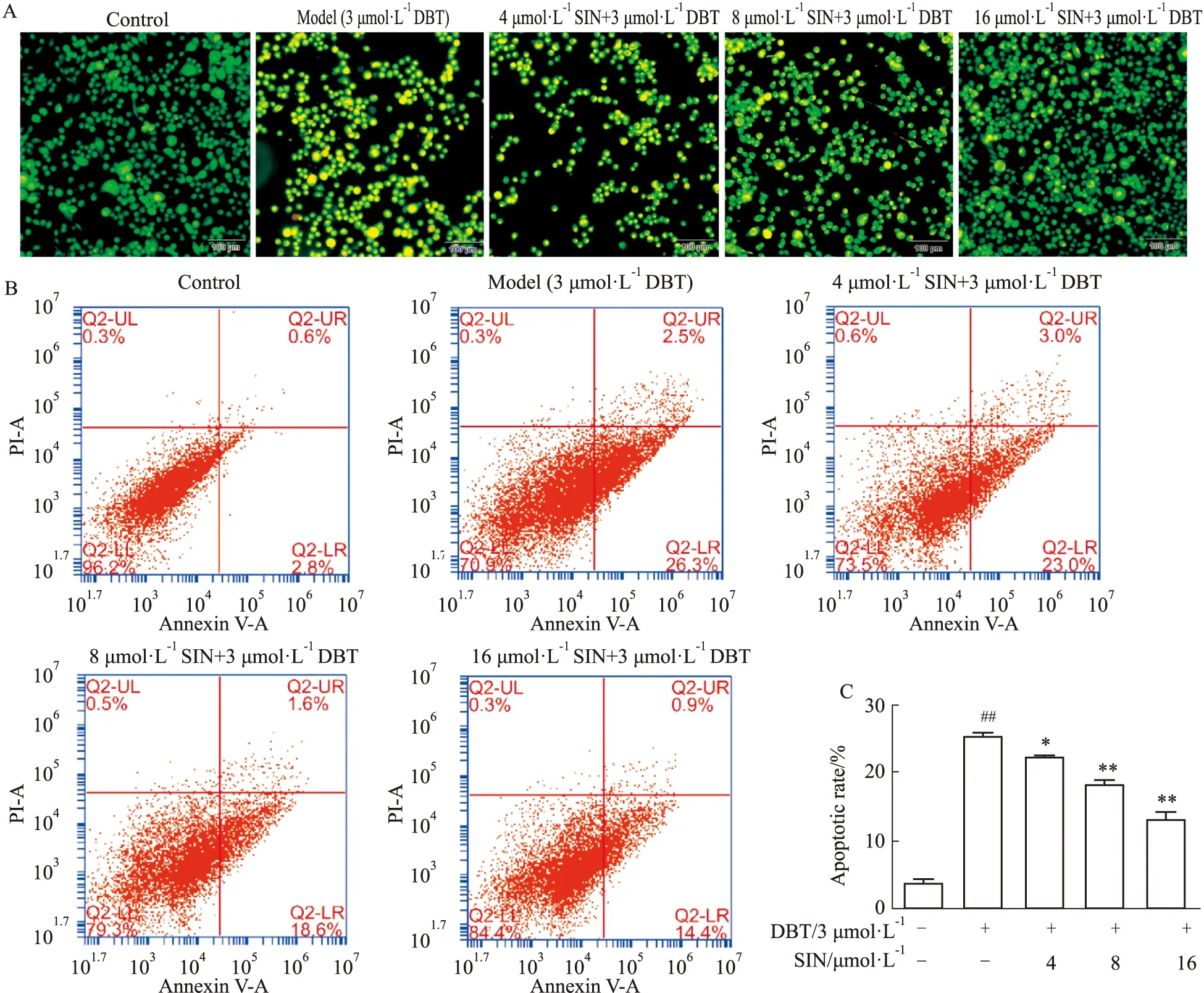
Fig 2 SIN reduced increase of DBT-induced HL02 cell A:The characteristics of cell apoptosis observed by AO/EB fluorescence staining;B:Cell apoptosis rate detected by Annexin V-FITC/PI double staining;C:The corresponding quantitative data of B.##P<0.01 vs control;*P<0.05,**P<0.01 vs model.
Apaf-1、caspase-9和caspase-3 的mRNA表达水平。结果显示(Fig 4),DBT能明显增加Bad、Bax、cytochome-c、Apaf-1、caspase-9和caspase-3的mRNA水平、降低Bcl-xL和Bcl-2的mRNA水平。而不同浓度SIN的预处理能明显逆转上述结果,差异有统计学意义(P<0.01)。
2.5 SIN对凋亡相关蛋白的影响结果如Fig 5所示,经过DBT单独处理,HL02细胞中的Bcl-2/Bax比例明显降低。相比之下,SIN的预处理后二者比例随SIN浓度的提高而升高(P<0.01)。同时,caspase-9与cleaved-caspase-3的表达也降低,差异有统计学意义(P<0.05)。
3 讨论
自三取代有机锡化合物因高毒性被禁止使用以来,二取代有机锡化合物逐渐发展。其中,二氯二丁基锡的应用十分广泛。本课题组对有机锡类化合物的药理和毒理研究过程中发现:二氯二丁基锡对肝细胞表现出明显的毒性。该毒性可能源于自由基引起的氧化损伤。在对DBT诱导肝细胞毒性的治疗过程中,我们检测了多种中药活性成分,从中筛选发现青藤碱具有一定的保护活性。近期有研究表明,青藤碱可以通过抑制氧化应激,凋亡和炎症发挥肝保护作用[8]。
氧化应激是肝细胞损伤重要的机制之一[9]。过量的ROS可与生物大分子发生反应,使之失活,最终导致细胞损伤。有研究表明,三苯基锡(TPT)可以诱导HepG2肝细胞产生过量ROS,诱导DNA损伤(DNA断裂),产生细胞毒性[10]。然而,据文献报道青藤碱具有抗氧化应激活性。例如:近期Fang等[8]报道,青藤碱可以通过抑制氧化应激,凋亡和炎症等机制,对乙醇诱导的小鼠肝损伤发挥保护作用;Fan等[11]报道,青藤碱可通过激活PC12细胞的内源性抗氧化机制减轻H2O2导致的细胞毒性。因此,我们推测青藤碱可能通过激活肝HL02细胞内源性抗氧化机制,清除细胞内产生的过量ROS,从而保护线粒体,降低肝细胞凋亡率。本实验结果也证实了DBT诱导的HL02细胞内ROS的过量产生能够经过SIN的预处理得到减轻。
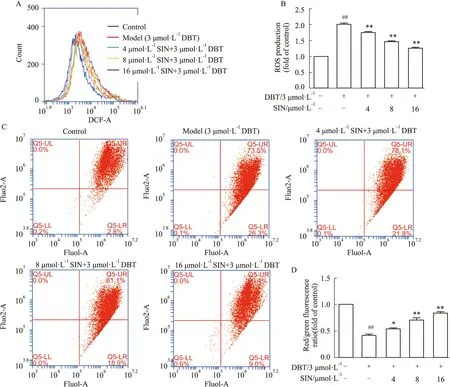
Fig 3 SIN reduced DBT-induced ROS production and MMP depolarization in HL02 (A,C)The result of intracellular ROS and MMP measured by flow cytometry.(B,D)The corresponding quantitative data of(A,C).##P<0.01 vs control;*P<0.05,**P<0.01 vs model.
在凋亡发生的初期,细胞内过量ROS可以降低抗凋亡蛋白表达、上调促凋亡的蛋白表达。这引起MMP下降与线粒体膜通透性增强[12]。进而导致细胞质中cytochrome-c蛋白增多。其可以和Apaf-1聚合为凋亡体[13]。凋亡体可以激活caspase-9形成cleaved-caspase-9。cleaved-caspase-9进一步诱导下游的caspase-3活化形成cleaved-caspase-3并最终可导致细胞程序性死亡。有研究表明,一些mRNA的表达水平能够反映相应蛋白质的表达水平[14]。本实验结果表明,DBT处理组中Bcl-2和 Bcl-xL的mRNA表达降低,而Bax、Bad、cytochrome c、Apaf-1、caspase-9和caspase-3的mRNA表达升高。经过不同浓度SIN的预处理,上述结果发生逆转。Western blot结果也证实SIN能够显著提升Bcl-2与Bax的比值、降低caspase-9与cleaved-caspase-3的表达。
综上所述,本研究结果表明,SIN能够有效降低DBT诱导的HL02细胞损伤,其机制与抑制ROS介导的线粒体凋亡有关。
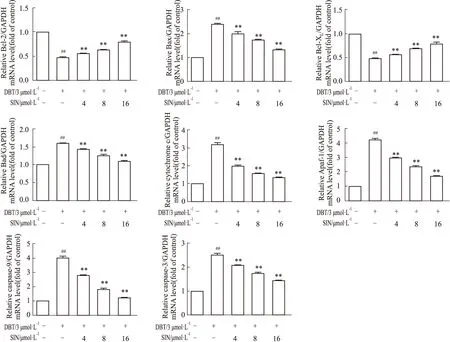
Fig 4 The mRNA expression of apoptosis-related ##P<0.01 vs control;**P<0.01 vs model.
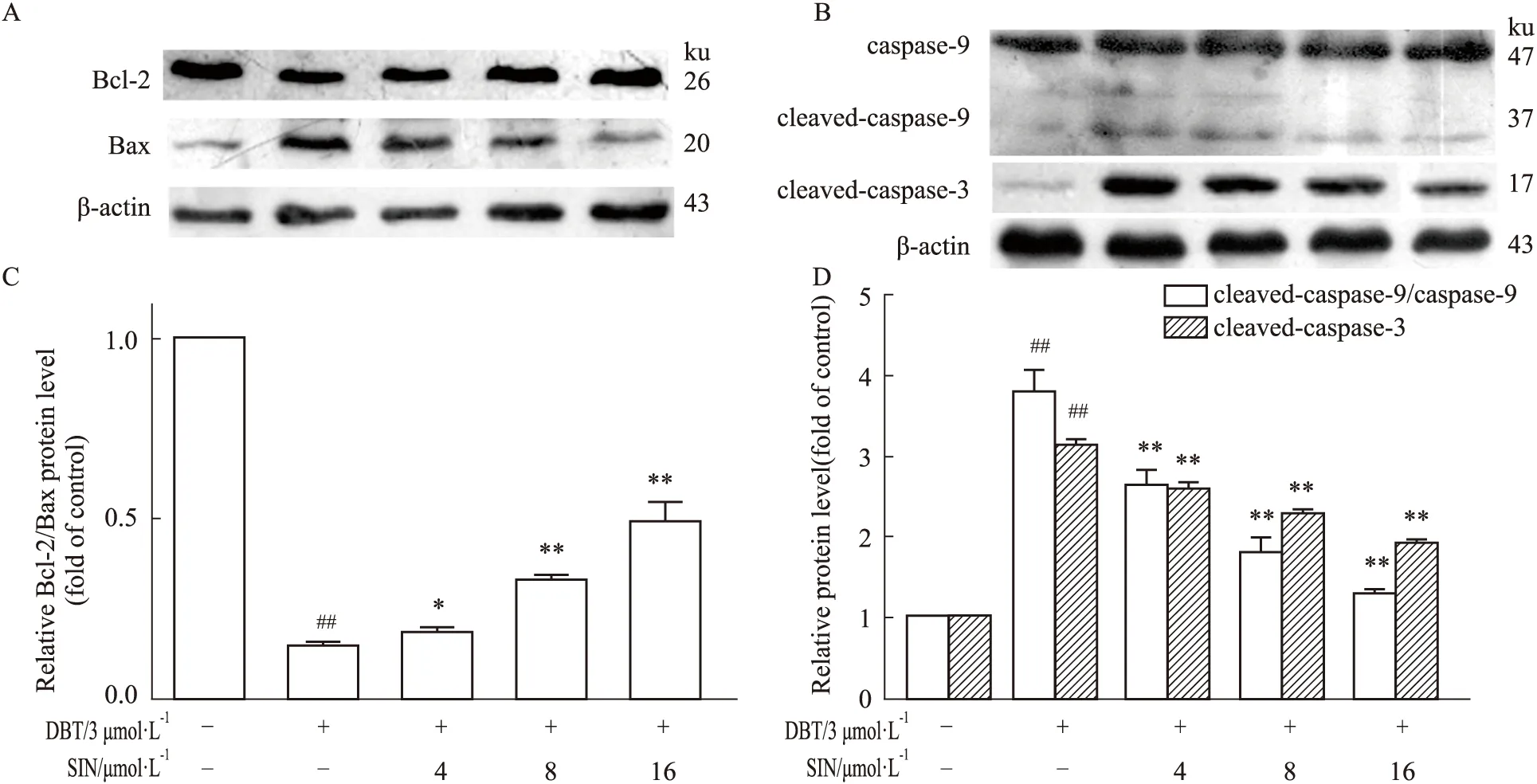
Fig 5 Expression of apoptosis-related (A,B)The expression of Bcl-2,Bax,caspase-9 and cleaved-caspase-3 proteins.(C,D)The corresponding quantitative data of(A,B).##P<0.01 vs control;*P<0.05,**P<0.01 vs model.
