山柰酚对脑缺血/再灌注损伤的体内外保护作用机制研究Δ
2022-10-10徐芳琴郭超王婧雯空军军医大学第一附属医院药剂科西安710032
徐芳琴,郭超,王婧雯(空军军医大学第一附属医院药剂科,西安 710032)
脑缺血/再灌注(cerebral ischemia/reperfusion,CI/R)损伤是指大脑缺血缺氧一定时间后,恢复血液供应时造成的严重脑机能障碍[1]。目前,CI/R损伤引起的严重脑损伤和功能障碍是临床治疗中一个具有挑战性的问题,其发病机制可能与炎症反应、氧化应激等生物过程有关,且尚未开发出可用于治疗CI/R损伤的安全可靠的靶向药物。山柰酚(kaempferol,KAE)主要来源于姜科植物山柰的根茎,属于黄酮类化合物,亦广泛存在于茶叶、蔬菜及水果中。药理研究表明,KAE具有抗炎[2]、抗氧化[3]、抗癌[4-6]、改善脂质代谢[7]、保护大脑[8]等作用。然而,KAE治疗CI/R损伤的蛋白靶标与生物过程仍不明确。网络药理学研究和分子对接可以同时研究多种化学物质和作用靶点,从而为中药提供可能的研究途径[9-10]。基于此,本研究首先利用网络药理学研究筛选KAE治疗CI/R损伤的作用靶点,分析其治疗CI/R损伤的可能作用机制,然后利用分子对接技术明确KAE与核心靶点的结合位点,最后利用体内外实验验证KAE发挥脑保护作用的可能机制,为KAE治疗CI/R损伤提供实验研究基础。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Multiskan Sky型酶标仪、371型CO2培养箱(美国Thermo Fisher Scientific公司),YQX-Ⅱ型厌氧培养箱(上海跃进医疗器械有限公司),CKX53型生物显微镜(日本Olympus公司),BSC-1100ⅡA2-X型生物安全柜(山东博科生物产业有限公司),TD4型台式离心机(湖南湘仪实验室仪器开发有限公司),BSA124S型分析天平[赛多利斯科学仪器(北京)有限公司],QL-901型涡旋仪(海门市其林贝尔仪器制造有限公司),Mini-TBC型转移槽、Mini-TBC型转移芯(北京凯元信瑞仪器有限公司),Mini chemi 500型凝胶成像系统(北京赛智创业科技有限公司)等。
1.2 主要药品与试剂
本研究所用主要药品与试剂包括KAE对照品(上海源叶生物科技有限公司,高效液相色谱法测得其含量≥98%),BCA蛋白定量试剂盒、RIPA裂解液(陕西中晖赫彩生物医药科技有限公司,批号分别为PQ003、BBO222),蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(p-Akt)、Src、磷酸化 Src(p-Src)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(武汉赛维尔生物科技有限公司,批号分别为 180947、175108、LS194236、AC2102017D、GB11002),磷酸盐缓冲液(PBS)、DMEM高糖培养基(美国Corning公司),DMEM无糖培养基(大连美仑生物技术有限公司),聚偏二氟乙烯(PVDF)膜(美国Merck Millipore公司,批号IPVH00010),HRP标记的山羊抗兔IgG抗体(美国Abbkine公司),ECL化学发光超敏显色试剂盒(上海翊圣生物科技有限公司,批号32106)等。
1.3 细胞和动物
小鼠海马神经元HT22细胞系由空军军医大学西京医院新药研发中心培养和保存。实验用动物为清洁级雄性SD大鼠,共18只,体质量200~220 g,购自空军军医大学实验动物中心,动物生产许可证号为SCXK(陕)-2019-001。大鼠在动物房内适应性喂养1周后进行后续实验。
2 方法
2.1 KAE-靶点-CI/R网络构建
2.1.1 KAE靶点的预测 从TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)获得KAE分子结构和结构式的“canonical smiles”格式信息;从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得KAE分子结构和结构式的“sdf”格式信息。选择物种为“Homo sapiens”,通过SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)预测靶点;利用UniProtKB数据库(https://www.uniprot.org/)使靶点名称标准化,并删除重复数据。
2.1.2 CI/R靶点的收集 在GeneCards数据库(https://www.genecards.org/)和 NCBI数据库(https://www.ncbi.nlm.nih.gov/gene/)中检索,关键词为“cerebral ischemia/reperfusion”;在 Drugbank数据库(https://go.drugbank.com/)中检索,关键词为“cerebral ischemic stroke”。收集3个数据库的CI/R靶点检索结果,删除重复数据。
2.1.3 共同靶点网络构建 将KAE、CI/R的靶点输入Venny在线绘图工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html),筛选KAE与CI/R的共同靶点,并利用Cytoscape 3.7.1软件(http://www.cytoscape.org)构建共同靶点网络。
2.2 核心靶点网络构建
2.2.1 蛋白质-蛋白质相互作用网络构建 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络可阐明预测目标与其他蛋白质之间的关系。STRING数据库(https://string-db.org/)可提供蛋白质间相互作用的信息,通过STRING数据库构建CI/R与KAE共同靶点的PPI网络,利用Cytoscape 3.7.1软件实现PPI网络的可视化展示。
2.2.2 核心靶点预测 对PPI网络进行拓扑学分析,利用Cytoscape 3.7.1软件中的CytoHubba插件筛选出结构亲和力排名前10位的核心靶点。节点颜色越趋近红色表示其连接的靶点越多,在CI/R损伤发生、发展中的作用越重要。
2.3 分子对接
分子对接是研究药物分子作用机制的一种方法。从RSCB PDB数据库(https://www.rcsb.org/)下载蛋白质结构,并使用PyMOL软件去除每个蛋白质结构的结晶水和其他小分子,然后将其保存为“PDB”格式。将结构文件导入AutoDock Vina软件中的Autodock Tool 1.5.6程序,在化合物结构上添加原子电荷及氢,保存为“pdbq”格式。将化合物KAE的“mol2”格式文件导入Autodock Tool 1.5.6程序,在化合物结构上添加原子电荷,保存为“pdbqt”格式,作为对接配体。采用AutoDock Vina软件模拟分子对接,确定核心靶点与KAE的结合亲和力。以KAE与核心靶点的对接结合能来评价结合亲和力,若分子对接的结合能<-7 kcal/mol(1 kcal=4.186 kJ),说明具有亲和力,且结合能的数值越低,说明结合亲和力越低,结合越稳定[11]。
2.4 细胞体外实验验证
2.4.1 细胞培养 将HT22细胞接种于含10%胎牛血清、1%青链霉素双抗的DMEM高糖培养基(即完全培养基)中,置于37℃、5% CO2培养箱中培养。每2天更换1次培养基,待细胞融合度为90%左右时,用0.25%胰酶消化并进行传代培养。本研究选用第7代细胞进行后续研究。
2.4.2 氧糖剥夺/再灌注细胞损伤模型的制备、分组与给药 实验分为对照组、氧糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)组和KAE低、中、高剂量组。对照组细胞用完全培养基常规培养24 h。OGD/R组细胞用DMEM无糖培养基在37℃恒温、厌氧培养箱(95%N2、5% CO2)中培养3 h,再用完全培养基代替DMEM无糖培养基常规培养24 h,构建OGD/R细胞损伤模型。KAE低、中、高剂量组细胞先参照OGD/R组厌氧培养3 h后,再分别加入含8、16、32 μmol/L KAE的DMEM无糖培养基常规培养24 h。KAE给药剂量参考文献[12]和课题组前期预实验结果设置。
2.4.3 细胞活力检测 采用CCK-8法进行检测。将HT22细胞以5×104个/孔接种于96孔板中,待细胞贴壁后,按“2.4.2”项下分组处理(每组设置3个复孔),同时设置不含细胞和药物的空白对照组。培养结束后,更换为含CCK-8的培养基,在37℃、5%CO2培养箱中孵育4 h。使用酶标仪在450 nm波长处检测各孔的光密度(OD),并计算细胞存活率:细胞存活率(%)=(实验组OD-空白对照组OD)/(对照组OD-空白对照组OD)×100%。实验重复3次。
2.4.4 HT22 细胞中 Akt、p-Akt、Src、p-Src蛋白表达检测 采用Western blot法检测Akt、p-Akt、Src、p-Src蛋白的表达,验证KAE对HT22细胞中上述蛋白的调控作用。将HT22细胞以2×106个/孔接种于25 cm2细胞瓶中,待细胞贴壁后,按“2.4.2”项下分组处理,用含1%蛋白酶抑制剂的4℃预冷的RIPA裂解液裂解细胞,细胞裂解液在12 000×g、4℃下离心10 min,收集上清液,保存待用。以BCA法测定总蛋白浓度,将蛋白高温变性后,取等量蛋白质(20 μg)上样电泳,并转移至PVDF膜上。用5%脱脂牛奶于室温下封闭2 h,并在4℃下与Akt、p-Akt、Src、p-Src、GAPDH一抗(稀释度均为1∶1 000)孵育过夜,再将膜与HRP标记的山羊抗兔IgG二抗(稀释度为1∶5 000)在37℃下孵育2 h。用ECL化学发光超敏显色试剂盒进行显影,采用凝胶成像系统Lane 1D软件对条带进行扫描以分析条带灰度值,以Akt、p-Akt、Src、p-Src与内参蛋白(GAPDH)条带灰色值的比值表示蛋白的表达水平,以磷酸化蛋白与对应未磷酸化蛋白的灰度值比值反映该蛋白的磷酸化水平,并以对照组为参照。实验重复3次。
2.5 动物体内实验验证
2.5.1 大鼠大脑中动脉阻塞模型的制备、分组与给药 采用随机数字表法将18只大鼠随机分为假手术组(Sham组)、大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)组、KAE组(剂量20 mg/kg),每组6只。除Sham组不造模外,其余2组均造模。采用线栓法建立大鼠MCAO模型:首先大鼠腹腔注射4%戊巴比妥钠麻醉,仰卧固定,常规消毒,于颈部正中纵切口,分离出右侧颈总动脉、颈外动脉、颈内动脉,结扎颈外动脉,动脉夹暂时夹毕颈总动脉和颈内动脉;在颈外动脉结扎处远心端剪一斜口,经此斜口插入顶端赖氨酸包被的线栓(直径0.18 mm),经颈内动脉进入大脑前动脉的起始部位,遇轻微阻力即停止;栓塞2 h后,拔出线栓,再灌注24 h,构建MCAO模型以模拟急性脑梗死[13]。Sham组仅钝性分离大鼠颈部正中切口。于再灌注同时,Sham组及MCAO组腹腔注射生理盐水,KAE组腹腔注射20 mg/kg KAE。KAE给药剂量参考文献[14]和课题组前期预实验结果设置。
2.5.2 大鼠神经功能评价 参照改良的Longa评分法对大鼠神经功能进行评分,按照0~4分进行评价。0分:无明显神经功能缺损;1分:提尾时,对侧前肢不能前伸;2分:向缺血对侧转圈;3分:不能承受对侧自身重量;4分:意识障碍或无自主运动。评分越高,表明大鼠行为障碍越严重[14]。
2.5.3 大鼠脑组织病理观察 采用TTC染色法进行观察。给药后,各组大鼠腹腔注射4%戊巴比妥钠麻醉猝死后立即摘除全脑,用预冷的1×PBS洗净,滤纸吸干,分为2份。其中一份脑组织置于-20℃冰箱速冻30 min,取出后在冰上切成5片(厚度2 mm)。将切片置于2%TTC染液中,用锡箔纸盖住后,置于37℃恒温箱中放置30 min,翻动脑组织切片,使其均匀接触到染液。取出切片用PBS洗涤3~5 min,立即拍照,采用Image J 1.8.0软件计算每一片脑组织的梗死区面积,分层计算面积,每一层的梗死面积之和称为梗死体积。TTC染色为红色表示正常组织,白色表示梗死区。
2.5.4 大鼠脑组织中Akt、p-Akt、Src、p-Src蛋白表达检测 采用Western blot法进行检测。将“2.5.3”项下另一份大鼠脑组织用预冷的1×PBS洗净后剪碎,称取20 mg,用含1%蛋白酶抑制剂的4℃预冷的RIPA裂解液裂解,组织裂解液在12 000×g、4℃下离心10 min,收集上清液,保存待用。其余步骤同“2.4.4”项。
2.6 统计学方法
使用SPSS 20.0软件进行统计分析。计量资料以±s表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 KAE-靶点-CI/R网络构建结果
通过SwissTargetPrediction数据库预测得到KAE靶点,并使用UniProtKB数据库使靶点名称标准化后,共获得148个KAE靶点。从GeneCards、NCBI和Drugbank 3个数据库中分别筛选出1 065、73和78个CI/R靶点,删除重复靶点,共收集到1 124个CI/R靶点。利用Venny在线绘图工具,将148个KAE靶点和1 124个CI/R靶点进行比对,最后得到61个共同靶点(图1A)。利用Cytoscape 3.7.1软件获得基于KAE-靶点-CI/R之间相互作用的由63个节点和122条边线组成的复杂网络(图1B)。
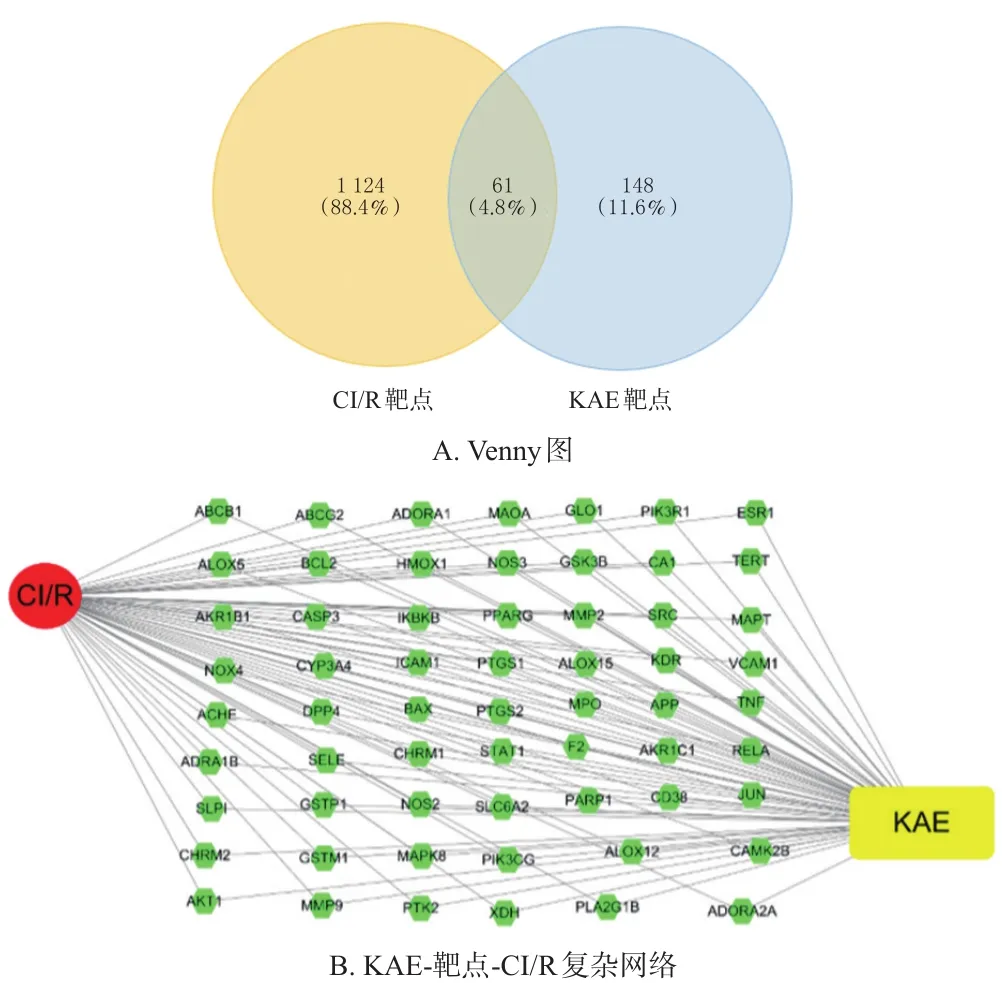
图1 共同靶点的Venny图和KAE-靶点-CI/R复杂网络
3.2 核心靶点网络构建结果
使用STRING数据库构建61个共同靶点的PPI网络。以综合得分>0.4和“Homo sapines”作为选择标准,获得由141个节点和1 152条边线组成的PPI网络(图2A)。通过CytoHubba插件获得PPI网络中排名前10位的核心靶点,依次为前列腺素内过氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、基质金属蛋白酶9(matrix metalloproteinase,MMP9)、JUN、Akt1、肿瘤坏死因子(tumor necrosis factor,TNF)、胱天蛋白酶3(caspase-3,CASP3)、丝裂原激活蛋白激酶8(mitogenactivated protein kinase 8,MAPK8)、细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM1)、血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM1)、Src(图2B)。

图2 共同靶点和核心靶点的PPI网络
3.3 分子对接实验结果
为进一步筛选KAE治疗CI/R的关键靶点,将KAE分别与排名前10位的核心靶点——PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src进行分子对接。结果表明,KAE与上述10个核心靶点的结合位点依次为5、4、4、2、3、5、4、5、5、4个(表1),主要包括丙氨酸(alanine,ALA)、丝氨酸(serine,SER)、酪氨酸(tyrosine,TYR)、甲硫氨酸(methionine,MET)、赖氨酸(lysine,LYS)等。分子对接后的配体-蛋白质相互作用分析结果显示,每个小分子与目标蛋白的结合主要依赖于氢键。其中,KAE与核心靶点Akt、Src的结合能均不高于-9.0 kcal/mol,说明结合较稳定,提示KAE可能通过作用于Akt、Src发挥治疗作用。因此,本研究以Akt、Src为靶点进行后续实验验证。
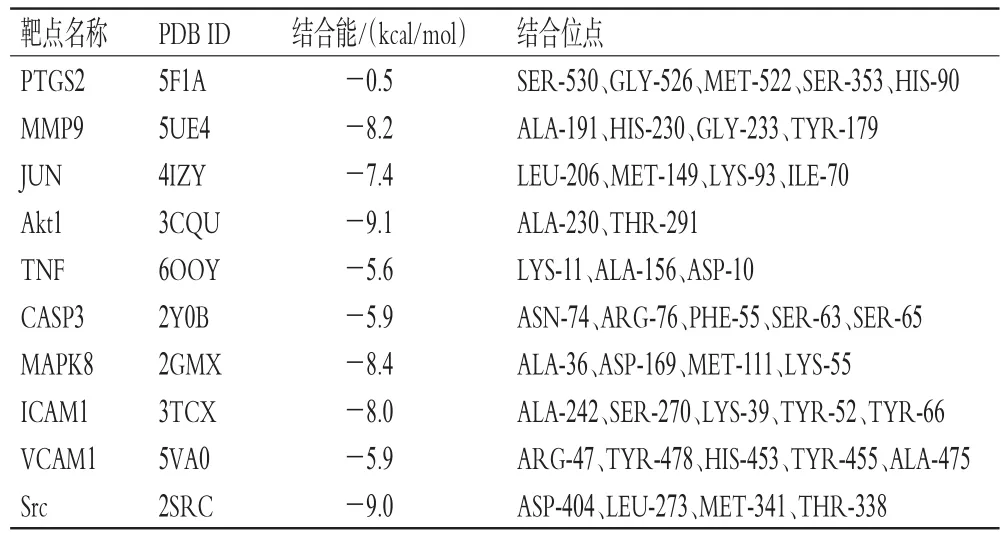
表1 KAE和排名前10位核心靶点的分子对接结果
3.4 体外细胞实验验证结果
3.4.1 KAE对OGD/R致HT22细胞损伤的影响 细胞活力检测结果显示,与对照组比较,OGD/R组细胞存活率显著降低(P<0.05),提示OGD/R导致HT22细胞损伤;与OGD/R组比较,KAE低、中、高剂量组细胞存活率均显著升高(P<0.05),提示KAE可明显促进HT22细胞存活,并呈剂量依赖趋势。结果见图3。

图3 KAE对HT22细胞存活率的影响
3.4.2 KAE对OGD/R损伤HT22细胞中Akt、Src蛋白磷酸化的影响 Western blot法检测结果显示,与对照组比较,OGD/R组细胞中Akt、Src蛋白的磷酸化水平均显著降低(P<0.05);与OGD/R组比较,KAE中、高剂量组细胞中Akt蛋白的磷酸化水平和KAE高剂量组细胞中Src蛋白的磷酸化水平均显著升高(P<0.05),且呈剂量依赖趋势。结果见图4。
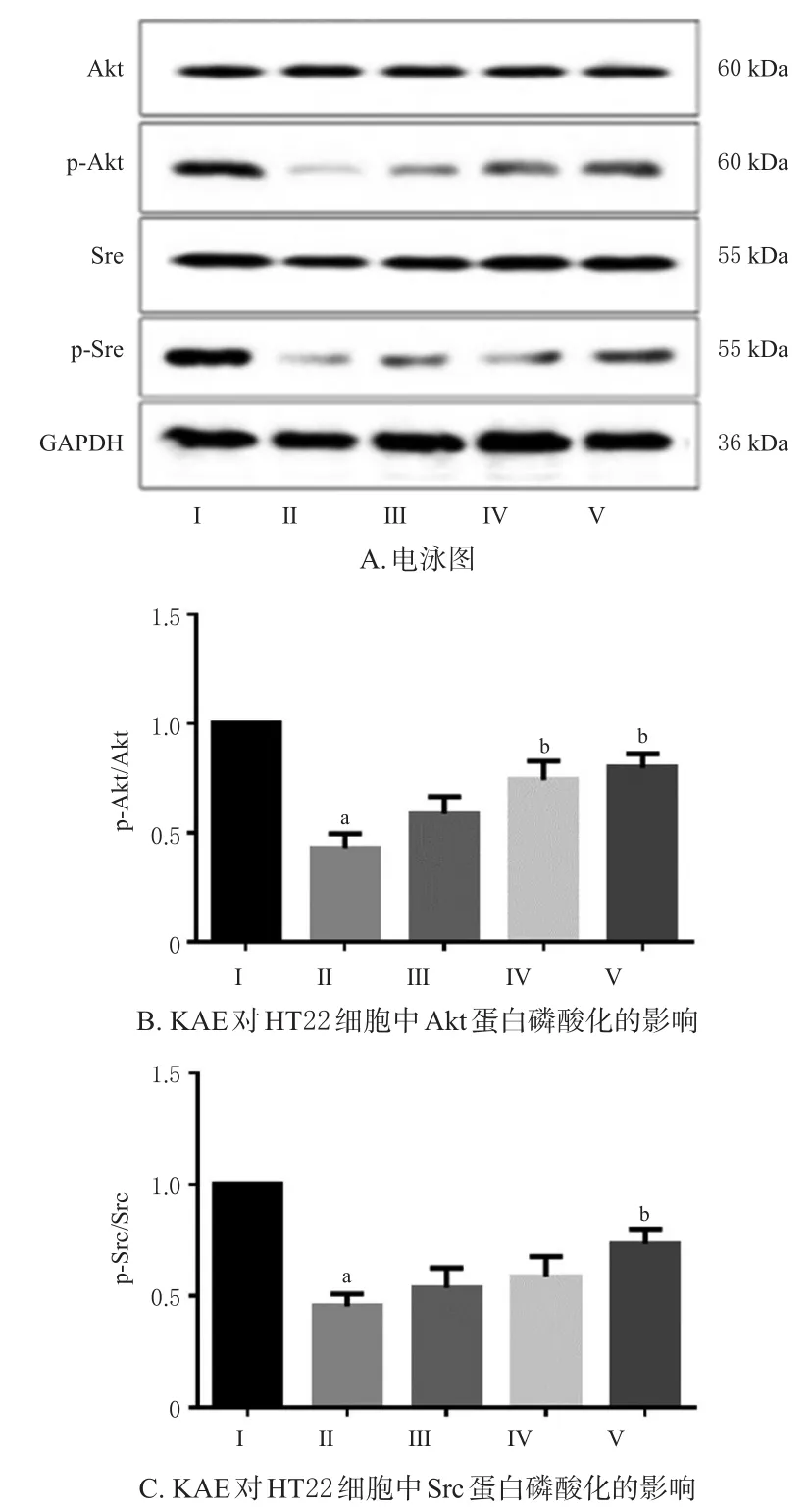
图4 KAE对HT22细胞中Akt、Src蛋白磷酸化的影响
3.5 大鼠体内实验验证结果
3.5.1 KAE对MCAO模型大鼠神经功能的影响 神经功能评分结果显示,与Sham组比较,MCAO组大鼠神经功能评分显著升高(P<0.05);与MCAO组比较,KAE组大鼠神经功能评分显著降低(P<0.05),提示KAE能够减轻MCAO造成的脑损伤。结果见图5。
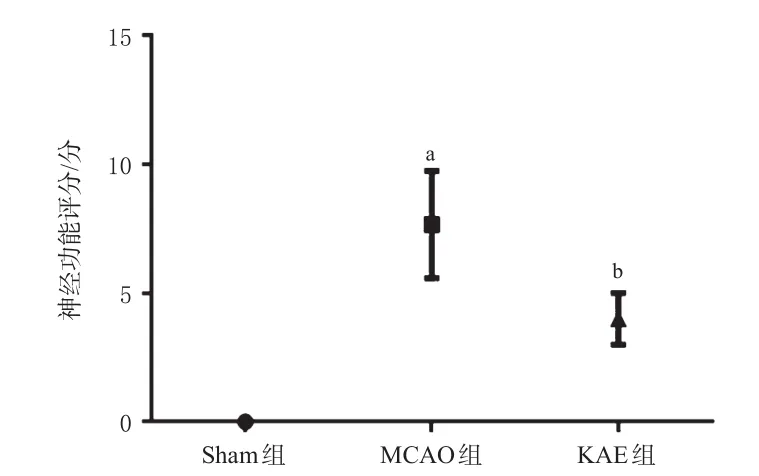
图5 各组大鼠的神经功能评分
3.5.2 KAE对MCAO模型大鼠脑组织病理学的影响 TTC染色结果显示,与Sham组比较,MCAO组大鼠脑梗死体积显著增加(P<0.05);与MCAO组比较,KAE组大鼠脑梗死体积显著降低(P<0.05)。结果见图6。

图6 各组大鼠脑组织的TTC染色图
3.5.3 KAE对MCAO模型大鼠脑组织中Akt、Src蛋白磷酸化的影响 Western blot法检测结果显示,与Sham组比较,MCAO组大鼠脑组织中Akt、Src蛋白磷酸化水平均显著降低(P<0.05);与MCAO组比较,KAE组大鼠脑组织中Akt、Src蛋白磷酸化水平均显著升高(P<0.05)。结果见图7。
4 讨论
CI/R损伤是一种复杂的级联性病理生理过程,其发生机制尚未完全明确。CI/R引起的脑损伤涉及多种生物过程,如炎症反应、氧化应激、线粒体功能调节和血管内皮功能调节等[15-17]。本研究为阐明KAE治疗脑卒中的作用机制,通过网络药理学研究和分子对接筛选出了KAE的主要作用靶点,随后用细胞和动物实验验证了筛选的结果。
本网络药理学研究结果显示,KAE可能作用于PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src 10个核心靶点,从而发挥其治疗CI/R损伤的作用。分子对接结果表明,KAE与10个核心靶点的结合亲和力均较低,提示KAE与靶点结合稳定。KAE 与PTGS2、MMP9、JUN、Akt1、TNF、CASP3、MAPK8、ICAM1、VCAM1、Src 10个核心靶点的结合位点分别有5、4、4、2、3、5、4、5、5、4个,主要包括ALA、SER、TYR、MET、LYS等,提示KAE可通过与核心靶点多位点结合发挥作用,这与中医的“多靶点、多通路”治疗疾病理论相呼应。其中,KAE与核心靶点Akt、Src的结合能均不高于-9.0 kcal/mol,提示KAE可能通过作用于Akt、Src发挥治疗作用。
以往网络药理学研究结果显示,在血管内皮功能调节方面,KAE通过作用于Akt1、MMP9、Src、MAPK8等靶点,调控血管内皮生长因子、松弛素等信号通路进而调节血管内皮功能。Src是一种非受体蛋白酪氨酸激酶,在缺血脑组织中可调节细胞外信号调节激酶,继而发挥脑保护作用[18]。在脑缺血后再灌注初期,Src可通过调节闭锁连接蛋白1和血管生成素1的表达,影响血管通透性,从而介导脑损伤[19]。下调Src蛋白磷酸化水平,抑制Src家族激酶信号通路激活,可发挥CI/R保护作用[20]。本研究结果表明,OGD/R损伤HT22细胞及MCAO模型大鼠脑组织中Src蛋白的磷酸化水平均显著降低,表明CI/R损伤可能导致Src失活,引发脑组织损伤;给予KAE能够显著升高OGD/R损伤HT22细胞及MCAO模型大鼠脑组织中Src蛋白的磷酸化水平,提示Scr可能是发挥脑保护作用的重要靶点。
磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)-Akt是维持机体细胞正常生理活动的关键信号通路,广泛存在于脑组织中,其中Akt作为PI3K的下游蛋白,可调节细胞增殖、生长和存活[21]。激活PI3K-Akt通路后可通过减少氧化应激、抑制炎症细胞因子表达、减少细胞凋亡,从而改善CI/R造成的脑损伤。研究表明,激活PI3K-Akt通路可抑制OGD/R诱导的HT22细胞活性氧的产生,减轻氧化应激[22]。另外,激活PI3K-Akt-核因子E2相关因子2信号转导可减轻CI/R损伤诱导的神经炎症和氧化应激[23]。本研究结果表明,OGD/R损伤HT22细胞及MCAO模型大鼠脑组织中Akt蛋白的磷酸化水平均显著降低,表明CI/R损伤可能导致Akt失活,引发脑组织损伤;给予KAE能够显著升高OGD/R损伤HT22细胞及MCAO模型大鼠脑组织中Akt蛋白的磷酸化水平,提示Akt可能是KAE发挥脑保护作用的重要靶点。
综上所述,KAE可能通过调控Akt、Src蛋白的磷酸化水平来发挥脑保护作用,从而改善CI/R损伤。
