黄芩素通过抑制氧化应激与凋亡改善小鼠心肌重构的作用研究
2022-10-08宋丽,王跃,田飞,钱凯
宋 丽,王 跃,田 飞,钱 凯
宜春学院医学院(江西 宜春 336000)
心血管疾病是世界范围内的主要死亡原因之一,大多数病例是缺血性心脏病。当血液中的胆固醇开始在动脉壁上积聚时,就会发展为缺血性心脏病,使动脉变窄并最终阻塞血流[1]。在病理性的刺激下,心脏早期可出现病理性心肌肥厚,是具有代偿作用的保护机制;若未得到改善,加重心脏代偿出现心肌纤维化,进而出现心室重构等严重症状[2]。心室重构表现为心肌细胞肥大、细胞外胶原增生及心室腔形态的变化,并同时伴有心脏舒缩功能的影响[3]。研究发现免疫-炎症反应在心肌重构过程中具有重要作用,也是该领域的研究热点,阻断炎症反应能有效改善心肌重构[4]。
心肌组织中过量的自由基会导致能量失衡、线粒体功能紊乱、p53激活、脂质过氧化引起细胞膜损伤,最终导致心肌细胞死亡[5]。研究表明[6]阿霉素诱导的自由基触发线粒体细胞色素c释放,导致心肌细胞凋亡,从而减少心肌细胞数量,左室壁变薄,由于后负荷增加,对心脏的压力增加,左室的整体功能下降,导致心肌病的发展。此外,由于线粒体膜完整性丧失和p53活性增高,心脏中活性氧(ROS)的产生促进脂质过氧化和凋亡改变[7]。而机体的内源性防御机制如抗氧化剂抑制自由基产生,防止细胞内损伤,改善ROS的危害作用。因此,恢复内源性抗氧化剂可能是保护心脏氧化损伤的有效策略。
黄芩素(Baicalein,Bai)是来源于黄芩根的主要黄酮类化合物之一,有多种药理活性,如抗氧化、抗炎、抗癌、和抗过敏作用[8]。由于其抗氧化或抗炎活性,大多数研究集中于慢性退行性疾病中的保护作用。研究表明[9]Bai通过降低自发性高血压大鼠心肌细胞中12-脂氧合酶的表达和基质金属蛋白酶-9(Matrix metalloproteinase,MMP-9)及胞外信号介导激酶的活性,抑制左心室I型和III型前胶原mRNA和蛋白质的合成,减轻心肌纤维化,从而降低高血压大鼠的血压。在对培养的人神经母细胞瘤SH-SY5Y细胞系统的研究中,发现10 μmol/L Bai和黄芩苷可保护细胞免受H2O2诱导的损伤[10]。因此,本研究通过建立ISO导致小鼠心肌损伤模型,探讨Bai对心肌损害的保护作用及机制。
1 材料与方法
1.1化学品、试剂盒和抗体Bai(纯度≥98.0%、麦克林、B802463)、异丙肾上腺素(I129810、阿拉丁)、二甲亚砜(ST038、碧云天)、丙二醛(MDA、S0131S、碧云天)、乳酸脱氢酶(LDH、A020-2-2、南京建成研究所)、肌酸激酶同工酶(CK-MB、H197-1-1、南京建成研究所);谷胱甘肽过氧化酶(GSH-Px)检测试剂盒(S0052、碧云天)、H&E染色试剂盒(G1120、Solarbio)、Masson染色试剂盒(G1340、Solarbio);抗体P-AKT(AF5740)、AKT(AF1777)、SOD1(AF8028)、CAT(AF0084)、caspase-3 (AF0081)、caspase-9(AF1264)、核因子-κB(NF-κB)(p65)(AF0246)、I型胶原纤维(Collagen I)(AF2740)、BNP(AF6336)、辣根过氧化物酶(A0208)均购自碧云天公司;抗体Bax(2774)、B淋巴细胞瘤-2基因(Bcl-2)(3498)、alpha(2122)、肿瘤坏死因子(TNF-α)(3707)、白介素-6(IL-6)(12153)、p-Smad2(3108)、磷脂酰肌醇-3-激酶(PI3K)(4255)均购自Cell Signaling公司。
1.2实验方法雄性SPF级小鼠,10~12周龄(体质量35~40 g),宜春学院实验动物中心提供,饲养在医学院动物中心,控制环境条件,光照/黑暗周期为12/12 h。给小鼠自由喂食鼠粮和水。实验开始前,动物驯化7 d。实验方案符合宜春学院动物实验伦理委员会的要求,所有程序均严格按照动物使用和护理的伦理原则进行,伦理审查批准号(2022012)。试验设小鼠供试品ISO(5.0 mg/mL)进行造模,连续腹腔注射15 d,建立心肌肥厚模型(ISO)。小鼠随机分成4组:空白对照组(Con组)、阳性对照组(Con+Bai组)、模型组(ISO组)、模型给药Bai组(ISO+Bai组),造模过程中有2只老鼠死亡,死亡率不超过10%,可进行后续实验。在造模成功次日开始给药,Bai加入20%DMSO配成浓度15 mg/mL的液体,Con+Bai组、ISO+Bai组腹腔注射50 mg/kg,隔天给药,共14 d。
最后1次给药24 h后记录所有实验动物的体质量,通过眼球采集血样,解剖收集心脏组织,称重,液氮冷冻以停止代谢活动,并保存在-80℃,待进一步分析。计算心肌组织相对质量,评估Bai对ISO所致心肌组织质量变化的影响。
1.3检测指标
1.3.1 心脏质量比、超声心动图的检测 给药结束后,禁食不禁水12 h,收集心脏大体图,记录所有实验动物的体质量、心脏质量,计算心肌组织相对质量。采用小动物超声检测小鼠心功能水平。小鼠异氟烷麻醉后,脱毛膏将颈部至胸部皮毛脱掉后涂抹耦合剂后采用相应探头进行超声观察,并计算小鼠左心室内径(Left ventricular diameter,LVIDd)、左室间隔直径(left ventricular septal diameter,LVSd)、左心室后壁直径(Left ventricular posterior wall diameter,LVPWd)水平变化。
1.3.2 心脏损伤的血清标志物评估 通过眼球采集血样,4 000 r/min离心15 min,收集上清液,液氮冷冻以停止代谢活动,并保存在-80℃,待进一步分析。测定血清特异性损伤生物标志物,如乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、谷胱甘肽过氧化物酶(GSH)、丙二醛(MDA)。按照其试剂盒说明书的操作步骤进行,用酶标仪于450 nm或405 nm波长处测各孔吸光度(D)值。
1.3.3 组织病理学检查 心脏组织样本在10%中性缓冲福尔马林中室温固定48 h,增加乙醇浓度脱水,二甲苯清除,石蜡包埋,制备约5 μm厚的切片,进行HE染色(脱蜡至水,苏木素染4 min,洗去浮色,分化液15 min,水洗;置伊红5 min,水洗;梯度脱水,透明,树胶封片)和Masson染色(脱蜡至水,Weigert氏铁苏木素染5 min,水洗,1%盐酸乙醇分化数秒,水洗3 min返蓝;丽春红酸性品红液染5 min,蒸馏水漂洗;磷钼酸水溶液3 min后苯胺蓝液复染5 min,1%冰醋酸分化1 min;梯度脱水,透明,树胶封片)。光镜下(Zeiss显微镜、Axioplan 2 Imaging、Axiovision软件)评估切片的结构变化。
1.3.4 蛋白提取和蛋白印迹分析 制备心脏组织的蛋白组分,并进行Western blot分析,将心脏组织样本使用匀浆器在冰冷的磷酸盐缓冲盐水(50 mM,pH 7.4)中均质,获得10%的心脏组织匀浆。匀浆在4℃,12 000 r/min离心30 min,得到清晰的上清液,用BCA试剂盒测定蛋白浓度。按照蛋白上样缓冲液比例制备上样液,Loading buffer变性后进行电泳,每泳道上样蛋白20 μg,SDS-PAGE电泳后,电转膜至PVDF膜,5%脱脂奶粉封闭,TBST洗涤3次,10 min/次,加入一抗NF-κB(p65)、Bax、Bcl-2、caspase-3、SOD1、PI3K、P-AKT、p-Smad2等蛋白(稀释比例1∶1 000),4℃封闭过夜,TBST洗涤3次,10 min/次,加入HRP标记的羊抗兔二抗,1 h后,TBST洗涤3次,10min/次,按试剂盒说明书混合发光液A和B,与膜作用3 min后,使用ECL Western印迹试剂进行定量。

2 结果
2.1 Bai对ISO所致小鼠心脏损伤的影响与Con组比较,ISO组心脏质量、体积、收缩期与舒张期LVPWd与IVSd明显增加、心肌损伤标志物CK-MB、LDH水平均升高、MDA含量增加(P<0.05);与ISO组比较,ISO+Bai组心脏质量、体积、收缩期与舒张期LVPWd与IVSd有所下降、心肌损伤标志物CK-MB、LDH活性下降、MDA含量降低(P<0.05)。HE染色显示,Con组和Bai单独处理的小鼠形态正常,心肌细胞排列整齐,细胞间隙正常,未见水肿。与Con组比较,ISO组小鼠心肌细胞多灶性变性和坏死,表现为心肌纤维丢失,伴有广泛的胞浆空泡化和肌纤维变性;ISO+Bai组心肌损伤较轻,心脏形态几乎完整,无空泡化和退行性改变,见图1,表1。

注:A:小鼠心脏大体图;B:超声心动图;C:HE染色的变化(×100)。图1 Bai对心肌损伤的影响变化

表1 4组小鼠CK-MB、LDH、MDA和HW/BW水平以及小鼠的血液动力学参数的比较
2.2 Bai对心肌纤维化的影响Masson染色显示Con组和Con+Bai处理组心肌细胞间质和血管外未出现胶原纤维化,与Con组比较,ISO组、ISO+Bai组细胞间质和血管外周纤维化(蓝色)显著增多;与ISO组比较,ISO+Bai组显示心肌纤维化明显增多(浅红色),见图2。Western blot检测显示,与Con组比较,ISO组、ISO+Bai组BNP、alpha、p-Smad2、Collage I蛋白表达上调;与ISO组比较,ISO+Bai组p-Smad2、Collagen I蛋白表达下调(P<0.05),显示Bai能够抑制ISO导致的心肌损伤,并降低心肌纤维化程度,见图3。

注:A:Western blot实验检测的蛋白表达;B:根据Western blot条带绘制的BNP蛋白相对表达量的柱状图;C:根据Western blot条带绘制的alpha蛋白相对表达量的柱状图;D:根据Western blot条带绘制的p-Smad2蛋白相对表达量的柱状图;E:根据Western blot条带绘制的Collagen I蛋白相对表达量的柱状图;与Con组比较,*:P<0.05,与ISO组比较,**:P<0.05。
2.3 Bai对心肌细胞凋亡的影响Western blotting结果显示,与Con组比较,ISO组、ISO+Bai组caspase-3、caspase-9、Bax蛋白表达上调,Bcl-2表达降低(P<0.05);与ISO组比较,ISO+Bai组caspase-3、caspase-9、Bax蛋白表达降低,Bcl-2表达上调(P<0.05),结果显示Bai可能通过抗凋亡作用,对心脏进行保护,见图4。
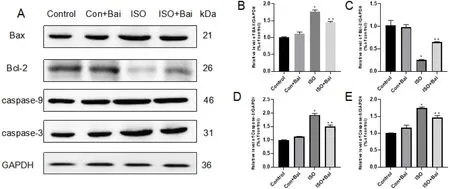
注:A:Western blot实验检测的蛋白表达;B:根据Western blot条带绘制的Bax蛋白相对表达量的柱状图;C:根据Western blot条带绘制的Bcl-2蛋白相对表达量的柱状图;D:根据Western blot条带绘制的caspase-3蛋白相对表达量的柱状图;E:根据Western blot条带绘制的caspase-9蛋白相对表达量的柱状图;与Con组比较,*:P<0.05,与ISO组比较,**:P<0.05。
2.4 Bai对心肌NF-κB及炎症因子的影响Western blotting结果显示,与Con组比较,ISO组、ISO+Bai组小鼠心肌中的NF-κB(p65)、TNF-α、IL-6蛋白表达上升(P<0.05);与ISO组比较,ISO+Bai组NF-κB(p65)、TNF-α、IL-6蛋白表达下降(P<0.05),结果显示Bai用药后可抑制ISO导致的心肌肥厚小鼠心肌组织中的炎症蛋白的表达,减轻心脏损伤,见图5。

注:A:Western blot实验检测的蛋白表达;B:根据Western blot条带绘制的IL-6蛋白相对表达量的柱状图;C:根据Western blot条带绘制的TNF-α蛋白相对表达量的柱状图;D:根据Western blot条带绘制的NF-κB蛋白相对表达量的柱状图;与Con组比较,*:P<0.05,与ISO组比较,**:P<0.05。
2.5 Bai对ISO所致小鼠心脏损伤抗氧化作用及PI3K/AKT1通路的影响根据GSH-Px试剂盒结果显示,与Con组比较,ISO组、ISO+Bai组活性下降;与ISO组比较,ISO+Bai组活性上升(P<0.05),见图6。Western blotting分析,与Con组比较,ISO组、ISO+Bai组SOD1、CAT、P-AKT1、PI3K蛋白表达下调(P<0.05);与ISO组比较,ISO+Bai组SOD1、CAT、P-AKT1、PI3K蛋白表达明显上调(P<0.05)。ISO能抑制AKT1向磷酸化转变,表明PI3K的激活能够使AKT1磷酸化,诱导细胞免疫应答,减少炎症因子的产生,从而保护心肌组织,见图7。
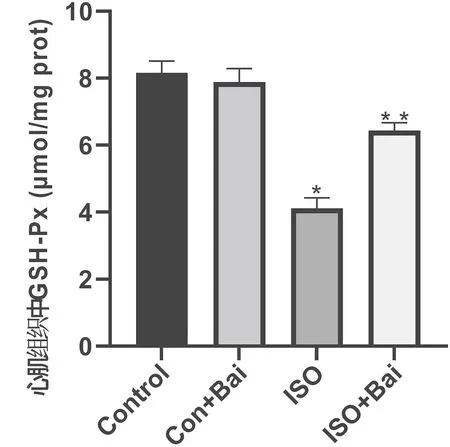
图6 各组小鼠心脏组织中GSH-Px活性水平的变化

注:A:Western blot实验检测的蛋白表达;B:根据Western blot条带绘制的CAT蛋白相对表达量的柱状图;C:根据Western blot条带绘制的SOD1蛋白相对表达量的柱状图;D:根据Western blot条带绘制的P-AKT1蛋白相对表达量的柱状图;E:根据Western blot条带绘制的PI3K蛋白相对表达量的柱状图;与Con组比较,*:P<0.05,与ISO组比较,**:P<0.05。
3 讨论
心肌重构是由一系列复杂的分子机制导致心肌结构功能和表型的变化,其发病机制复杂,目前认为是遗传和环境因素共同导致的多基因疾病[11]。在长期的病理应激下,心肌肥厚伴有间质纤维化、收缩功能障碍、基因表达模式改变、能量代谢改变和异常电生理特性,最终导致明显的失代偿性心力衰竭[12]。Bai具有清除氧自由基、抗炎、抗病毒、抗癌等作用,通过对细胞增殖、迁移、凋亡和自噬等生物学途径发挥作用。在缺氧、缺血、药物处理时,会引起氧自由基上升,导致心肌损伤,包括心肌坏死、心肌肥大等[13]。研究发现[14]黄芩的黄酮类化合物具有清除体内过量的氧自由基,防止体内产生过氧化脂质的作用。Bai可以控制小鼠模型中的铁超载,减轻铁超载引起的小鼠心脏损伤。Liu等[15]研究表明,Bai可以通过抑制血管平滑肌内皮细胞增殖和有丝分裂起到保护心血管的作用,Bai的这些保护心血管的作用预示着其具有成为治疗冠心病和高血压等心血管疾病的潜在药物。
在本实验中,通过建立体内ISO小鼠心肌模型中发现,Bai处理后,与ISO组比较,ISO+Bai组血清中CK-MB、LDH活性降低、MDA含量降低,心肌组织中GSH-Px活性水平升高(P<0.05);心脏超声波显示,与ISO组比较,ISO+Bai组收缩期与舒张期LVPWd与IVSd有所下降,说明Bai可抑制ISO诱导的心肌细胞氧化应激损伤。MDA是心肌细胞膜脂质过氧化的稳定产物,具有一定的生物毒性,其含量的多少直接反映心肌组织氧化损伤的程度[16]。在正常机体中,CAT、SOD1和GSH-Px在细胞内建立了强有力的抗氧化防御系统,其蛋白水平的多少反映机体清除氧自由基的能力。本实验中ISO+Bai组心肌组织中MDA含量降低,CAT、SOD1、GSH-Px水平升高(P<0.05),说明Bai可通过提高CAT、SOD1和GSH-Px的含量,以清除过量的氧化自由基,从而增强Bai的抗氧化作用,通过体内实验证实了Bai可预防心肌细胞受到氧化应激损伤。
ROS过量产生会导致心肌细胞凋亡和细胞死亡。研究表明[17]心肌细胞凋亡或坏死是异丙肾上腺素导致心功能损伤的重要机制。ISO诱导的ROS激活促凋亡的Bcl-2家族成员Bax,诱导心肌细胞线粒体通透性转变,导致细胞色素c、caspase-3的释放激活,最后凋亡。Bcl-2是一种抗凋亡的Bcl-2家族成员蛋白,阻止线粒体通透性的发生,最终在抑制凋亡中起着关键的保护作用。NF-κB被证明可以促进或抑制细胞凋亡,这取决于细胞类型和氧化刺激的性质[18]。在氧化剂或其他细胞外刺激下,IκB激酶的激活导致IκB磷酸化,IκB磷酸化导致其蛋白酶体降解,NF-κB复合物在核内的释放和转运。研究发现NF-κB通过激活促凋亡蛋白p53促进细胞凋亡。此外,通过基因缺失或化学抑制降低p53活性可减轻有毒制剂诱导的心肌细胞凋亡和心功能障碍[19]。在本研究中,Western blotting结果表明,ISO可诱导心肌细胞凋亡和坏死,Bai处理减弱了ISO诱导的致Bcl-2/Bax比值的增加(P<0.05),介导的下游基因caspase-3、caspase-9,NF-κB的蛋白水平显著降低(P<0.05)。因此,Bai可以改善ISO对小鼠ROS造成的损伤且具有一定的保护作用。
PI3K/Akt信号通路是心肌细胞内存在的自我保护机制,调节细胞的增殖、分化、凋亡等重要活动,通过调控转录因子可以抑制促凋亡基因(Bax、caspase-3、caspase-9)表达和促进抗凋亡基因(Bcl-2)表达,从而提高心肌细胞的存活率。在本研究中,Western blotting结果表明,ISO可诱导心肌细胞凋亡,Bai能抑制细胞凋亡,上调磷酸化Akt蛋白表达,逆转P-AKT的水平,研究结果显示,ISO诱导细胞凋亡的机制可能与PI3K/Akt的活化有关,Bai具有较强的抗氧化和抗凋亡机制,起到保护心脏的作用。
综上所述,Bai治疗可改善ISO所致的小鼠心肌重构。Bai对心肌非酶抗氧化剂和酶促抗氧化剂的恢复,以及上调ISO诱导心肌细胞损伤的抗氧化酶和激活PI3K/AKT调控的凋亡通路,这些与Bai的心脏保护作用相关,为临床应用提供基础。
