人类胎盘的葡萄糖转运机制及GDM 对胎盘葡萄糖转运的影响
2022-10-08何银东柳汝明
何银东,张 峻,黄 桦,柳汝明,王 茜
(昆明医科大学第一附属医院临床药学科,云南 昆明 650032)
葡萄糖是胎儿的主要能量来源,由于胎儿缺乏合成自身所需葡萄糖的能力,胎儿需要的所有葡萄糖均通过胎盘从母体获取,因此胎盘在葡萄糖转运至胎儿的过程中行驶非常重要的作用。葡萄糖从母体侧到胎儿侧的转移主要通过胎盘上的葡萄糖转运体(glucose transporters,GLUTs)完成。此外,胎盘自身对葡萄糖的代谢是调控葡萄糖从胎盘向胎儿转运的重要因素。
1 正常胎盘上的葡萄糖转运
1.1 正常胎盘上GLUTs 的分布及其对葡萄糖转运的影响
胎盘上葡萄糖的转运,首先由母体面的合胞体滋养层细胞,将母体侧的葡萄糖转运至胎盘中,合胞体滋养层细胞可分为面向母体的微绒毛膜(microvillous membranes,MVM)及面向子体侧的基底膜(basal membrane,BM)。再由胎盘子体面的血管内皮细胞,将胎盘中的葡萄糖转移到子体侧。具体来说,葡萄糖可通过浓度扩散,或者分布在上述不同细胞中的各种葡萄糖转运体(glucose transporters,GLUTs)完成葡萄糖转运[1],见图1(据Placenta,引自Day P E,2013)。其中,GLUTs在胎盘上葡萄糖转运过程中行驶着非常重要的作用。
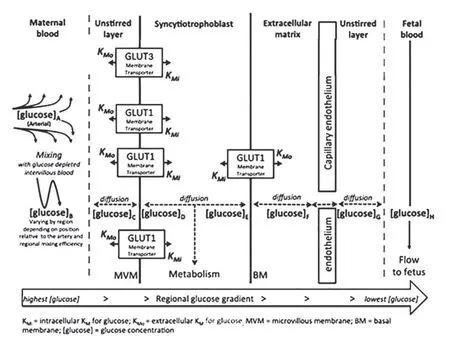
图1 胎盘上的葡萄糖转运简图[1]Fig.1 Transplacental glucose transport
人类胎盘共表达有GLUT1、3、4、8、9、10和12 七种亚型。目前的研究结果表明不同的GLUTs 在胎盘上的表达水平和分布位置不同,同时,一些GLUTs 的表达随着妊娠期的变化而改变,提示不同GLUTs 在胎盘葡萄糖转运过程中行使不同的功能。
GLUT1 在合胞体滋养层上的表达水平显著高于胎盘其他部位,是胎盘上主要负责葡萄糖转运的转运体,GLUT1 也表达在胎盘内皮细胞。随着妊娠的推移,GLUT1 在滋养层细胞MVM 上的表达逐渐增加,孕晚期达到最高水平[2-3]。GLUT 1在MVM 的表达量约是BM 的3~4 倍[4],折叠的MVM 展开后的膜面积是BM 的7~9 倍,这使得MVM 上的物质交换效率远高于BM。因此有假设提出,BM 上的葡萄糖转运是葡萄糖经合胞体滋养层转运的限速步骤[5]。Vardhana 等[6]发现,随着BeWo 细胞BM 上GLUTs 表达的减少,葡萄糖转运也减少。
GLUT3 主要表达于合胞体滋养层的MVM 以及胎盘血管内皮细胞。随着妊娠的推移,合胞体滋养层细胞上的GLUT3 的表达下降[7]。因此推测GLUT3 主要在孕早期发挥作用。GLUT3 与葡萄糖有非常高的亲和力,这保证了细胞在能量物质缺乏时能快速有效获得葡萄糖。在孕早期,子宫-胎盘血流系统不完全成熟,在低能量物质(如葡萄糖)的环境中,GLUT3 能促使大量葡萄糖快速从母体侧转运到胎儿侧,满足胎儿对葡萄糖的需求[8]。
GLUT4 表达在合胞体滋养层细胞的BM 上,MVM 上几乎不表达,且孕晚期胎盘上的合胞体滋养层BM 上GLUT4 的表达显著升高[9]。GLUT4 是胰岛素依赖型葡萄糖转运体。在孕早期,胰岛素刺激GLUT4 的表达及其介导的葡萄糖摄取。James-Allan[9]及Ericsson 等[10]发现,胰岛素能增加孕早期合胞体滋养层细胞上GLUT4 的表达和葡萄糖摄取。Hiden 等[11]研究发现孕早期胰岛素受体(insulin receptor,IR)主要表达在合胞体滋养层细胞的MVM。Desoye G 等[12]的研究结果中,免疫组化结果提示:孕早期,IR 主要表达在合胞体滋养层细胞的MVM,而在孕晚期,主要表达在胎盘上的内皮细胞。最近,James-Allan 等[9]发现在MVM 和BM 上都有IR 表达,但在MVM 上的表达是BM 上的10 倍,随着妊娠推进,MVM 和BM 上的IR 表达都增加。因此,有假设提出:胰岛素可能通过MVM 上的IR 调控BM 上GLUT4 的表达及其介导的葡萄糖转运。而且,在孕晚期,胰岛素也可能影响经胎盘的葡萄糖摄取。
GLUT8 表达于足月胎盘上的合胞体滋养层和内皮细胞中。但GLUT8 对经胎盘的葡萄糖转运的影响尚不清楚。
胎盘上的GLUT9 存在GLUT9α 及GLUT9β两种亚型,前者主要表达在合胞体滋养层的BM以及内皮细胞中,后者主要表达在合胞体滋养层的MVM 上[13]。
胎盘组织中发现GLUT10 存在,但其在胎盘上的位置和功能都不明确。
GLUT12 主要表达于孕早期合胞体滋养层细胞的胞质中。在足月胎盘中,主要表达于绒毛血管平滑肌和绒毛间质细胞。随着妊娠的推进,合胞体滋养层细胞上GLUT12 的表达降低[14]。在妊娠不同时期,GLUT12 的分布变化可能与胰岛素受体的变化有关,可能参与孕早期合胞体滋养层细胞上的胰岛素依赖的葡萄糖摄取。
1.2 胎盘上葡萄糖代谢对葡萄糖转运的影响
除了GLUTs 的分布和活性会影响胎盘上的葡萄糖转运外,胎盘上葡萄糖代谢、子宫-胎盘血流量也会影响胎盘上的葡萄糖转运。Trond 等[15]发现约30%被胎盘自身消耗。而且,胎盘的葡萄糖消耗与胎盘的葡萄糖摄取呈正相关,与胎儿的葡萄糖消耗负相关。这表明胎盘自身对葡萄糖的消耗也是调节葡萄糖母亲-胎儿转移的重要手段之一,但目前对此方面的研究仍然较少。
2 妊娠期糖尿 病(gestational diabetes milletus,GDM)患者胎盘上葡萄糖转运的改变
GDM 是指妊娠期间首次发生或发现的不同程度的葡萄糖耐受不良。全球发病率高达14.0%[16],我国GDM 发病率高达8.4%~18.9%,且呈逐年上升的趋势[17]。GDM 会对子体产生不良影响。短期内,新生儿则发生巨大儿、低血糖和高胆红素血症风险增加[18];且在后期发生肥胖及2 型糖尿病等慢性代谢疾病的风险增加[19]。
研究发现,与正常孕妇胎盘相比,GDM 患者的胎盘重量、直径、厚度等有所增加[20-21],胎盘上的纤维素样坏死、脉络膜血管病变、缺血性疾病和绒毛不成熟均增加[22]。因此GDM 患者的胎盘结构发生不同程度病变,可能会引起胎盘葡萄糖转运的异常等功能改变,从而可能增加胎儿发生不良结局的风险。
2.1 GDM 患者胎盘上GLUTs 的变化
GDM 患者常表现出高血糖和高胰岛素血症,早期体外实验探讨了血糖和胰岛素对胎盘合胞体滋养层细胞GLUT1 的表达水平的影响。例如,Hahn、Illsley 等[23-24]发现,当血糖值为0 mmol/L时,合胞体滋养层细胞上的GLUT1 的表达增加,葡萄糖摄取增加。而当血糖值为20~25 mmol/L时,GLUT1 的表达降低后,葡萄糖摄取减少。而当血糖浓度为1~12 mmol/L 时,GLUT1 的表达并未发生改变[24]。但该研究尚未探讨血糖对GLUT1活性的影响。Basak 等[25]发现胰岛素可促进孕早期BeWo 细胞株的GLUT1 mRNA 的表达和葡萄糖摄取。
一些研究报道了GDM 对胎盘上GLUT1 功能的影响,但结果不完全一致。Jansson 等[26]发现正常产妇与血糖控制良好GDM 患者的MVM 和BM 上GLUT1 的表达和葡萄糖摄取无显著差异。然而,Gaither[27]和Yao 等[28-30]的研究发现GDM患者合胞体滋养层上GLUT1 的表达增加,且与子代出生体重呈正相关。GLUT1 表达的增加可能是GDM 患者中葡萄糖转运过多和胎儿生长加速的原因之一。
Sciullo E 等[31]发现与健康产妇相比,GDM患者胎盘上GLUT3 的表达降低。但Kainulainen等[32]的免疫组化结果显示,GDM 患者胎盘上GLUT3的表达无显著变化。因此,目前关于GDM 患者胎盘上GLUT3 表达的影响尚无统一定论。
研究GDM 胎盘上GLUT4 表达的研究报道较少,结果也不尽一致。Stanirowski 等[2]发现,胰岛素治疗的GDM 胎盘滋养层细胞上的GLUT4 表达增加,但是Colomiere 等[28]发现GDM 胎盘上GLUT4 的表达水平降低,且胰岛素治疗会进一步降低GLUT4 的表达水平。GDM 胎盘上GLUT4 的表达水平的改变对葡萄糖转运的影响尚无报道。
Stanirowski 等[2]的研究发现,胰岛素治疗的GDM 胎盘上GLUT9 的表达水平显著高于正常胎盘。另外还有研究报道,GDM 患者胎盘BM 上的GLUT9α 表达水平明显高于正常胎盘。
暂无关于GDM 影响胎盘上GLUT8 及GLUT12的表达水平的报道。
由目前的研究结果可知,GDM 可能会通过影响胎盘上GLUTs 的表达,从而改变胎盘上的葡萄糖转运。但GDM 对不同GLUTs 的表达影响可能不完全相同,并且,饮食控制及胰岛素治疗的GDM 对GLUTs 的影响也有所差异。另一方面,大部分的研究结果均研究胎盘上GLUTs 的表达水平,针对其转运活性的影响研究较少。
2.2 GDM 患者胎盘上葡萄糖代谢的变化及其对葡萄糖转运的影响
一些研究讨论了GDM 患者胎盘上葡萄糖代谢的改变对胎盘上葡萄糖转运的影响。最近的一项研究发现,GDM 胎盘上的细胞滋养层细胞的糖原合成减少[33],但是Michelsen 等[15]的研究表明GDM 患者胎盘上的糖原合成与正常产妇无差别。
3 胎盘上调节葡萄糖转运的分子机制及GDM 患者胎盘上分子机制的改变
已有一些研究探讨了胎盘上AMP 激活的蛋白激酶(AMP kinase,AMPK)、哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR)信号通路和胰岛素/胰岛素样生长因子1(insulin-like growth factor 1,IGF1)信号通路对胎盘上葡萄糖转运影响。
AMPK 是人体重要的能量传感因子,当细胞内低能量状态时(AMP/ADP:ATP 的比例增加),AMPK 信号通路被激活,从而促进葡萄糖及脂肪酸等物质的产能代谢。AMPK 可以调节骨骼肌、肝脏等组织中GLUTs 转运功能。一些研究也报道了AMPK 信号通路调节胎盘上葡萄糖转运,以及GDM 患者胎盘上AMPK 活性的改变。Carey,E.A等[34]发现在胎盘滋养层细胞中,AMPK 敲除可抑制GLUT3 蛋白的表达及活性。肥胖的GDM 患者胎盘上的AMPK 的mRNA 表达水平下降[35-36]。Guo Yao 等[28]研究结果表明,GDM 胎盘上GLUT1表达增加,AMPK 及其下游ACC 的磷酸化水平降低,提示AMPK 信号通路被抑制。GDM 合并巨大儿患者胎盘上AMPK 及ACC 磷酸化水平与新生儿的体重呈负相关[37]。
mTOR 是丝氨酸/苏氨酸蛋白激酶,其与不同的蛋白成分组合形成mTOR 复合物1(mammalian target of rapamycin complex,mTORC1)和mTORC2,mTORC1 是胎盘上感应葡萄糖转运和代谢的重要靶点之一[38]。胎盘合胞体滋养层细胞上的mTOR信号通路受葡萄糖调节[39],葡萄糖可通过生成ATP 直接与mTOR 结合激活mTOR 信号通路[40]。mTOR 信号通路可能会影响胎盘上GLUTs 的表达水平。在JEG-3 滋养层细胞中抑制mTOR 的表达可降低GLUT3 的表达水平[41]。GDM 胎盘上mTOR信号通路被激活,mTORC1 的下游关键蛋白磷酸化水平显著上调,且磷酸化水平变化与子代出生体重呈正相关[42]。
胰岛素/ IGF1 是调节胎盘生长和胎儿发育的关键信号通路。IGF1 与IGFR1 受体或者IR 结合后,导致胰岛素受体底物(insulin receptor substrate,IRS)以及磷脂酰肌醇3 激酶(phosphatidylinositol-3 kinase,PI3K)的激活,激活的PI3K,最终激活下游的AKT 和mTOR 信号通路,增加糖原合成和储存。研究发现IGF1 可促进合胞体滋养层细胞上的葡萄糖摄取和GLUT1 的表达[43]。
4 小结
胎儿从母体有效摄取葡萄糖有赖于胎盘的正常结构和功能,胎盘主要通过多种GLUTs 将母体侧葡萄糖转运至子体侧,此外胎盘上葡萄糖代谢、子宫-胎盘血流量也会对葡萄糖转运产生影响。GDM 患者胎盘上的葡萄糖转运与正常孕妇胎盘上的葡萄糖转运存在差异。目前研究认为胎盘合胞体滋养层细胞上的GLUTs 是导致葡萄糖转移发生改变的原因之一,不同的GLUTs 表达及活性的改变,如何对GDM 患者胎盘上葡萄糖转运产生影响,有待进一步确认。此外GDM 胎盘细胞滋养层细胞的葡萄糖代谢活性改变也可能影响葡萄糖的转运。影响胎盘上葡萄糖转运的具体机制包括AMPK、mTOR 及胰岛素/IGF1 信号通路。但具体分子机制的改变对胎盘上葡萄糖转运以及对胎儿不良结局的影响,仍然有待进一步研究。
