肺腺癌患者PLA2G1B 表达情况与预后的相关性
2022-10-08朱中山杨洲江承川李小兵任斗黄橙张维薇李湘军赵顺利
朱中山,杨洲,江承川,李小兵,任斗,黄橙,张维薇,李湘军,赵顺利
(湖南省第二人民医院肿瘤科,湖南 长沙 410007)
非小细胞肺癌(non-small cell lung cancer,NSCLC)已连续多年位列全球癌症致死率榜首[1-2],而其中的肺腺癌亚型(lungadenocarcinoma,LUAD)也是非小细胞肺癌中占比最多的一类[3]。近些年,随着精准医疗的研究推进,尤其在肺腺癌领域鉴定出多个中国人群常见的驱动突变基因[4],其中以EGFR 以及ALK 为代表的驱动基因均已有相应的小分子抑制剂研发成功,并用于临床延缓肺腺癌患者的复发以及死亡。但是整体的肺癌患者的5 a 生存率仍然较低,因此寻找更多的针对不同患者的精准治疗的靶点仍然是一个非常迫切的临床需求。
癌症通常是由基因的突变或者功能异常而驱动的,寻找到不同患者的不同异常基因,降为后续的治疗手段选择提供非常有指导意义的参考。基于EGFR 驱动突变以及ALK 融合变异的靶向治疗,以及通过检测PDL1 表达[5-6]或者肿瘤突变负荷(Tumormutationburden)[7]而选择使用免疫治疗。这些精准诊疗精准用药的手段在临床上确实大大改善了患者的生存状态和生存率。
PLA2G1B(Phospholipase A2 group 1B)基因可以编码一种蛋白酶,其功能主要为调控细胞内的钙离子结合以及A2 亚型的磷脂酶活性[8]。并且既往研究已发现肝癌中该基因会发生显著的表达上调,并且该表达上调与肝癌患者的预后相关[9]。但是在肺癌中该基因的表达模式以及与患者的预后关系尚不清楚,本研究主要通过公共数据对PLA2G1B 基因全面的生物信息学分析,以解释PLA2G1B 基因在肺腺癌中的表达特征、预后指导意义,并寻找潜在的治疗靶点。
1 数据和方法
1.1 TCGA 以及GEO 中肺腺癌数据
本研究纳入TCGA 数据库(数据下载自https://xena.ucsc.edu/)中共计490例肺腺癌原发灶的RNAseq 表达量数据,其中表达量信息包含测序得到的原始序列计数(Readscount)以及定量之后的TPM(Transcriptpermillion)信息。该490例患者均具有完整的预后OS 数据用于生存分析。并且纳入来自GEO(Gene expression omnibus,https://www.ncbi.nlm.nih.gov/geo/)数据库的GSE11969[10]以及GSE72094[11]两个数据集,分别包含了90 以及398例肺腺癌患者的表达量数据以及临床信息。选用的数据集中患者平均年龄均大于60 岁,且分期偏早期,性别分布相同,数据对比见表1、表2。

表1 GSE11969、TCGA 的年龄、分期、性别分布情况Tab.1 GSE11969、TCGA age,stage,gender distribution
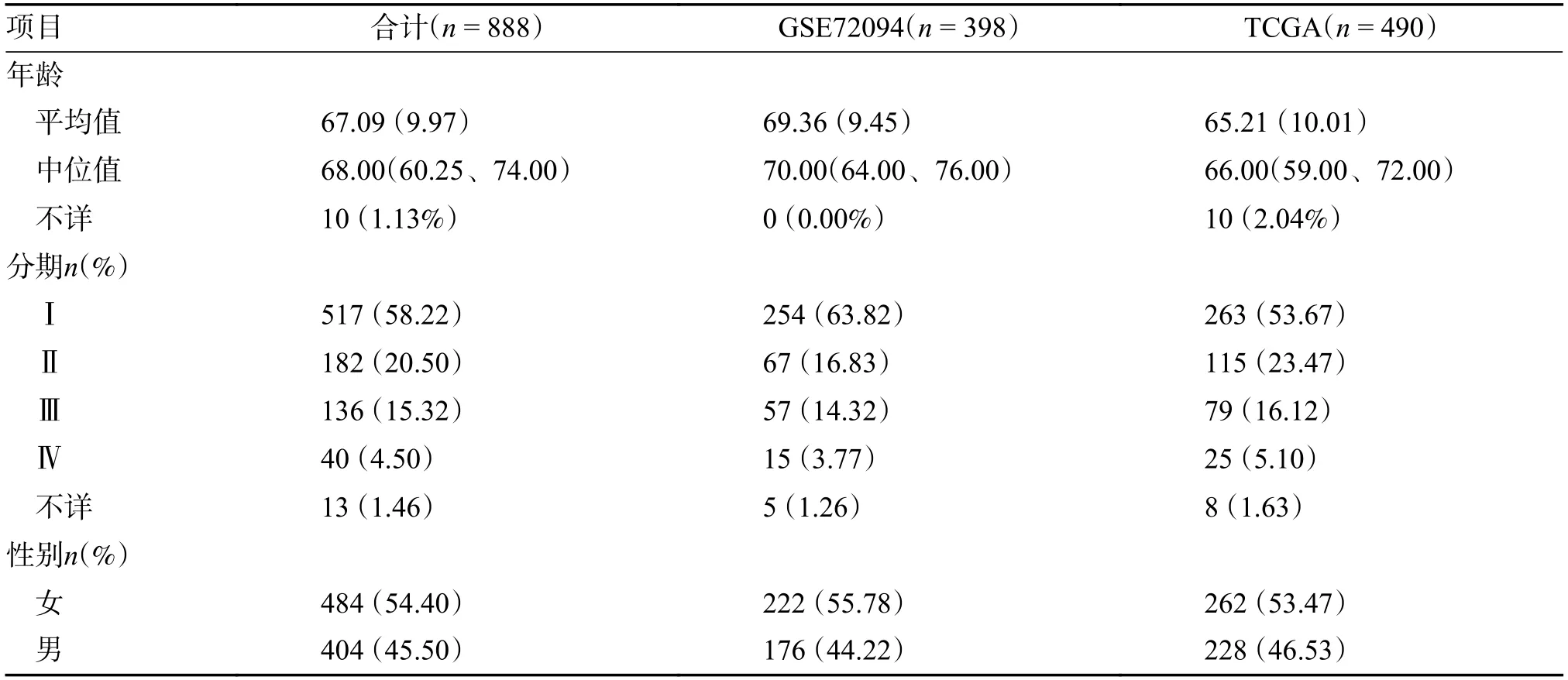
表2 GSE72094、TCGA 的年龄、分期、性别分布情况Tab.2 GSE72094、TCGA age,stage,gender distribution overall
1.2 方法
1.2.1 数据集定义其中来自TCGA 的490例肺腺癌数据用于本研究的训练数据集(Trainingdataset),而GSE11969 以及GSE72094 两个数据集作为本研究的2 个独立验证数据集(Independentvalidationcohort)。
1.2.2 基因表达量分析TCGA 中490例患者其中48例既有原发灶肿瘤样本的表达量,同时检测了癌旁正常肺组织的表达量信息。通过wilcoxontest 检验方法对比490例肺癌样本与48例癌旁样本之间的PLA2G1B 基因表达量。Pvalue 小于0.05 则定义为该基因在肿瘤以及癌种之间的表达量差异有统计学意义。
1.2.3 基因与患者的预后生存分析在训练数据集以及验证数据集中,分别按照PLA2G1B 基因的表达量排序,并取每个数据集中排名最低的四分之一样本为低表达量组,其余为高表达量组。然后通过log-ranktest 检验分析高低表达两组患者之间的预后总生存(overall survival,OS)差异。然后同时纳入数据集中提供的患者年龄、性别、分期信息通过Coxregressiontest 检验进行多因素生存分析已确定PLA2G1B 的表达量高低为肺腺癌患者的独立预后因素。
1.2.4 免疫浸润分析通过CIBERSORT 算法[12]分析490例TCGA 中肺腺癌患者的共计20 个免疫细胞类型的浸润程度,然后分别对比每一种免疫细胞在PLA2G1B 低表达和高表达两组之间的显著差异。
1.2.5 药物敏感性分析根据PLA2G1B 表达量分成低表达和高表达2组之后,使用pRRophetic 算法[13]分析2组患者之间的化疗药物敏感性,该算法集合了来自CCLE 的不同细胞系经过不同药物处理之后的IC50 信息。通过对比不同组别之间的IC50 信号差异,IC50 越低则说明该药物对该类细胞的抑制作用越强。
2 结果
2.1 PLA2G1B 基因在肺腺癌组织中表达量显著下调
通过对TCGA 中490例肺癌组织样本以及48例癌旁组织样本中的PLA2G1B 基因表达量进行对比分析发现,在肺腺癌样本中该基因的表达量发生了显著下调(P< 0.001),见图1。

图1 PLA2G1B 基因在肺腺癌组织以及癌旁组织中的表达量对比蓝色为肿瘤组织,红色为癌旁组织。Fig.1 Comparison of PLA2G1B gene expression between lung adenocarcinoma and paracancerous tissue
2.2 PLA2G1B 表达量越低肺腺癌患者的预后越差
在TCGA 的490例训练集数据中,PLA2G1B高表达组367例,低表达组123例;高表达组生存人数为247例低表达组生存人数为65例;中位生存期高表达组为1 632 d,低表达组1 115 d;中位随访期高表达组为670 d,低表达组为656 d。PLA2G1B 基因低表达的患者其整体生存率显著低于高表达组的患者(P=0.002,HR=0.60,图2A),在两个独立验证数据集中同样呈现出了低表达组预后差的一致结果。GSE72094 以及GSE11969 中的HR 分别为0.39 和0.51,P<0.05,差异有统计学意义,见图2B,图2C。

图2 PLA2G1B 基因表达量与OS 关系Fig.2 The relationship between PLA2G1B gene expression and OS
2.3 多因素生存分析发现PLA2G1B 基因为独立预后因素
在TCGA 以及来自GEO 的2 个独立验证数据集中均提供了患者年龄、性别、分期信息,将三个临床潜在影响患者预后的因素以及PLA2G1B基因的表达量一起纳入多因素预后分析模型中发现,经过多因素校正之后PLA2G1B 基因的表达量依然为显著影响预后的因素。在训练集以及两个独立验证数据集中均达到了差异有统计学意义(P< 0.05),结果如图3(A-TCGA 训练集P=0.003,B-验证集1GSE11969P=0.046,C-验证集2GSE 72094P< 0.001)。

图3 多因素校正生存分析Fig.3 Multivariate adjusted survival analysis
2.4 免疫细胞浸润程度分析提示PLA2G1B 不同组之间免疫浸润程度有差异
通过对CIBERSORT 得到的22 类免疫细胞浸润程度对比分析发现,在PLA2G1B 基因高表达组的患者中相比低表达组的患者显著富集Bcellmemory,Tcell CD4+memoryresting,Monocyte,Myeloiddendriticcell,Mastcellactivated。而在低表达组中则表现为Macrophage M0/M1,Mastcellresting更为富集。该结果说明在PLA2G1B 表达量不同的2组之间呈现了不同的免疫浸润类型以及浸润程度,见图4。
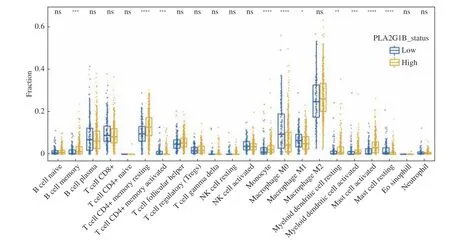
图4 CIBERSORT 算法分析免疫浸润水平Fig.4 CIBERSORT algorithm analysis of immune infiltration level
2.5 药物敏感性分析
为进一步研究PLA2G1B 表达量不同的两组患者之间是否有药物敏感性的不同,已探索后续针对预后显著不同的这两类人群采用不同的临床治疗方案。本研究通过pRRophetic 算法分析发现,在PLA2G1B 低表达(即患者预后表现更差的肺腺癌患者)的细胞系中,其对铂类化合物(Cisplatin),见图5A,多西他赛(Docetaxel),见图5B,依托泊苷(Etoposide),见图5C,吉西他滨(Gemcitabine),图5D,紫杉醇(Paclitaxel),见图5E,长春瑞滨(Vinorelbine),见图5F 等常见化疗药物的敏感性均更好,表现为IC50 显著更低(P< 0.05)。该结果也提示临床上表现为PLA2G1B 基因低表达的肺腺癌患者相比高表达的患者,有更高的可能取得临床获益。

图5 PLA2G1B 表达量不同分组之间化疗药物的敏感性分析Fig.5 Sensitivity analysis of chemotherapeutic drugs among different groups with PLA2G1B expression levels
3 讨论
本研究基于数据挖掘对肺腺癌中PLA2G1B基因的表达特征、预后特征、免疫特征以及药物敏感性特征进行了全面分析。并发现在肺腺癌中患者的PLA2G1B 基因发生了显著下调,该基因表达量的下调同时关联了肺腺癌患者的整体更差的生存表现,提示该基因的表达量越低患者的肿瘤恶性程度也存在更高的可能性。该发现不仅了490例的TCGA 中大样本发现,并且在两个独立的验证数据集中进一步证实该结果的可靠性。当纳入更多的潜在影响患者临床预后表现的年龄、性别以及患者临床分期之后,该基因的预后指导作用依然显著,且同样在多个独立数据集中得到验证,进一步证明该基因的独立提示预后作用。
在既往研究中多次证明患者整体的预后表现与患者的免疫浸润程度息息相关。杀伤性免疫细胞浸润程度越高的患者其在整体的预后表现中则更好,这与免疫细胞的协助杀伤肿瘤功能相一致。而在本研究中为了解释PLA2G1B 低表达的患者预后更差的潜在因素,同样进行了免疫浸润程度的分析。结果发现在低表达差预后的患者中仅有Macrophage M0/M1,Mastcellresting 细胞更为富集,而在高表达好预后的患者中显著富集的免疫细胞较多,包括Bcellmemory,Tcell CD4+memoryresting,Monocyte,Myeloiddendriticcell,Mastcellactivated。其中尤其B 细胞以及CD4+T 细胞均已被多次证实[14],该细胞越多越容易激活免疫反应,并行使对肿瘤细胞的杀伤功能。该结果也为PLA2G1B低表达的患者表现出较差的预后提供了一种解释,即为低表达的患者呈现较强的免疫排斥现象,有较少的免疫细胞浸润,进而免疫杀伤功能不足,影响到患者的整体预后表现。
为了进一步协助临床为低表达差预后的患者选择更为有效的治疗测序,本研究通过细胞系的药物敏感性数据分析发现,在PLA2G1B 低表达的患者中其对化疗药物如铂类化合物(Cisplatin),多西他赛(Docetaxel),依托泊苷(Etoposide),吉西他滨(Gemcitabine),紫杉醇(Paclitaxel),长春瑞滨(Vinorelbine)的敏感性更好,IC50 更低,该结果也为进一步的临床治疗选择提供了一定的依据。但因缺少真实患者样本的数据验证,因此该结果具有一定的局限性。
