大蒜己糖激酶基因AsHXK2的克隆及其参与根际促生菌缓解干旱胁迫的表达分析
2022-10-07郭春倩
郭春倩 ,田 洁,2,*
(1.青海大学 农林科学院, 青海省蔬菜遗传与生理重点实验室, 青海 西宁 810016; 2.青海大学 省部共建三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016)
干旱作为限制粮食安全和植物生产力的主要因素之一,对农作物的生长发育及产量造成严重影响。干旱胁迫会导致作物细胞脱水,阻碍细胞扩张,导致水势降低、膨压损失、气孔关闭、膜完整性破坏以及蛋白质变性。根际促生菌(PGPR)作为一种生活在土壤或附生于根系的一类细菌,具有促进植物生长及矿质营养吸收,并提高植物抗逆能力的作用。已有研究证明,由根际微生物诱导的植物耐旱性可通过分泌亲水性胞外多糖(EPS)途径,赋予生物膜结构和许多功能,且胞外多糖的分解能够有效增强寄主植物适应不同生态环境或地理分布的能力,使寄主植物具有更大的适应性优势,以确保植物在干旱胁迫条件下的生存。
己糖激酶(HXK)是一种双功能蛋白,在高等植物体内以多基因家族形式存在,具有磷酸化己糖关键性作用,为植物的生长发育提供能量。另外,HXK在植物介导糖信号中具有重要作用。作为糖传感蛋白,参与糖信号转导,感知胁迫、光照、激素和养分等条件,进而调控植株的基因表达与生长发育。目前已从葡萄、枸杞、茶树、苹果等植物中成功克隆出基因,并发现不同植株中其家族成员数目各不相同,如在单子叶植物水稻有11个家族成员,模式植物拟南芥中有6个家族成员,番茄中有4个家族成员,不同植物的基因家族成员在不同生长发育时期及器官表达特性各异。其中2基因作为第一个被鉴定出的植物基因之一,经验证在多数植物中均有存在。目前对植物己糖激酶的研究主要集中于基因在植物生长发育过程中的作用,关于其在抗逆胁迫方面的研究则相对较少。因此,研究己糖激酶相关基因,明确其功能,对揭示植物抗逆机制具有重要意义。
大蒜(L.),百合科葱属一、二年生草本植物,是世界范围广泛栽培的药食兼用蔬菜。因其原产地土壤中水分含量较高,因此形成根系小,入土浅,分布范围窄,根毛极少,所以大蒜根对水分要求严格,反应敏感。目前有关大蒜基因克隆及其参与根际促生菌缓解干旱胁迫的表达研究尚未见到报道。本研究以乐都紫皮大蒜为材料,基于大蒜转录组测序数据,克隆出大蒜2的开放阅读框全长,并分析了大蒜在干旱胁迫下根际促生菌处理下2的表达特征,为进一步研究大蒜2的功能及大蒜己糖代谢机制提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为青海省主栽品种乐都紫皮大蒜,由青海大学农林科学院园艺所提供。供试促生菌菌株为恶臭假单胞菌()UW4,由加拿大滑铁卢大学提供。
1.2 促生菌悬浮液的制备
恶臭假单胞UW4接种于LB液体培养液中,在30 ℃摇床上以160 r·min振荡培养至=0.6(菌落数达10CFU·mL),菌悬液于3 000 r·min离心5 min收集菌体,弃上清。菌体用无菌ddHO清洗2次后,将沉淀于管底的菌体重新悬浮,并保持原有菌液浓度,4 ℃保存备用。
1.3 试验设计
将解除休眠的乐都紫皮大蒜播种于含有基质(草炭∶珍珠岩体积比1∶1)的盆钵中,并置于植物光照培养箱中进行培养。培养条件25 ℃/15 ℃(14 h/10 h,白天/黑夜),空气相对湿度为70%。培养至大蒜幼苗长至10~12 cm,选取长势一致、健壮的大蒜幼苗进行不同处理。试验设4个处理:CK,以300 mL蒸馏水浇透盆钵,培养条件不变,每5 d浇一次水;PGPR,将制备好的300 mL菌悬液以灌根的方式浇入盆钵,培养条件不变,每5 d浇一次水;DT,300 mL蒸馏水浇透盆钵后进行干旱胁迫处理,参照课题组前期研究通过停止浇水进行人工控水,保持空气相对湿度30%,处理结束时土壤达中度干旱(土壤相对湿度为50%左右);DTP,300 mL菌悬液浇透盆钵后进行干旱胁迫处理,通过停止浇水、保持空气相对湿度30%,使土壤达中度干旱(土壤相对湿度为50%左右)。处理15 d进行采样,取3次重复,分别采取大蒜叶片、假茎、鳞芽以及根系,液氮速冻后立即置于-80 ℃冰箱进行保存,以备后续试验使用。
1.4 试验方法
1.4.1 总RNA提取与cDNA合成
将上述4个不同处理的大蒜叶片、假茎、鳞芽和根系材料利用天根总RNA提取试剂盒进行总RNA提取,通过诺禾HonorⅡ 1st Strand cDNA Synthesis SuperMix for qPCR试剂盒对所提取的RNA反转录为cDNA,以备后续2基因克隆。
1.4.2 大蒜2基因的克隆
根据大蒜转录组数据(未公布),查找得到大蒜己糖激酶基因2基因序列。并设计全长扩增引物,引物序列为AsHXK2-F(5′-ATGATGTCCAAGAAAGCGGCT-3′)和AsHXK2-R(5′-TCAGGGCTCTTCGACTCCAAT-3′)。并以处理0 d乐都紫皮大蒜根系单链cDNA作为模板,使用2X-酶进行PCR扩增,PCR产物经1.0%琼脂糖凝胶电泳、目的条带回收纯化、连接至PMD19-T载体、转化至感受态细胞后,送至北京六合华大基因科技有限公司测序,取适量转化产物涂板于LB+氨苄青霉素(Amp)的固体培养基,随机挑选阳性单克隆测序,获得目的序列。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸2.5 min,共35个循环;72 ℃延伸10 min。PCR产物用琼脂糖凝胶电泳回收,与pMD19-T载体连接,并转化至大肠埃希菌DH5α中,阳性克隆。
1.4.3 序列分析
在NCBI数据库中获得水稻等其他植物的HXK2序列。利用DNAMAN软件进行氨基酸序列比对和蛋白质疏水性/亲水性分析;采用ExPaSy(https://web.expasy.org/protparam/)软件对氨基酸基本成分、蛋白质分子量和等电点进行分析;跨膜结构域和亚细胞定位预测分别采用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)和Softberry(http://linux1.softber-ry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)在线软件进行网上运行分析;利用SOPMA软件分析蛋白质二级结构(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl);通过Phyre 2软件预测蛋白质三级结构(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index);使用NCBI中的BlastP(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比对,在蛋白质保守区数据库中对AsHXK2进行预测蛋白质保守区;使用MEGA 6.0软件对系统进化树进行测试和编辑,生成报告图形。
1.4.4 实时荧光定量PCR
实时荧光定量PCR(qRT-PCR)按照试剂盒操作说明在Roche LightCycler480 Ⅱ上进行。以大蒜基因为内参基因,其引物为CYP-F:5′-AAGGACGAGAACTTCATC-3′,CYP-R:5′-TCAATATCTCTCACCACTTC-3′。根据克隆得到的己糖激酶基因序列设计表达检测引物AsHXK2-F:5′-CACCAACACCTCCCTAAAG-3′和AsHXK2-R:5′-CATACAAGCCACCATCCAT′,目的基因与内参基因一起扩增。
1.5 数据分析
以大蒜基因作为定量表达分析的内参基因,采用2-ΔΔC法计算目的基因的相对表达水平。
2 结果与分析
2.1 大蒜己糖激酶基因AsHXK2的克隆与序列分析
以大蒜品种乐都紫皮大蒜的叶片cDNA为模板,经过PCR扩增后得到1条长度约为1 500 bp的片段(图1)。经测序表明,2基因ORF全长序列为1 500 bp,编码499个氨基酸(图2)。用NCBI中的CD-Search对2基因编码蛋白中可能存在的结构与结构域进行分析。

M,DNA分子量标准(2 000 bp)。M, DNA marker (2 000 bp).图1 大蒜AsHXK2基因的RT-PCR扩增Fig.1 AsHXK2 gene amplified by RT-PCR from garlic

图2 大蒜AsHXK2基因的核苷酸序列及其编码的氨基酸序列Fig.2 Nucleotide sequences and predicted amino acid sequences of AsHXK2 gene from garlic
2.2 大蒜AsHXK2蛋白的理化性质分析
ExPaSy-ProtParam预测结果表明,AsHXK2蛋白分子式为CHNOS,分子量为57.77 ku,理论等电点为6.37,亲水性平均系数为-0.048,是一个稳定性蛋白(不稳定系数为36.64)。SignaIP 3.0 Server预测结果显示,该蛋白无信号肽,不属于分泌型蛋白;TMHMM预测该蛋白有一个跨膜螺旋区(图3)。AsHXK2蛋白的亚细胞定位预测结果表明:该蛋白定位于叶绿体的可能性较大。

图3 大蒜AsHXK2蛋白跨膜结构域的预测Fig.3 Prediction of the transmembrane domain of AsHXK2 protein
2.3 大蒜AsHXK2的氨基酸亲水性和疏水性预测
通过DNAMAN7.0对大蒜AsHXK2基因推导的氨基酸序列进行亲水性/疏水性分析。结果表明(图4),该蛋白的第432位赖氨酸(Lys)亲水性最强;疏水性最强的位点为第250位的亮氨酸(Leu),其次为第24位的亮氨酸(Leu)。
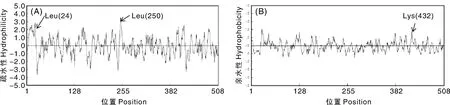
图4 大蒜AsHXK2氨基酸序列的疏水性和亲水性分析Fig.4 Analysis of hydrophilicity and hydrophobicity of amino acid sequences of AsHXK2 from garlic
2.4 大蒜AsHXK2的蛋白结构分析
利用SOPMA对AsHXK2蛋白进行蛋白质二级结构预测,结果如图5-A所示,AsHXK2的二级结构主要由α-螺旋(47.09%)、延伸结构(13.63%)、β-转角(5.41%)和无规则卷曲(33.87%)构成。利用Phyre 2软件进行同源建模,并通过PyMOL软件分析蛋白三级结构(图5-B),其结果显示AsHXK2蛋白模型构建基于模板c4qs9A,可信度100%,覆盖率为90%,且大蒜AsHXK2蛋白的三维结构由19个α-螺旋和14个β-折叠所构成。

图5 AsHXK2蛋白二级、三级结构预测Fig.5 Secondary and tertiary structure prediction of AsHXK2 protein
2.5 大蒜AsHXK2的保守域分析
在NCBI保守域数据库中将大蒜AsHXK2的氨基酸序列进行Blast比对(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),其包含一个氮端核苷酸结合域-糖激酶-热休克蛋白-激动蛋白(N-teraminal nucleotide binding domain-sugar kinase-heat shock protein-actin , NBD-sugar-kinase-HSP70-actin)以及一个己糖激酶特异位点,这些结果表明,AsHXK2属于己糖激酶2家族。

图6 大蒜AsHXK2氨基酸序列保守域预测Fig.6 Prediction of conserved domain of amino acid sequences of AsHXK2 from garlic
2.6 大蒜AsHXK2的进化树分析
利用MEGA6.0软件中的Neighbor-Joining法
将大蒜与其他12种不同植物的己糖激酶2(HXK2)构建同源进化树(图7)。结果显示,大蒜AsHXK2与天门冬科芦笋、禾本科的大麦HXK2在进化上属于同一个分支,且与芦笋在进化关系上最为接近。

图7 AsHXK2氨基酸序列的系统进化树Fig.7 Phylogenetic tree of AsHXK2 amino acid sequence
2.7 大蒜AsHXK2基因在不同组织表达分析及干旱胁迫下根际促生菌处理的响应分析
通过qRT-PCR对2基因在乐都紫皮大蒜不同组织中的表达模式进行分析。结果(图8)表明,在正常条件下2基因在大蒜叶、假茎、根和鳞芽中均有表达,其中,在鳞芽中表达水平最高,其次是假茎和叶,在根中表达水平最低,各组织间表达量存在显著差异。鳞芽2基因表达量较叶、根和假茎分别提高了4.08倍、9.20倍和4.15倍。

不同处理间没有相同字母表示差异显著(P<0.05)。下同。The bars with different letters showed the significant difference (P<0.05). The same as below.图8 不同大蒜组织AsHXK2基因表达量Fig.8 AsHXK2 gene expression in different tissues of garlic
由图9可知,不同处理均可以显著诱导或抑制2基因的表达,且不同组织变化趋势各不相同。图9-A显示,与对照相比,干旱胁迫及促生菌处理(PGPR、DT、DTP)均能显著增加叶中2的表达量,PGPR、DT、DTP下基因表达量分别比对照升高了1.71倍、1.92倍和2.21倍。同时,施加促生菌能够显著提高干旱胁迫下2表达水平,与DT相比,DTP使2表达量增幅10%;与大蒜叶片不同,根中2表达量仅在干旱胁迫处理(DT)显著高于对照,PGPR、DTP与对照无显著差异,同时DTP显著低于DT(图9-B);与大蒜叶片类似,假茎2表达量在PGPR、DT、DTP处理中分别比对照升高了1.48倍、1.88倍、1.28倍,且三者无显著差异(图9-C);而在大蒜鳞芽中,不同处理下2的表达趋势与其他组织存在明显差别,DT、DTP处理的2表达量显著低于对照,二者分别比对照降低了43%和45%,DT和DTP差异不显著(图9-D)。综上,干旱胁迫显著上调了大蒜叶片、根以及假茎中2的表达水平,显著下调了鳞芽中2的表达量。而促生菌仅能显著诱导干旱胁迫下叶片的2表达,即大蒜叶片2对干旱胁迫及促生菌处理的响应较为明显。

A,叶;B,根;C,假茎;D,鳞芽。A, Leaf; B, Root; C, Pseudostem; D, Scale bud.图9 不同处理下各大蒜组织AsHXK2基因表达量Fig.9 AsHXK2 gene expression in various tissues of garlic under different treatments
3 讨论与结论
生长在青海东部的作物经常遭受到干旱胁迫的影响,尤其大蒜作为东部农业区的主产作物之一,其产量及品质极易受到影响,严重时甚至导致植株死亡。植物体中正常的代谢是植株正常生长发育的基础,在逆境下其生长发育会受到严重影响。有研究表明,根际促生菌在增加植物吸收营养及增强植物的适应性等方面发挥重要作用,主要通过植物激素含量的改变、抗氧化防御、生产渗透剂和产生胞外多糖等方式改善、减轻干旱胁迫对植株造成的影响,维持植株正常生长。其中植物己糖激酶是具有磷酸化己糖和介导糖信号的关键性作用,源库组织内,由淀粉和蔗糖产生的葡萄糖和果糖,经HXK磷酸化形成葡萄糖-6-磷酸和果糖-6-磷酸,进而参与糖酵解、呼吸作用、分解与合成等代谢过程,为植物的生理活动提供能量和中间代谢产物,进而调控植株的基因表达与生长发育。因此,研究HXK不仅有利于阐明植糖己糖激酶相关基因表达水平及其抵御逆境胁迫的分子机制,也对改善干旱胁迫下大蒜植株的生存能力具有实际生产意义。本研究利用团队前期构建的大蒜转录组数据库,克隆得到大蒜2基因,并利用生物信息学方法对其性质和功能进行了分析。其ORF全长为1 500 bp,编码499个氨基酸,分子量为57.77 ku,理论等电点为6.37;亚细胞定位预测AsHXK2蛋白定位于叶绿体的可能性比较大,但其在细胞中具体位置需进一步试验证明;保守域分析显示,2基因所推导的氨基酸属于己糖激酶家族。因此,克隆大蒜2基因为其功能研究及大蒜抗逆品种育种改良提供新的基因资源。
目前,已有多种植物的己糖激酶基因被克隆,并发现该基因在植物抵御逆境过程中具有重要的功能。己糖激酶基因在植物代谢及生长发育中起着不可替代的作用,其在植物生长不同阶段和不同组织中表达量具有差异。如木薯2在不同组织中均有表达,其中木薯叶、茎和花的表达量最高,且各发育时期的木薯2表达水平明显不同,块茎初期和膨大阶段的基因表达量显著高于成熟块茎。在本研究中,2基因在大蒜叶、假茎、根、鳞芽不同组织中均有表达,且鳞芽2表达量最高,分别比叶、根和假茎提高了4.08倍、9.20倍和4.15倍。这与木薯2的组织表达特异性并不相同,说明不同作物间己糖激酶基因的组织表达存在差异。另外,研究表明,不利环境下通过差异表达来响应逆境胁迫,如拟南芥2会受到干旱、盐和低温的显著诱导;高粱1-5在干旱处理后,表达水平明显上调,而盐胁迫下1、7出现阶段性降低趋势。本研究为解析大蒜不同组织的2在促生菌及干旱胁迫下的响应情况,对4种处理后该基因的表达量进行了qRT-PCR分析。结果表明,干旱处理下叶片、假茎及根系的2表达量较对照显著提高了1.92倍、1.88倍、0.90倍,这可能是因为干旱胁迫介导了碳水化合物对气孔的调节作用,通过增加2表达量来提高植物水分利用效率;而鳞芽2表达水平在干旱胁迫显著降低,这可能是是由于干旱胁迫阻碍了光合作用,使得大蒜叶片糖类物质合成减少,而干旱胁迫程度的加重,鳞芽中贮藏的糖类营养物质被消耗,致使己糖激酶底物含量减少,故其表达量显著降低。与干旱处理相比,促生菌能显著提高干旱胁迫下大蒜叶片2的表达水平,这在一定程度上提高了大蒜叶片组织对干旱的抗性。与叶片不同,DTP处理的根系2表达量较DT显著降低,这可能是因为促生菌分泌的胞外多糖,促使根系己糖激酶通过磷酸化作用,将外源多糖转化为植物可吸收利用的糖,胞外多糖的转化过程需要大量的HXK2,使己糖激酶活性下降。即促生菌产生的胞外多糖与己糖激酶存在反馈抑制调节关系,通过下调2表达来参与干旱响应,为保证大蒜根系在干旱胁迫下正常的水分运输,故促生菌处理后通过降低根系2表达量参与干旱响应。说明2在干旱胁迫和促生菌处理下具有明显的组织特异性,且叶片2对促生菌缓解干旱胁迫的响应较为明显。综上可知,2基因在大蒜抵御干旱胁迫过程中发挥重要作用,且根际促生菌能够通过调节2基因表达量在一定程度上增强大蒜植株的抗旱性,这为进一步探讨己糖激酶基因参与根际促生菌缓解干旱胁迫的调控作用机制提供参考。
