基于网络药理学和体外细胞实验研究土茯苓抗骨质疏松的机制
2022-10-04高诗尧章镇宇李育泉黄林科
高诗尧 宁 超 章镇宇 李育泉 黄林科 谭 桢
(1. 广西医科大学 广西再生医学重点实验室, 广西 南宁 530022; 2. 广西医科大学 第二附属医院 骨科, 广西 南宁 530007)
骨质疏松是一种多因素导致的骨骼疾病,其主要特征为骨组织中骨小梁的破坏,导致骨量下降,骨强度降低,骨脆性增加[1-2]。骨质疏松的发病率随着年龄增长逐渐增高[3],我国65岁以上人群中骨质疏松患病率已达32%[4]。骨质疏松的发病机制尚未完全明确,目前主要认为是由于骨稳态平衡被打破所导致[5]。因此,进一步了解骨质疏松的发病机制,研究防治骨质疏松的方法是目前医学上亟待解决的问题。
土茯苓是一味传统中药,在临床上广泛使用。研究表明,土茯苓可以治疗痛风[6]、皮肤病[7]等疾病。然而,土茯苓成分复杂多样,目前关于该药治疗骨质疏松的化学成分和作用机制研究较少。网络药理学是一门借助多种学科技术,如系统生物学、计算机医学、分子药理学及药动学等,从系统层面揭示中药对机体网络调控作用的新学科[8]。本研究运用网络药理学方法对土茯苓治疗骨质疏松的成分及靶点进行归纳整理,并通过全面系统生物学分析,深入揭示土茯苓成分-靶点-通路之间的相互作用,并通过体外细胞实验验证土茯苓对成骨的作用,为探索土茯苓治疗和预防骨质疏松提供新的思路。
1 材料与方法
1.1 材料
1.1.1 细胞
武汉普诺赛生命科技有限公司提供MC3T3-E1成骨细胞系。
1.1.2 药品与试剂
土茯苓购自上海源叶生物科技有限公司,成骨诱导液(β-磷酸甘油0.4 mol,抗坏血酸10 mg/mL,地塞米松100 μmol)由赛业(广州)生物科技有限公司提供,碱性磷酸酶(alkaline phosphatase,ALP)显色试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 土茯苓药物成分及成分相关靶点搜集
将土茯苓在中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)[9]中筛选出药物的有效成分,同时按照口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug-likeness,DL)≥0.18筛选出有效成分并搜集其相关靶点。
1.2.2 骨质疏松疾病靶点的建立
在人类基因数据库(GeneCards)以“osteoporosis”为关键词搜集疾病靶点,删除重复靶点并利用Unitprot(https://www.uniprot.org/)数据库进行蛋白与基因的标准化转换。
1.2.3 构建韦恩图、有效成分-作用靶点网络
通过微生信(https://www.bioinformatics.com.cn/)在线作图工具制作韦恩图并获得药物-疾病交集靶点,采用Cytoscape 3.9.1软件,构建药物有效成分与基因的相互作用网络。
1.2.4 构建药物蛋白与疾病蛋白的相互网络关系图
采用STRING数据平台(https://string-db.org)[10]对药物-疾病交集靶点进行蛋白相互作用(protein-protein interaction,PPI)网络构建,隐藏游离节点,获取TSV数据,使用Cytoscape软件进行可视化分析,根据CytoHubba插件的MCC算法获取PPI网络中的前十位核心靶点基因。
1.2.5 GO和KEGG富集分析
使用Metascape数据库(https://metascape.org/)[11]对药物-疾病交集靶点进行基因本体(gene ontology,GO)及京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,设富集结果P<0.01时有统计学意义。使用微生信在线作图软件对富集结果-log10(Pvalue)值由小到大排列的GO生物功能前10条及KEGG信号通路前20条富集结果制作气泡图进行可视化分析。
1.2.6 土茯苓对成骨分化的影响
MC3T3-E1成骨细胞系复苏后接种于α-MEM完全培养基(含10%胎牛血清、1%青/链霉素),置于37℃,5%CO2培养箱中培养。
土茯苓完全溶解于含有二甲亚砜的母液中,-20℃下保存。使用前用完全培养基将其溶解于所需的工作液中。将MC3T3-E1细胞以105/孔接种于24孔板。空白对照组用完全培养基培养细胞,实验组加入含有诱导液(每50 mL的培养基加入1.25 mL β-磷酸甘油,0.25 mL抗坏血酸,5 μL地塞米松)和不同浓度土茯苓(0 μmol/L,10 μmol/L,50 μmol/L)的培养基进行培养。间隔48 h更换培养基,培养7天后用多聚甲醛固定30 min,ALP显色试剂盒染色30 min。采用BioTek成像系统拍照, Image J软件定量分析。
1.3 统计学方法
所有数据采用GraphPad Prism 8.0.2软件包进行统计分析,计量资料以均数±标准差表示,采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 土茯苓药物成分及成分相关靶点
根据OB≥30%且DL≥0.18的标准,在TCMSP数据库并结合文献检索,共获得土茯苓有效成分15个(表1),其中包括槲皮素、β-谷甾醇、豆甾醇、柚皮素等;成分相关靶点总计324个,删除重复靶点,最终有129个相关靶点。

表1 土茯苓有效成分一览表
2.2 骨质疏松症的相关靶点
在GeneCards数据库并结合文献检索,共获得疾病靶点4 658个,取Relevance score分数≥0.5的2 287个靶点。
2.3 药物-疾病交集靶点、有效成分-作用靶点网络分析
构建药物成分相关靶点及疾病相关靶点韦恩图(见图1),获得PTGS1、PGR、JUN、ESR1、AKT1及MAPK3等68个药物-疾病交集靶点;通过Cytoscape 3.9.1软件进行映射分析,构建土茯苓有效成分相互作用靶点网络图(见图2)。

图1 土茯苓-骨质疏松症靶点及交集韦恩图

注:红色代表土茯苓的有效成分,蓝色代表有效成分的靶点基因
2.4 蛋白相互作用网络
在STRING软件中,对68个药物-疾病交集靶点进行分析,获取TSV数据文件并导入Cytoscape 3.9.1软件进行分析,使用插件CytoHubba中MCC算法获取药物相互作用网络中前10的核心基因,包括IL1B、PTGS2、TNF、CXCL8、VEGFA、IL10、EGF、JUN、CCL2、AKT1。对核心基因进行PPI分析,见图3。

注:A:土茯苓与骨质疏松症共同靶点蛋白相互作用网络图,颜色由浅入深按照degree从小到大排列; B:土茯苓治疗骨质疏松症前十位核心靶点蛋白互作网络图,颜色深浅代表靶点蛋白的重要性
2.5 GO及KEGG富集分析
将土茯苓治疗骨质疏松症的作用靶点导入Metascape数据库进行GO生物功能富集分析和KEGG信号通路富集分析,其中GO富集分析主要涉及细胞因子受体结合、趋化因子受体结合、核受体活性等;KEGG通路富集分析结果显示基因可能涉及HIF-1、AMPK、P53及Wnt信号通路。通过微生信在线作图软件对富集结果-log10(Pvalue)值由小到大排列,GO生物功能前10条(图4A)及由大到小排列KEGG信号通路前20条富集结果制作气泡图(图4B)。

注:BP:生物学过程; CC:细胞组分; MF:分子功能
2.6 土茯苓对成骨分化的影响
为了解土茯苓对成骨细胞分化的作用,我们对成骨细胞系MC3T3-E1加入诱导液和不同浓度土茯苓(0 μmol/L、10 μmol/L、50 μmol/L)进行培养并设置空白对照。细胞培养7天后,进行ALP染色。实验结果表明,仅加入诱导液的对照组ALP染色呈阴性,随着加入土茯苓的浓度增加,ALP染色加深,50 μmol/L的土茯苓可显著促进成骨细胞ALP的表达(P<0.01),见图5。
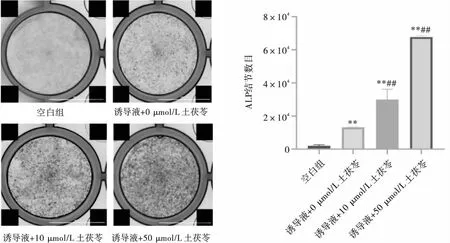
注:与空白组比较,**P<0.01; 与诱导液+0 μmol/L土茯苓组相比,##P<0.01
3 讨论
骨质疏松由于进行性骨量减少及骨强度降低,骨小梁破坏,增加了骨折风险。该病主要临床表现为进行性腰背部疼痛、平衡功能降低[12]。骨质疏松的病理生理学基础在于成骨细胞骨形成和破骨细胞骨吸收功能失衡[13]。各种原因导致的成骨细胞的减少而影响骨形成减弱是其重要的发病机制[14]。成骨在细胞基质矿化中发挥重要作用,成骨细胞的减少导致骨形成减少[4]。目前,临床治疗骨质疏松症的主要药物有维生素D、甲状旁腺激素和双膦酸盐等[15]。而这些药物具有一定副作用,如雌激素疗法并不适合长期治疗骨质疏松症,主要由于高水平的雌激素可能诱发子宫出血、乳腺癌和心血管疾病[16];双膦酸盐可能引起恶心、呕吐等胃肠道反应[17]。网络药理学从网络层面观察药物对疾病的影响并阐明机制,从而有效降低用药风险并找出高效药物。目前有研究已证实,中草药及提取物在骨质疏松防治方面安全有效,如虎杖苷可以通过激活Wnt/β-catenin信号通路,增强骨质疏松症期间骨髓间质干细胞功能,减轻骨质流失[18]。
本研究通过TCMSP数据库筛选出OB≥30%和DL≥0.18的15个土茯苓有效成分,发现作用于骨质疏松靶基因的主要活性成分有柚皮素[19]、槲皮素[20]、β-谷甾醇[21],这些化合物主要参与调节PI3K/AKT相关信号通路等。除此之外,存在一些尚未被研究的有效成分,这将成为未来研究土茯苓治疗骨质疏松的潜在方向。土茯苓的活性成分与骨质疏松的主要蛋白有很强的相互作用,其中涉及JUN、TNF、VEGFA等核心靶蛋白。研究证实,在骨形成中基因VEGF发挥不可替代的作用,与骨修复关系是不可分割的,其主要机制是可以诱导新血管生成,从而为骨组织提供氧气、营养、生长因子和激素,促进骨组织的生长[22]。JUN磷酸化后,可以通过刺激cAMP信号通路,促使类固醇生成的相关基因表达量增加[23]。TNF通过直接刺激细胞可诱导细胞增殖和分化[24]。故推测,土茯苓可能通过作用于VEGFA、JUN、TNF等靶点发挥抗骨质疏松的作用。
我们将所得到的靶点通过KEGG富集分析,发现共同靶点可能通过HIF-1、AMPK、Wnt等多条通路参与防治骨质疏松。研究表明,Wnt通路可以促进成骨的分化,其主要机制如下:当Wnt信号通路激活状态时,Wnt蛋白与卷曲蛋白及低密度脂蛋白相互结合,竞争性结合GSK-3β进而降解复合物[25];β-catenin由胞质转移至胞核,其C端与转录因子TCF/LEF结合,上调RUNX2/Cbfα转录因子家族基因的表达,从而促进成骨分化[26]。细胞实验ALP染色也发现,土茯苓具有促进成骨分化的作用。ALP是成骨细胞分化的早期指标、骨形成不可缺少的因子,可以直观反映骨的活跃程度[27]。
综上所述,运用网络药理学和体外细胞实验研究发现,土茯苓防治骨质疏松可能与其能够促进成骨分化有关,为下一步系统地开展土茯治疗骨质疏松的实验研究及临床应用提供了理论依据。
