超声波对盐胁迫下紫松果菊种子萌发和幼苗生理特性的影响
2022-09-30朱庆松赵晶晶曹永奕马桂花
尹 娟,朱庆松,赵晶晶,曹永奕,马桂花
(信阳农林学院,河南 信阳 464000)
我国盐碱地总面积高达9 913 万hm2,已被开发用于农业种植的面积较小[1]。根据土壤中含盐量差异,可将其分为轻度(含盐量<0.3%)、中度(含盐量0.3%~0.6%)和重度(含盐量>0.6%)盐碱地[2]。盐胁迫不仅对植物种子萌发有一定影响,甚至对植物的整个生长期都有一定影响。有研究表明,我国土地盐碱化程度有加重趋势[3]。耐盐植物种植布局以及完善的配套农业管理措施有助于合理开发利用盐碱地,对改善生态环境及农业可持续发展具有重要意义。
河南是我国花卉产业大省,近5 a 来,花卉年均种植面积达到10 万hm2以上,年产值已突破100 亿元,位居全国第二,全省形成南阳月季、洛阳牡丹、开封菊花等特色花卉生产集聚区[4]。紫松果菊(Echinacea purpurea)是一种菊科松果菊属宿根草本植物,我国从20 世纪80 年代开始,陆续在北京、吉林、河南等地开展引种栽培[5]。紫松果菊因颜色亮丽、造型奇特,大面积应用于城市公园景观中,在河南开封、信阳、南阳等地已广泛种植[6]。随着城市建设加剧,园林土壤普遍硬化,不透水导致盐分大量积累产生胁迫[7]。盐胁迫下,植物体内渗透调节物质失衡,氧化和抗氧化平衡被打破,活性氧(ROS)大量积累,导致植物的生理代谢紊乱,生长发育受到明显抑制[8]。研究表明,紫松果菊在一定浓度盐胁迫下,种子萌发和生长会受到明显抑制[9]。另外,随着盐浓度的升高,紫松果菊幼苗株高、生物量以及体内抗氧化酶活性均显著降低[10]。因此,提高紫松果菊的耐盐性有利于其在盐环境中正常生长。
超声波是一种波长极短的机械波,已广泛应用于谷物、豆类、花卉和中药材等,提高种子萌发质量[11]。超声波具有操作简单、环保、性价比高等特点,被视为可提高种子萌发期耐盐碱能力的一项物理技术[12]。超声波处理可提高水稻[13]和毛竹[14]种子盐胁迫下的萌发率。然而超声波对盐胁迫尤其是高盐胁迫下紫松果菊种子萌发的影响鲜有报道。鉴于此,拟以紫松果菊种子为试验材料,利用不同时长超声波处理,研究其对不同含量盐胁迫下种子萌发的影响,以期为紫松果菊的耐盐性应用和优质高效栽培提供理论依据。
1 材料和方法
1.1 试验材料
试验所用紫松果菊(匠心系列品种)种子于2020 年7 月购于江苏长景种业有限公司;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)等试剂盒购买于南京建成生物工程研究所;超声波清洗仪(KH5200)购自江苏省昆山市禾创超声仪器有限公司。
1.2 试验设计与处理
选取颗粒饱满、大小均匀的紫松果菊种子,放入0.5%的高锰酸钾溶液中浸泡消毒8 min,然后用无菌蒸馏水清洗消毒后的种子,重复清洗3 次。将清洗后的种子分成4 组,每组3 次重复,采用超声波清洗仪(频率40 kHz、功率200 W)对清洗干净的4组种子进行不同时长(0、5、25、45 min)超声波处理,并向超声仪槽内注入不同含量的NaCl 溶液[0、0.45%(低盐)、0.90%(高盐)]进行处理。最后将超声波处理后的种子在25 ℃下用无菌水浸泡10 h,室内风干。具体试验设计见表1。
1.2.1 种子发芽试验 采用滤纸床发芽法,提前将滤纸和培养皿进行高压灭菌处理。将种子放入垫有2 层滤纸的培养皿中,每个培养皿40 粒种子,每个处理5 个培养皿,3 次重复。按照表1,每个培养皿加入对应含量的NaCl 溶液15 mL,每天补充相应的新溶液至原刻度。将培养皿放入植物生长气候箱中进行发芽试验,设置温度为25 ℃、光照/黑暗时间为14 h/10 h、光照强度为2 000 lx。
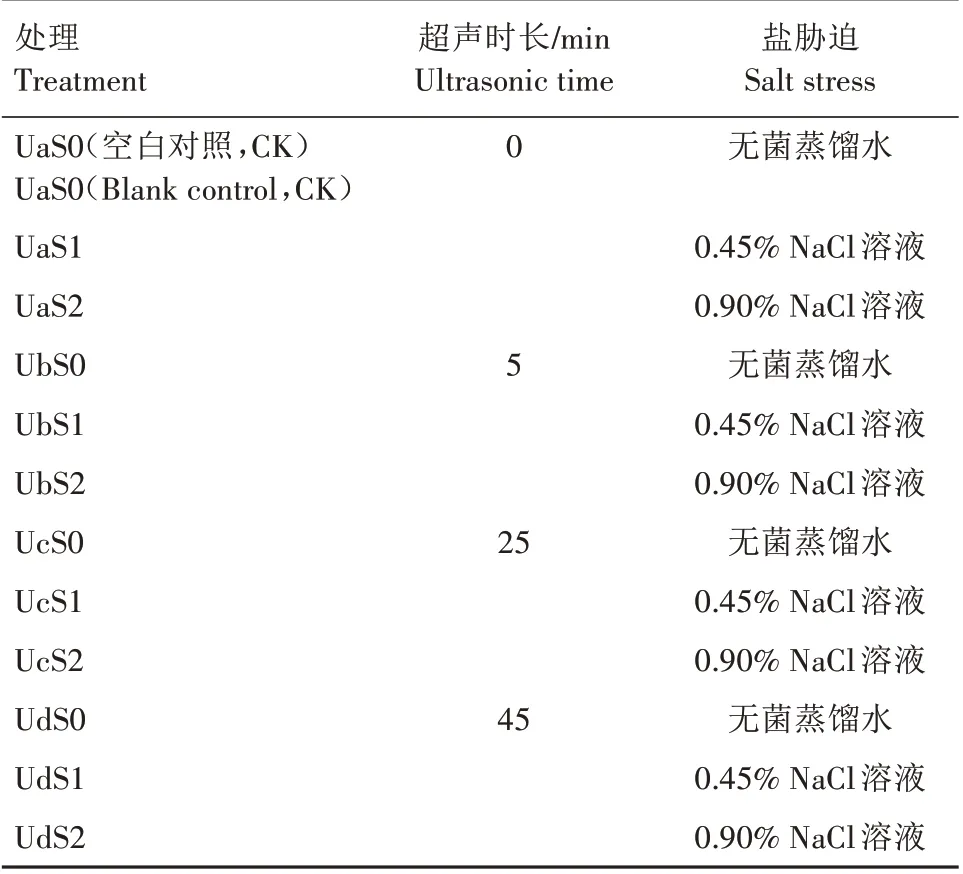
表1 盐胁迫下紫松果菊种子超声波处理试验设计Tab.1 Ultrasonic experimental design of E.purpurea seeds under salt stress
1.2.2 盆栽幼苗生长试验 待紫松果菊种子小苗长出2 片子叶后,按照不同处理选取长势较一致的紫松果菊幼苗,移栽于装有等量砂土的培养盆中。砂土提前以高温灭菌。培养盆规格为直径50 cm、深度40 cm。每盆15株为1个处理,3次重复。将移栽后的幼苗放入恒温气候室中培养,控制温度为25 ℃、湿 度 为65%~75%、光 照/黑 暗 时 间 为12 h/12 h。配制Hoagland’s营养液。前期每天每盆浇灌100 mL无菌蒸馏水和20 mL Hoagland’s 营养液,当紫松果菊幼苗长出3 片子叶时,向盆中喷施对应处理组的不同含量NaCl 溶液50 mL 或无菌蒸馏水,后期常规管理直到试验结束。将第1 次喷施不同含量NaCl溶液的时间记为盐胁迫第0天。
1.3 测定项目
1.3.1 种子萌发指标测定 紫松果菊种子发芽率、发芽势、发芽指数和活力指数测定依照参考文献[15]中的方法进行。当胚根长度接近种子长度时,记作萌发。并于第7、10、13 天记录发芽种子数,在第13天记录萌发种子的胚根、胚芽长度。
发芽率=第13 天发芽种子数/试验种子总数×100%;
发芽势=第10 天发芽种子数/试验种子总数×100%;
发芽指数=Σ(第n天种子的发芽数/相应种子发芽天数);
活力指数=发芽指数×(胚根长度+胚芽长度)。
1.3.2 幼苗抗氧化酶活性和渗透调节物质测定 分别在盐胁迫第5、10、20天采集紫松果菊幼苗顶部功能叶。每个处理每次采集5 株,每株采集1 片功能叶,无菌蒸馏水清洗干净后晾干备用。按照试剂盒说明书方法分别测定紫松果菊幼苗叶片内SOD、POD、CAT 活性和MDA 含量。并在第20 天采集全部紫松果菊幼苗叶片及根,分别测定根和地上部分干质量,并计算根冠比(根干质量/地上干质量)。第20 天幼苗根系脯氨酸、可溶性糖含量测定参考张治安等[16]的方法,同时采用考马斯亮蓝法测定可溶性蛋白含量[17]。
1.4 数据处理
采用Excel 2013 及SPSS 22.0 进行数据处理与统计分析,种子萌发和幼苗生长试验数据均取平均值。
2 结果与分析
2.1 超声波处理对盐胁迫下紫松果菊种子萌发的影响
超声波处理对盐胁迫下紫松果菊种子发芽率、发芽势、发芽指数和活力指数的影响见表2。与空白对照(UaS0)相比,未经超声波处理的0.45%、0.90%NaCl 溶液胁迫下紫松果菊种子发芽率、发芽势、发芽指数和活力指数均显著减小(P<0.05);在非盐胁迫下,种子经超声波处理后,与空白对照相比,种子萌发指标均明显提高,随着超声波处理时长的增加各项指标均出现先升高后降低趋势,说明适宜时长的超声波处理有助于提高种子的发芽率、发芽势、发芽指数和活力指数。在超声波和盐胁迫协同处理下,相同时长超声不同盐含量处理中,随着盐含量的增加种子的发芽率、发芽势、发芽指数和活力指数均呈不同程度的降低;在相同盐胁迫下,随着超声波处理时长的增加,种子的发芽率、发芽势、发芽指数和活力指数均呈现先升高后降低趋势,且均在25 min 超声波处理时达到最高值。可见,对种子进行超声波处理能明显缓解盐胁迫对紫松果菊种子萌发造成的伤害,以25 min 超声波处理为最佳处理时长。
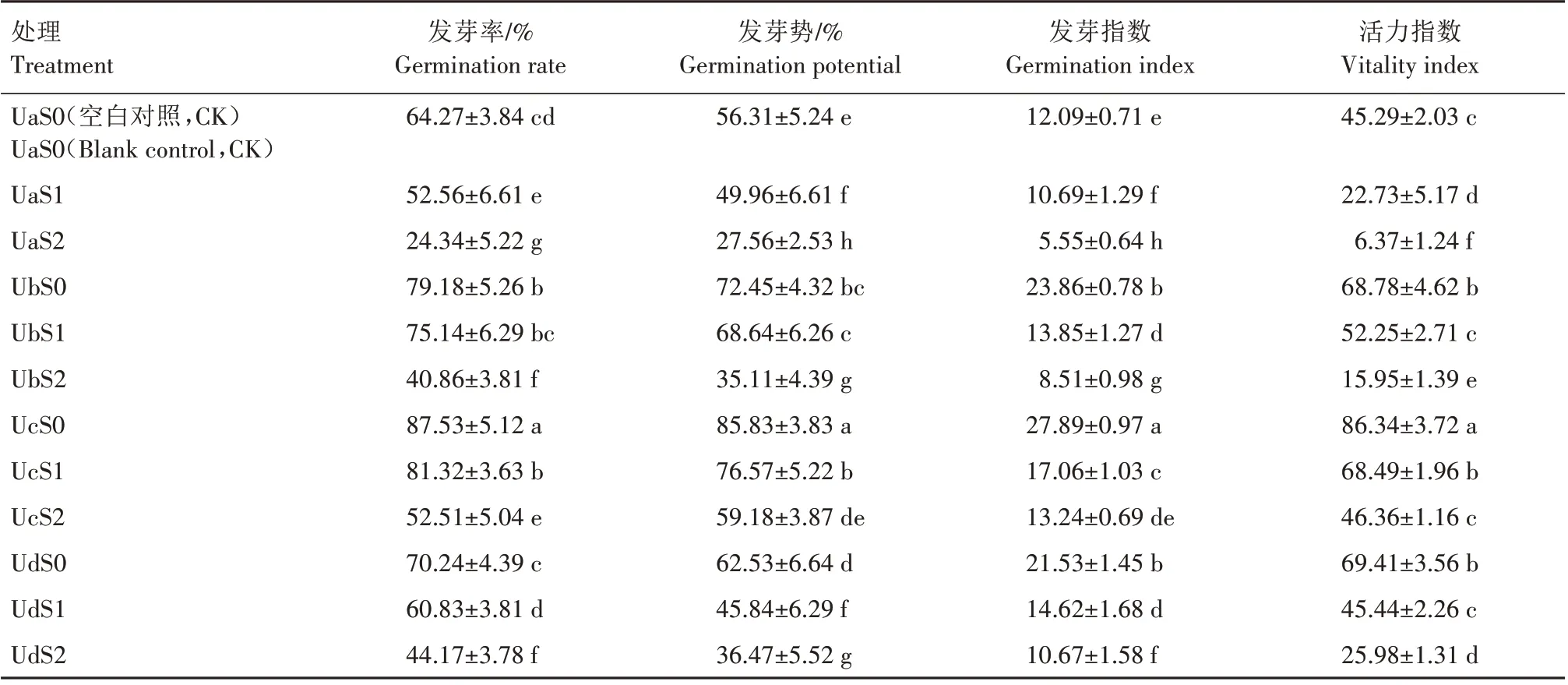
表2 超声波处理对盐胁迫下紫松果菊种子萌发的影响Tab.2 Effect of ultrasonic treatment on germination of E.purpurea seeds under salt stress
2.2 超声波处理对盐胁迫下紫松果菊幼苗生长的影响
超声波处理盐胁迫下20 d 后紫松果菊幼苗生长情况见表3。未经超声波处理的UaS0、UaS1、UaS2,随着盐含量的升高紫松果菊幼苗地上干质量和根部干质量整体上显著降低(P<0.05),可见盐胁迫明显抑制了紫松果菊幼苗的生长。非盐胁迫下,经超声波处理的种子,其幼苗地上干质量整体上较空白对照显著增加(P<0.05)。在0.45% NaCl 溶液胁迫和超声波共同处理下,幼苗地上干质量和根干质量均随着超声波处理时长的增加而先升高后降低,均以25 min 超声波处理紫松果菊幼苗地上干质量和根干质量最大;幼苗的根冠比随着超声波时长的增加而逐渐降低。在0.90% NaCl 溶液胁迫和超声波共同处理下,幼苗地上干质量、根干质量和根冠比均随着超声波处理时长的增加而先升高后降低,均在25 min 超声波处理下达到最大值。另外,盐胁迫和超声波共同处理下幼苗的地上干质量和根干质量整体上高于对应的单独盐胁迫组。综上,盐胁迫下紫松果菊种子经超声波处理有助于增加幼苗的地上干质量和根干质量,且随着超声波处理时长的增加表现为先升高后降低趋势。可见,超声波处理在一定程度上能缓解盐胁迫对紫松果菊幼苗生长的抑制作用。
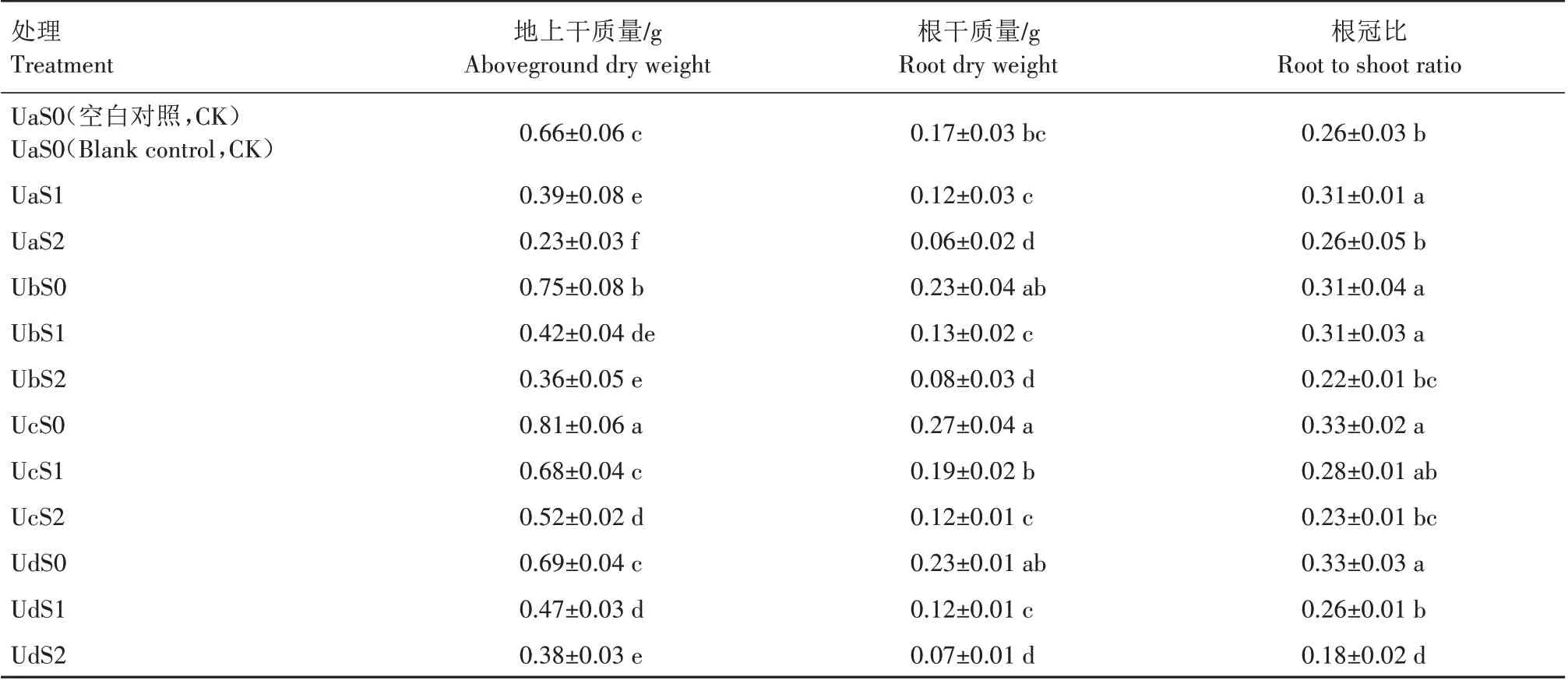
表3 超声波处理对盐胁迫20 d紫松果菊幼苗生长的影响Tab.3 Effect of ultrasound on the seedling growth of E.purpurea seedling under salt stress for 20 days
2.3 超声波处理对盐胁迫下紫松果菊幼苗抗氧化酶活性的影响
2.3.1 超声波处理对盐胁迫下紫松果菊幼苗SOD活性的影响 超声波处理对盐胁迫下紫松果菊幼苗抗氧化酶SOD 活性的影响见图1。紫松果菊幼苗在非盐胁迫下,超声波处理组中幼苗SOD 活性均显著高于空白对照(P<0.05),且SOD 活性随着超声波处理时长的增加先升高后降低。说明超声波处理种子有助于提高幼苗SOD 活性,但超声波处理时长过长时,会降低SOD 活性。紫松果菊幼苗在盐胁迫下,0.45%低盐胁迫组中SOD 活性均高于0.90%高盐胁迫组。以上说明,盐胁迫提高了紫松果菊幼苗叶片内SOD 活性,而当盐含量高于一定值时,SOD活性则下降。在盐胁迫处理第5、10、20 天时,5、25 min 处理组中的幼苗SOD 活性总体上均显著高于相同盐含量胁迫下的未经超声波处理组(P<0.05),且25 min 处理组中幼苗SOD 活性均高于相同盐胁迫下5 min 处理组;45 min 处理组中,随着盐含量的增高,SOD 活性下降。可见,适量的超声波处理种子,能提高幼苗SOD 活性,而长时超声波处理在一定程度上对幼苗SOD 活性带来了负影响。另外,5、25、45 min 处理组幼苗叶片内SOD 活性均随着盐胁迫时长的增加而呈现下降趋势。
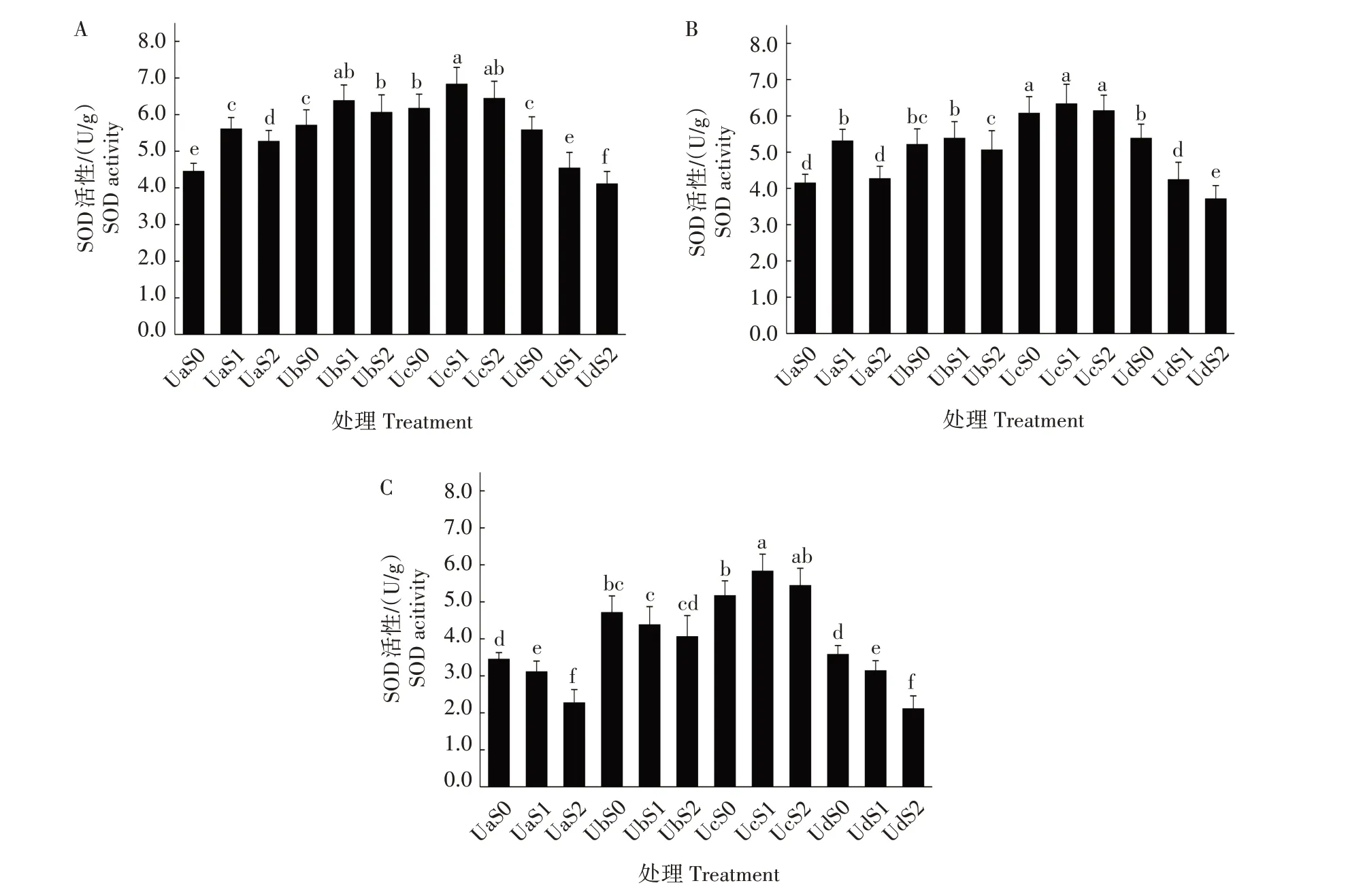
图1 超声波处理对盐胁迫下紫松果菊幼苗SOD活性的影响Fig.1 Effect of ultrasonic treatment on SOD enzyme activity of E.purpurea seedlings under salt stress
2.3.2 超声波处理对盐胁迫下紫松果菊幼苗CAT活性的影响 超声波处理对盐胁迫下紫松果菊幼苗抗氧化酶CAT活性的影响见图2。未经超声波处理组中,盐胁迫处理第5、10 天时,紫松果菊幼苗CAT 活性均随着盐胁迫含量的升高而升高;在胁迫处理的第20天时,低盐胁迫下的CAT活性显著高于空白对照和高盐胁迫处理;盐胁迫处理第10 天时,紫松果菊幼苗CAT 活性显著高于相同盐胁迫下第5、20 天。可见,随着盐胁迫时长的延长,未经超声波处理幼苗CAT 活性先升高后降低。在超声波处理组中,盐胁迫第5、10、20 天时,25 min 处理组中CAT 活性均显著高于相同盐胁迫下5、45 min 处理组(P<0.05)。这一结果与SOD 活性趋势相似,且随着胁迫天数的增加,紫松果菊幼苗CAT 活性呈现先升高后降低的趋势。
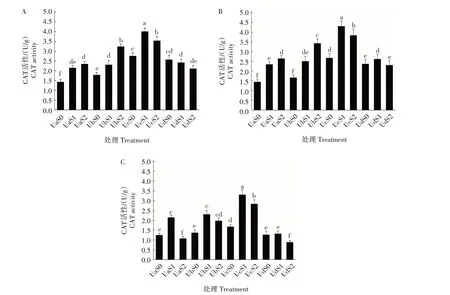
图2 超声波处理对盐胁迫下紫松果菊幼苗CAT活性的影响Fig.2 Effect of ultrasonic treatment on CAT enzyme activity of E.purpurea seedlings under salt stress
2.3.3 超声波处理对盐胁迫下紫松果菊幼苗POD活性的影响 超声波处理对盐胁迫下紫松果菊幼苗抗氧化酶POD活性的影响见图3。适量的超声波处理能提高幼苗POD 活性,而超声波处理时长超出一定范围后会抑制幼苗细胞内POD 活性,这一结果与其对SOD 活性影响的结果相同。不同含量盐胁迫条件下,未经超声波处理的幼苗在盐胁迫第5、10天时,其叶内POD 活性随着盐胁迫含量的升高而升高;在胁迫处理的第20 天时,叶内POD 活性随着盐胁迫含量的升高而降低。在超声波处理组中,盐胁迫处理第5、10天,25 min处理组中POD活性均显著高于相同盐胁迫条件下5、45 min 处理组(P<0.05),这一结果与SOD、CAT 活性趋势相似。盐胁迫处理第20 天时,5 min 处理组中POD 活性均显著高于相同盐胁迫条件下25、45 min 处理组(P<0.05)。综上,POD 活性与SOD、CAT 活性趋势一样,均随着盐胁迫天数的增加,紫松果菊幼苗POD 活性呈现先升高后降低的趋势。

图3 超声波处理对盐胁迫下紫松果菊幼苗POD活性的影响Fig.3 Effect of ultrasonic treatment on POD enzyme activity of E.purpurea seedlings under salt stress
2.3.4 超声波处理对盐胁迫下紫松果菊幼苗MDA含量的影响 超声波处理对盐胁迫下紫松果菊幼苗MDA 含量的影响见图4。紫松果菊在盐胁迫条件下,叶片内MDA 含量均随着盐含量的增加而增加,同时随着盐胁迫天数的增加而明显增加。可见,盐胁迫产生的逆境对紫松果菊幼苗生长发育产生了一定的负影响。紫松果菊种子在经过超声波处理后,幼苗体内MDA 含量出现了较大变化,5、25 min 处理组叶片内MDA 含量整体上较未经超声波处理组显著降低(P<0.05)。45 min 处理组中,低盐胁迫下第5、10 天时,幼苗体内MDA 含量与未经超声波处理低盐胁迫组相比无显著差异(P>0.05);而在第20 天时,低盐胁迫组幼苗MDA 含量则显著高于未经超声波处理低盐胁迫组(P<0.05);高盐胁迫下第5、10、20 天时的幼苗MDA 含量均显著高于其他组(P<0.05)。说明紫松果菊种子经适量超声波处理后可降低盐胁迫下幼苗叶片MDA含量,减轻细胞的脂质过氧化,缓解盐胁迫对紫松果菊生长的危害。
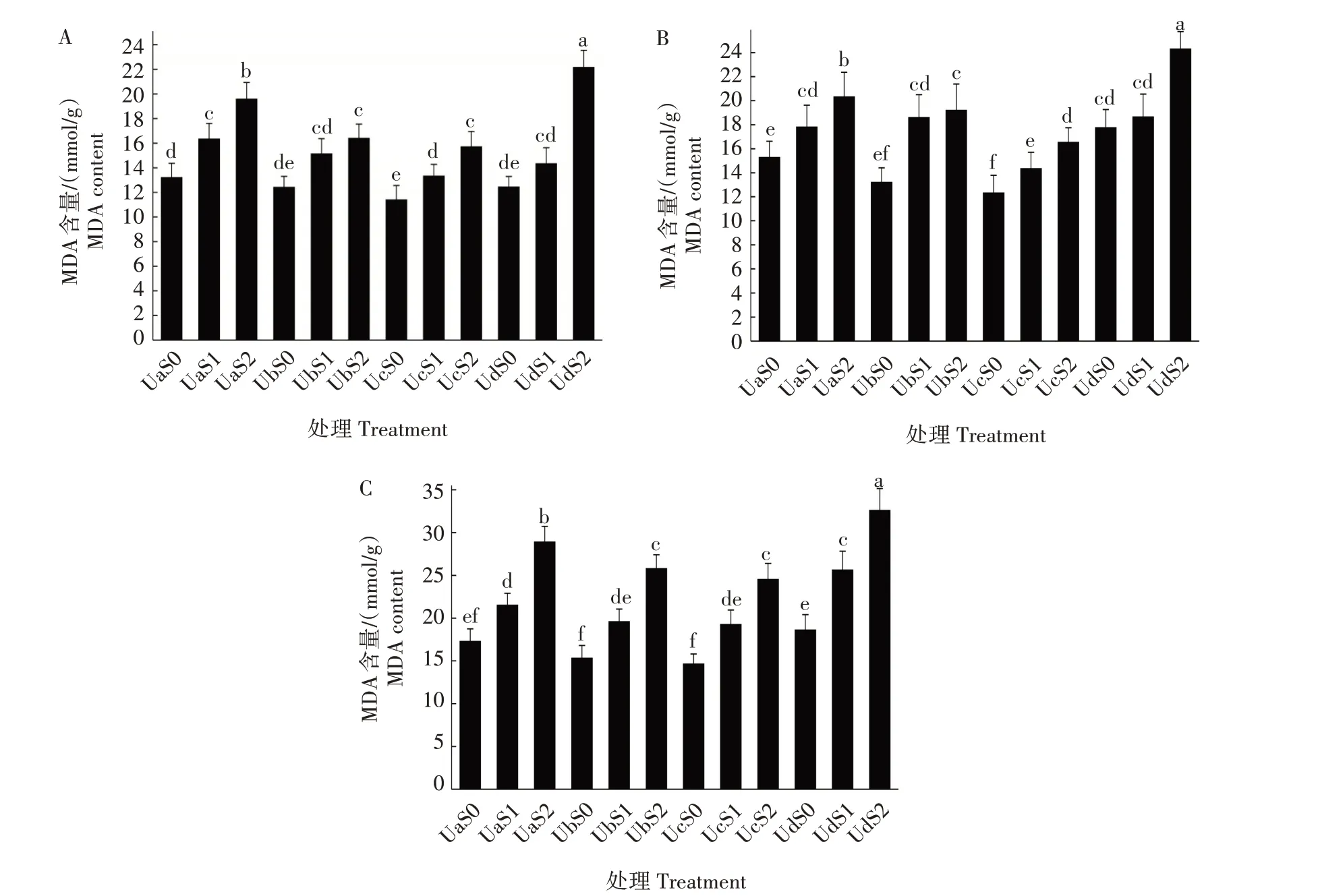
图4 超声波处理对盐胁迫下紫松果菊幼苗MDA含量的影响Fig.4 Effect of ultrasonic treatment on MDA content of E.purpurea seedlings under salt stress
2.4 超声波处理对盐胁迫下紫松果菊幼苗可溶性糖、可溶性蛋白和脯氨酸含量的影响
超声波处理对盐胁迫下紫松果菊幼苗根系渗透调节物质脯氨酸、可溶性糖和可溶性蛋白含量的影响见表4。由表4 可知,未经超声波处理组,紫松果菊幼苗根系脯氨酸、可溶性糖含量均随着盐胁迫程度的增加而显著增加(P<0.05),可溶性蛋白则随着盐胁迫程度的增加而显著降低(P<0.05)。非盐胁迫下,紫松果菊种子经5、25、45 min 超声波处理后,幼苗根系中脯氨酸、可溶性糖含量均随着超声波处理时长的增加而升高,而可溶性蛋白含量则随着超声波处理时长的增加而先升高后降低。低盐胁迫下,与0 min(UaS1)相比,5、25 min 超声波处理组脯氨酸含量分别降低了12.17%、27.23%,可溶性糖含量分别降低了20.33%、12.23%,45 min 超声波处理则分别提高了29.11%、29.60%,5、25、45 min 处理组可溶性蛋白含量则分别提高了40.42%、92.81%、47.10%;高盐胁迫下,与0 min(UaS2)相比,5、25 min 超声波处理组脯氨酸含量分别降低了14.65%、11.43%,可溶性糖含量分别降低了23.02%、12.75%,45 min 超声波处理则分别提高了17.55%、12.49%,5、25、45 min 处理组可溶性蛋白含量则分别提高了53.52%、87.83%、40.43%。可见,25 min 超声波处理对紫松果菊幼苗根系盐胁迫缓解作用较好。综上,超声波和盐胁迫处理均能提高紫松果菊幼苗根系可溶性糖、脯氨酸含量,可溶性蛋白含量随着超声波处理时长的增加而先升高后降低。说明在一定时长范围内超声波处理能提高幼苗根系可溶性蛋白含量,但超出一定时长范围后,幼苗根系可溶性蛋白含量开始降低。
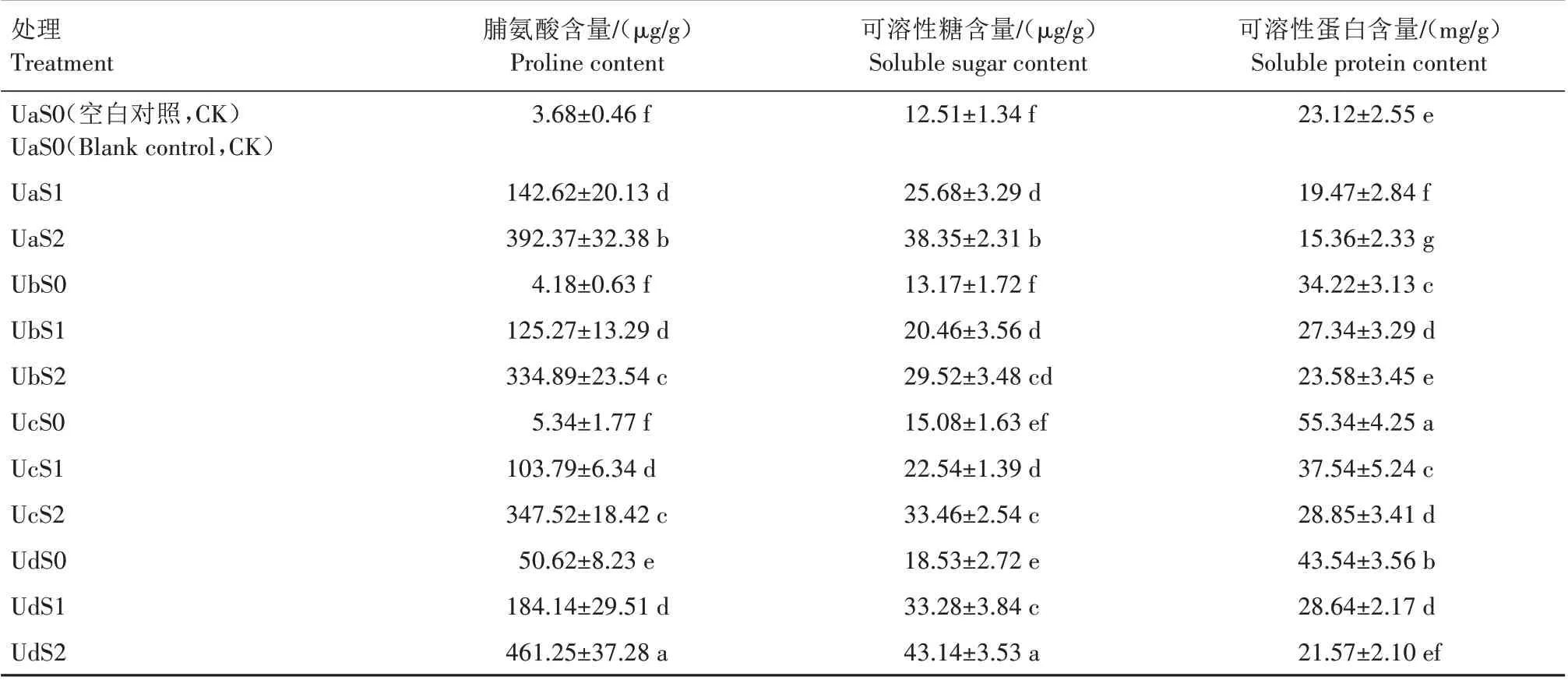
表4 超声波处理对盐胁迫下紫松果菊幼苗脯氨酸、可溶性糖和可溶性蛋白含量的影响Tab.4 Effect of ultrasonic treatment on the contents of proline,soluble sugar and soluble protein in E.purpurea seedlings under salt stress
3 结论与讨论
在植物的整个生长周期中,种子活力起着决定性作用[14],发芽势、发芽率、发芽指数和活力指数常被用来评价种子的活力变化。如果种子在萌发时期抵抗力弱,一旦环境对种子产生了逆境胁迫将会直接影响种子萌发和幼苗生长,最终导致植株生理和形态发生改变。对种子进行改良处理的目的是提高种子发芽率和增强抗性,以增强种子的活力,使植株健康生长。
盐胁迫对种子萌发的影响主要包括渗透效应与毒性效应2个方面:渗透效应使种子吸水下降,从而影响种子发芽;毒性效应则对细胞膜产生毒害,干扰代谢,从而影响种子萌发[18]。超声波是一种能被种子吸收的特殊能量,适量的超声波处理可有效刺激种子,提高发芽率和发芽势,有效缓解盐害作用,促进生长[19]。本研究中,盐胁迫对紫松果菊种子萌发具有明显的抑制作用,且随着盐含量的增加其发芽率、发芽势、发芽指数和活力指数降低,这与张红玲[15]的研究结果相似。在非盐胁迫处理下,种子经超声波处理后其发芽率、发芽势、发芽指数和活力指数均明显提高,同时还显著增加了幼苗的地上干质量和根干质量,并提高了根冠比,这一结果与MIRSHEKARI 等[20]、曹福麟等[21]的研究结果相似。说明超声波处理对幼苗生长有一定的促进作用。但随着超声波处理时长的增加,种子的发芽率、发芽势、发芽指数、活力指数及幼苗的地上干质量和根干质量等指标逐渐下降,说明短时超声波处理对幼苗有促进作用,而长时处理则表现出一定的抑制作用。这可能是超声波处理种子后使种子内部某些结构发生了一定变化,这种变化加快了种子内部的物质运输,从而提高了新陈代谢能力;但长时超声波处理,其所具有的强穿透性破坏了种子内部细胞膜的流动性,种子活力下降,从而导致后期幼苗生长异常[22]。
种子在逆境胁迫条件下,细胞内会产生大量的活性氧和自由基,从而使植物细胞膜产生脂质过氧化[23]。较多的研究表明,种子或植株经高盐胁迫会导致其细胞质渗透压发生显著变化,细胞膜的通透性增强,产生过多的活性氧使抗氧化酶防御体系被破坏,从而大大降低种子或植株的活力[23-24]。种子在经过超声波处理后,其耐受性得到提高的生理机制之一就是超声波提高了植物细胞内抗氧化酶的活性,降低了细胞的脂质过氧化程度,从而缓解了外界环境对其造成的胁迫[25]。种子经一定时长超声波处理后,可提高细胞活力,细胞内抗氧化酶活性被激活,加速细胞有丝分裂促使植物生长,从而提高植株的耐受性,缓解外界环境刺激[26];超声波处理时长过长时,会改变细胞膜的流动性,抑制细胞内抗氧化酶的活性,降低植株对外界环境耐受性[25]。本研究结果表明,在盐胁迫下,5、25、45 min 超声波处理组幼苗SOD 活性在第5、10、20 天时逐渐下降,CAT、POD 活性则先升高后降低;另外,在盐胁迫的第5、10 天时,25 min 处理组中的幼苗SOD、CAT、POD 活性均显著高于相同盐胁迫下5、45 min 处理组。可见,适量的超声波处理,能提高种子活力,而长时超声波处理在一定程度上对种子活力造成了负影响,表明种子经适量超声波处理有助于提高幼苗抗氧化酶活性。这可能是盐胁迫初期幼苗体内产生了较多的活性氧,为维持体内氧化还原系统平衡,细胞内抗氧化酶活性得到增强,种子通过适量超声波处理后,激活了种子内部抗氧化酶系统,使得幼苗抗氧化酶活性进一步增强。综上可知,紫松果菊种子经超声波处理可以通过增强体内抗氧化酶的活性来帮助消除活性氧,减轻细胞的脂质过氧化,缓解盐胁迫对植株的危害。这一研究结果与较多学者的研究结果相似,如CHEN 等[27]用超声波处理小麦种子后,CAT、SOD、谷胱甘肽酶(GSH)活性得到了显著提高;柳旭等[28]研究发现,自然老化的麦草种子经适宜时长超声波处理后显著提高了其抗氧化酶活性,同时降低了MDA 含量;王思蒙等[29]用超声波处理苦荞麦种子后,不仅促进了种子萌发,还提高了幼苗内抗氧化酶活性。
植物体内渗透调节物质的积累和释放也是适应逆境胁迫的重要生理机制[30]。植物在盐胁迫条件下体内会积累大量有机渗透调节物质,以此提高细胞质间渗透压,增强渗透调节能力,维持正常吸水和代谢活动[31]。脯氨酸、可溶性糖和可溶性蛋白均是植物体内重要的渗透调节物质,其在植物体内的含量变化可以衡量植物在逆境胁迫下组织和功能受损的程度[32]。本研究结果显示,盐胁迫下,紫松果菊在未经超声波处理的条件下,幼苗根系脯氨酸、可溶性糖含量均随着盐胁迫程度的增加而显著增加,可溶性蛋白则随着盐胁迫程度的增加而显著降低。这可能是盐胁迫对紫松果菊幼苗形成渗透胁迫,当盐含量增加时,渗透胁迫随之增强,幼苗根系通过积累脯氨酸、可溶性糖使得细胞液浓度迅速升高,更好地从外界环境中吸收水分维持体内生长平衡,从而提高紫松果菊的耐盐性。在种子经过5、25 min 超声波处理后,根系脯氨酸、可溶性糖含量相较未超声波处理组出现了不同程度的下降,45 min 处理则进一步提高了脯氨酸、可溶性糖含量。另外,种子经过5、25、45 min 超声波处理后,根系可溶性蛋白含量出现先升高后降低。由此可见,种子经过适量超声波处理后一定程度上能缓解根系的盐胁迫效应,且在25 min 超声波处理时效果较好。
综上,盐胁迫对紫松果菊种子萌发具有较强的抑制作用,盐含量越高其胁迫抑制作用越强,而将种子用适量的超声波处理后能显著提高其发芽率、发芽势、发芽指数、活力指数和幼苗的生物量。同时,一方面能提高幼苗叶片内抗氧化酶(SOD、POD、CAT)活性,降低MDA 含量;另一方面还能提高可溶性蛋白含量。表明适量的超声波处理对紫松果菊种子萌发和幼苗生长起着一定的促进作用。综合各项指标,对紫松果菊种子超声处理的最适宜时长为25 min。
