高迁移率族蛋白B1 在重型创伤性颅脑损伤患者肠黏膜屏障功能损伤发生机制中的作用研究
2022-09-28孙旭日赵彦萍刘霞吴玲唐恩波杜春红
孙旭日 赵彦萍 刘霞 吴玲 唐恩波 杜春红
创伤性颅脑损伤(traumatic brain injury,TBI)患者常合并肠黏膜屏障功能损伤,使得肠源性毒素和细菌易位,导致肠源性感染,诱发全身炎症反应,甚至导致多器官功能障碍[1-3],但TBI 出现肠黏膜屏障功能损伤的机制并未完全阐明。近年来研究发现[4-6],高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)在炎症反应中扮演着重要角色,其与肠黏膜屏障功能损伤的相关研究也逐渐引起关注。为此,本实验通过测定重型TBI 患者不同时间血HMGB1 水平及相关炎症反应指标、肠黏膜屏障功能指标,分析重型TBI 血HMGB1 水平与炎症反应指标及肠黏膜屏障功能指标的相关性,初步探讨HMGB1 在重型TBI 患者肠道黏膜屏障功能损伤发生机制中的作用。
1 资料与方法
1.1 一般资料 选取昌吉州中医医院2017 年9 月~2018 年8 月收治的30 例重型TBI 患者作为观察组,另选取同期30 例健康体检者作为对照组。观察组男17 例,女13 例;年龄28~77 岁,平均年龄(55.03±13.98)岁;格拉斯哥昏迷量表(GCS)评分3~8 分,平均GCS 评分(6.17±1.53)分。对照组男18 例,女12 例;年龄27~77 岁,平均年龄(53.67±15.23)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。所有研究对象临床资料完整。观察组纳入标准[7]:①经颅脑CT 证实为创伤性颅脑损伤;②年龄>20 岁;③入院前无感染征象;④单纯颅脑外伤(GCS 评分<9 分)。排除标准[8]:①严重复合伤患者;②入院前存在其他脏器衰竭;③有免疫缺陷疾病;④儿童和80 岁以上的老年患者。对照组纳入标准:年龄20~80 岁,无基础疾病。本项目经昌吉州中医医院伦理委员会同意,并征得患者家属及健康体检者知情同意。
1.2 方法 观察组在给予脱水降颅压、维持水电解质平衡等综合治疗期间采用GCS 评价昏迷严重程度,分别在伤后6、24、48 h 抽取外周静脉血标本3 ml。对照组于健康体检时抽血留取外周静脉血标本3 ml。血样标本分别转入生化管及去热源肝素化处理的内毒素专用试管,离心机3000 r/min 离心分离上清液,留取上清液-70℃保存备用,集中行ELISA 检测HMGB1、TNF-α、IL-1β、IL-6、DAO、D-Lac 及LPS 水平。主要试剂与仪器:人HMGB1、TNF-α、IL-1β、IL-6、DAO、D-Lac 及LPS 的ELISA 检测试剂盒(上海康朗生物公司提供)、酶联免疫反应加速仪(NY/MMJ)、MB580 酶标仪(Heales)、恒温水箱(WSZ-261-71)、离心机。根据上海康朗公司提供的ELISA 试剂盒说明书实验步骤进行,MB580 酶标仪(Heales)自动分析,读取检测结果。
1.3 观察指标 ①比较观察组伤后6 h 与对照组肠黏膜屏障功能指标(DAO、D-Lac 及LPS)及血清炎症反应指标(HMGB1、TNF-α、IL-1β、IL-6)。②比较观察组伤后6、24、48 h 肠黏膜屏障功能指标和血清炎症反应指标。③分析重型TBI 患者伤后6 h 血清HMGB1 与TNF-α、IL-1β 及IL-6 的相关性 。④分析重型TBI 患者伤后6 h 血清HMGB1 与DAO、D-Lac及LPS 的相关性。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t检验;计数资料以率(%)表示,采用χ2检验;相关性采用Pearson 相关检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 观察组伤后6 h 与对照组肠黏膜屏障功能指标比较 观察组伤后6 h DAO、D-Lac 及LPS 水平均高于对照组,差异具有统计学意义(P<0.05)。见表1。
表1 观察组伤后6 h 与对照组肠黏膜屏障功能指标比较()

表1 观察组伤后6 h 与对照组肠黏膜屏障功能指标比较()
注:与对照组比较,aP<0.05
2.2 观察组伤后6、24、48 h 肠黏膜屏障功能指标比较 观察组伤后24 及48 h DAO、D-Lac、LPS 水平均高于伤后6 h,差异具有统计学意义(P<0.05);观察组伤后24 h 与48 h DAO、D-Lac、LPS 水平比较,差异无统计学意义(P>0.05)。见表2。
表2 观察组伤后6、24、48 h 肠黏膜屏障功能指标比较(,n=30)

表2 观察组伤后6、24、48 h 肠黏膜屏障功能指标比较(,n=30)
注:与伤后6 h 比较,aP<0.05
2.3 观察组伤后6 h 与对照组血清炎症反应指标比较观察组伤后6 h HMGB1、TNF-α、IL-1β 及IL-6 水平均高于对照组,差异具有统计学意义(P<0.05)。见表3。
表3 观察组伤后6 h 与对照组血清炎症反应指标比较()

表3 观察组伤后6 h 与对照组血清炎症反应指标比较()
注:与对照组比较,aP<0.05
2.4 观察组伤后6、24、48 h 血清炎症反应指标比较观察组伤后24 及48 h HMGB1、TNF-α、IL-1β、IL-6水平均高于伤后6 h,差异具有统计学意义(P<0.05);观察组伤后24 h 与48 h HMGB1、TNF-α、IL-1β、IL-6水平比较,差异无统计学意义(P>0.05)。见表4。
表4 观察组伤后6、24、48 h 血清炎症反应指标比较(,n=30)
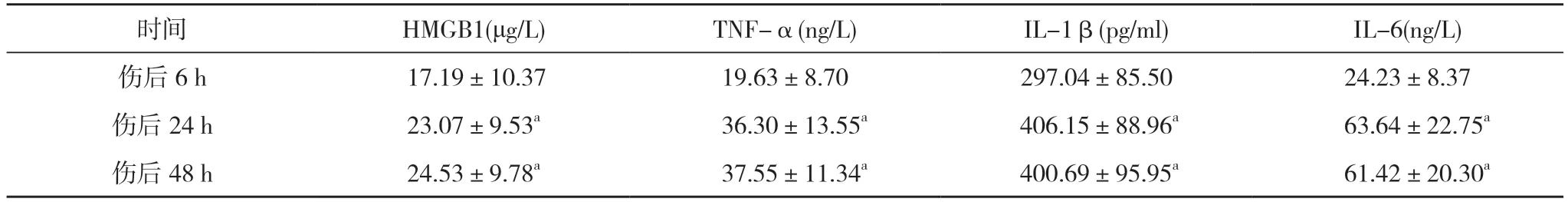
表4 观察组伤后6、24、48 h 血清炎症反应指标比较(,n=30)
注:与伤后6 h 比较,aP<0.05
2.5 重型TBI 患者伤后6 h 血清HMGB1 与TNF-α、IL-1β 及IL-6 的相关性分析 重型TBI 患者伤后6 h血清HMGB1 与TNF-α 呈正相关(r=0.597,P<0.05)(见图1),与IL-1β 无相关性(r=0.210,P>0.05)(见图2),与IL-6 呈正相关(r=0.651,P<0.05)(见图3)。
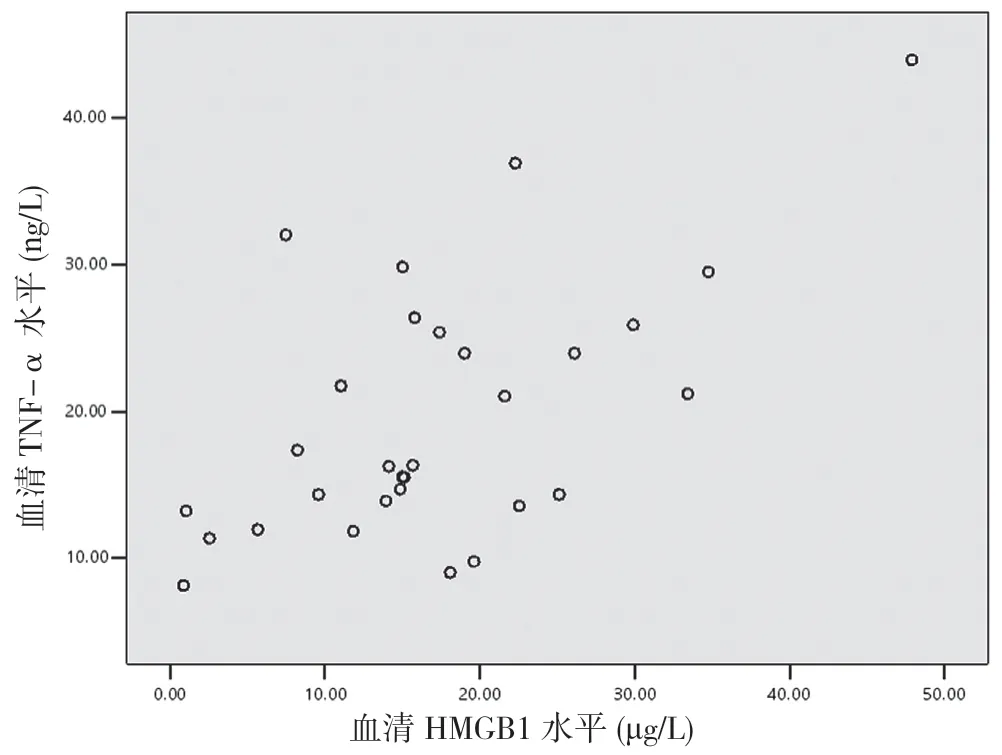
图1 重型TBI 患者血清HMGB1 水平与TNF-α 相关性分析
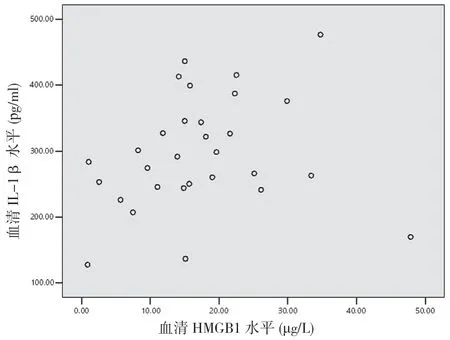
图2 重型TBI 患者血清HMGB1 水平与IL-1β 相关性分析
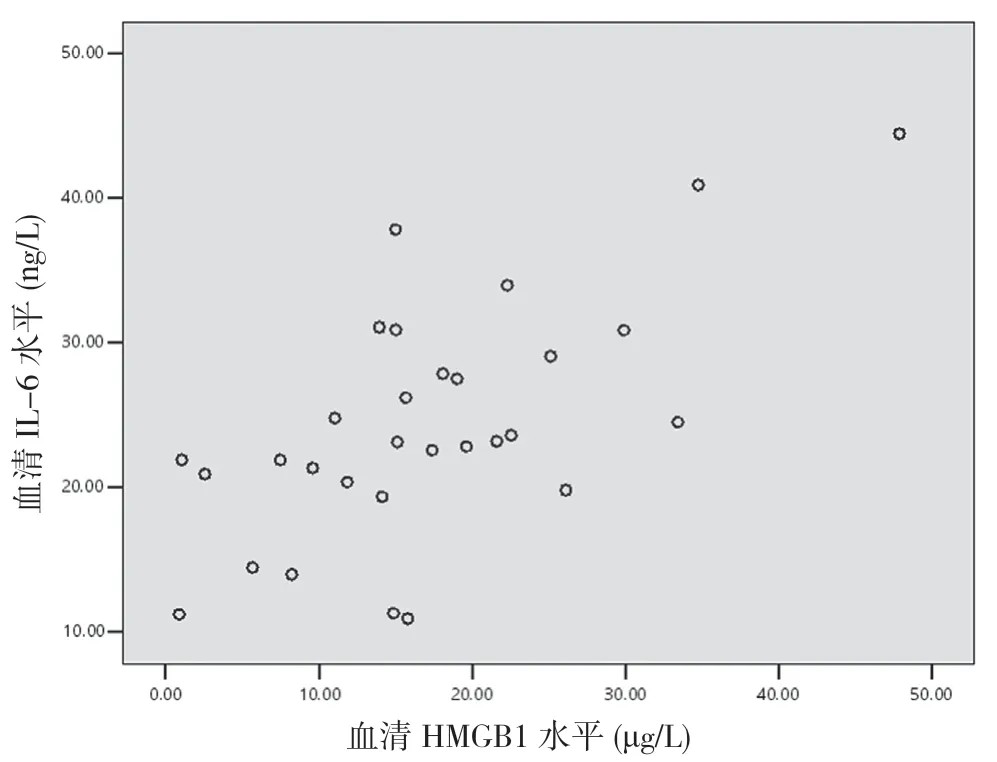
图3 重型TBI 患者血清HMGB1 水平与IL-6 相关性分析
2.6 重型TBI 患者伤后6 h 血清HMGB1 与DAO、D-Lac 及LPS 的相关性分析 重型TBI 患者伤后6 h血清HMGB1与DAO呈正相关(r=0.488,P<0.05)(见图4),与D-Lac 呈正相关(r=0.407,P<0.05)(见图5),与LPS呈正相关(r=0.466,P<0.05)(见图6)。
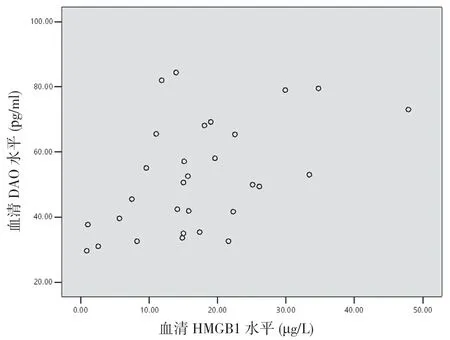
图4 重型TBI 患者血清HMGB1 水平与DAO 相关性分析
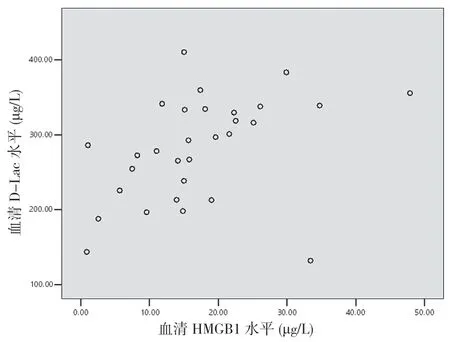
图5 重型TBI 患者血清HMGB1 水平与D-Lac 相关性分析
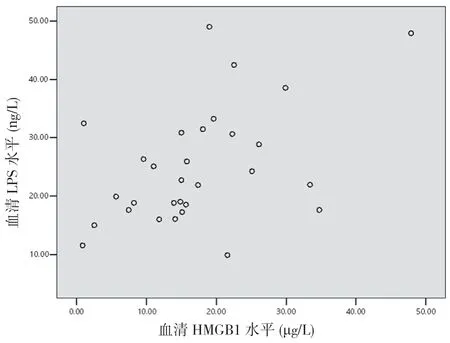
图6 重型TBI 患者血清HMGB1 水平与LPS 相关性分析
3 讨论
TBI 患者常合并肠黏膜屏障功能损伤,其损伤机制尚未完全阐明,因此TBI 合并肠黏膜屏障功能损伤的发病机制成为当今的研究热点[9]。肠黏膜屏障功能损伤可以从肠道组织形态学检查进行反应,但临床上获取肠道黏膜组织标本存在较大困难,因此更多的是从血清学上评价肠黏膜屏障功能完整性,常采用DAO、D-Lac 和LPS 间接评估肠道黏膜屏障功能的损伤严重程度[10-13]。本研究结果显示,重型TBI 患者在伤后6 h即出现血清DAO、D-Lac、LPS持续升高,在24 h达峰值,维持至伤后48 h 仍无明显下降趋势,该现象说明重型TBI 患者在伤后早期即可出现肠黏膜屏障功能损伤,而且能持续较长时间。
近年研究发现,HMGB1 具有强大的促炎作用,是器官损伤的关键介质之一[14]。在本实验中,重型TBI患者在伤后6 h 的炎症反应指标中HMGB1、TNF-α、IL-1β 及IL-6 较健康体检者均有不同程度的升高,差异有统计学意义(P<0.05)。由此说明重型TBI 患者伤后即出现炎症反应。分析这些炎症反应指标在伤后6、24 及48 h 时间点的变化,发现重型TBI 患者炎症反应早期即出现逐渐加重,在伤后24 h 可以达峰值,而且持续至伤后48 h 仍无下降趋势。重型TBI 患者伤后炎症反应指标的变化与肠道黏膜屏障功能损伤指标的变化具有一致性,因此推测炎症反应可能介导了重型TBI患者肠道黏膜屏障功能的损伤[15,16]。这与国内庞永斌等[17]报道,一组106 例急性重度闭合性颅脑损伤患者中存在血清HMGB1、TNF-α 和IL-6 高表达水平的情况相一致。
HMGB1 作为炎症反应的核心因子,其与肠黏膜屏障损伤的相关研究方面也逐渐引起关注。研究[18]发现,HMGB1 在急性重症胰腺炎患者中的表达水平明显高于健康对照组,而且与肠道黏膜通透性指标DAO、LPS 呈正相关,该研究发现循环HMGB1 与肠屏障功能障碍的严重程度相关,为HMGB1 可能是引起小肠黏膜屏障损伤的关键因素提供了直接证据。在本次实验中,重型TBI 患者伤后6 h 血清HMGB1 水平与肠道黏膜屏障功能指标DAO、D-Lac、LPS 呈正相关,说明HMGB1 可能与重型TBI 患者肠道黏膜屏障功能损伤具有紧密联系。进而本课题组分析了重型TBI 患者伤后6 h 血清HMGB1 与血清TNF-α、IL-1β 及IL-6 的相关性,相关性检验发现HMGB1 与血清TNF-α、IL-6呈正相关。研究结果也说明了HMGB1参与了炎症反应,可能是非常重要的炎症介质,触发炎症反应,最终导致肠黏膜屏障功能损伤。文献报道[19]能解释本课题组的结果,在机体损伤时应激反应所产生的致炎因子与细胞膜表面相应受体结合,触发细胞内HMGB1 的合成和释放,HMGB1 可与晚期糖基化终产物受体(RAGE)和Toll 样受体4 相结合激活核因子-kB 信号转导途径,并产生大量炎症因子,包含IL-1β、TNF-α 和IL-6 等,导致炎症反应,炎症因子又反过来促进HMGB1的分泌,其形成了一个正反馈,启动炎症级联反应。
综上所述,重型TBI 患者在伤后早期即出现炎症反应和肠黏膜屏障功能损伤,炎症反应可能参与了肠黏膜屏障功能损伤的发生机制,而HMGB1 可能在炎症反应介导的肠黏膜屏障功能损伤发生过程中发挥着重要作用。当然,HMGB1 如何介导炎症反应参与重型TBI 患者肠道黏膜屏障功能还需要动物实验及临床实验来进一步阐明。
