水杨酸对干旱胁迫下凤仙花生长、生理特性及相关基因表达的影响
2022-09-23王梦雨
沈 昀, 马 甜, 王梦雨
(江苏农牧科技职业学院,江苏泰州 225300)

水杨酸(SA)是植物体内含量最多且作用最广的激素之一,参与许多植物生理和发育代谢过程,包括植物病原体防御反应和对非生物胁迫的调控,因此SA通常用作外源植物激素/植物生长调节剂。一些证据证明,即使在低浓度下,SA对增强抗氧化系统同样具备高效的功能。非生物胁迫下SA可刺激植物HO合成,进而诱导基因相关抗氧化酶的表达,提高植物中SOD、过氧化物酶(POD)和CAT等抗氧化酶的活性,最终上调植物相关防御基因表达以缓解应激反应带来的损伤。同时,SA的应用可降低膜脂过氧化产物MDA的积累和叶膜通透性。迄今为止,多项研究报告了非生物胁迫下外源SA应用对植物调节作用的影响,发现其效果取决于应用方法(如喷叶、浸种、茎注、根施)、时间、外源和内源SA水平、胁迫因子、植物种类以及发育阶段。凤仙花()是广泛分布于亚洲与非洲的重要园艺植物,因叶子多肉、花色多样及次生代谢旺盛,因此具有较好的观赏及药用价值,然而在种植、运输及应用过程中易受到干旱和高温等影响,且凤仙花对干旱反应极为敏感,当水分供应不足时植株枯萎迅速。目前,关于干旱胁迫对凤仙花生理及生化反应的研究较少,对应用水杨酸的耐旱机制亦知之甚少。基于此,本研究探索了水杨酸不同用量对不同干旱程度下凤仙花生理代谢及相关基因表达的影响。研究结果有助于为水杨酸应用于干旱胁迫提供理论支持。
1 材料与方法
1.1 供试地点与供试材料
试验于2021年6—8月在江苏农牧科技职业学院温室中进行。空气相对湿度为75%,温度为18~28 ℃。凤仙花植物来自江苏省沐阳县九洲苗木场。水杨酸[SA,2-(HO)CHCOH]购自Sigma-Aldrich化工试剂公司。供试培养基质为泥炭、珍珠岩、蛭石按体积比2 ∶1 ∶1复配而成。
1.2 试验试剂与仪器
(1)仪器:AKF-IS2020V型水分仪,购自上海禾工科学仪器有限公司;UV-1800紫外分光光度计,购自上海美谱达仪器有限公司;TP-PW-Ⅱ自动植物水势仪(数显式),购自浙江托普云农科技股份有限公司;Nanodrop 2000分光光度计,购自美国赛默飞世尔科技公司。(2)试剂:A003-3-1丙二醛试剂盒、A107-1-1脯氨酸试剂盒、A064-1-1过氧化氢试剂盒、A001-4-1超氧化物歧化酶试剂盒、A123-1-1过氧化氢酶试剂盒、抗坏血酸过氧化物酶(APX)试剂盒,均购自南京建成生物工程研究所;OMEGA BS8231450植物DNA提取试剂盒,购自天根生化科技(北京)有限公司;PrimerScript RT试剂盒,购自日本TaKaRa生物试剂公司。
1.3 试验设计
试验采用完全随机设计,设置3个水杨酸处理(SA):0、1、2 mmol/L,分别记为SA0、SA1、SA2,3个基质含水率处理(WW):95%、75%、55%,分别对应为水分充沛、轻度干旱和中度干旱,分别记为WW95、WW75、WW55,共9个组合处理。各处理重复3次。盆栽器具采用塑料圆桶,每盆装培养基质3 kg,将各处理的1株凤仙花小植株移入桶中,采用配备时域反射计(TDR)的水分仪保持相应处理基质含水率。SA处理为每周进行10 mL药液的叶片喷施。期间及时补充培养基质水分并记录用水量,凤仙花培育75 d。
1.4 样品采集及测定分析
1.4.1 凤仙花生长参数测定 凤仙花生长参数包括株高、有效叶数、叶面积、茎粗、根长、根体积及干物质。株高、有效叶数、叶面积、茎粗、根长采用数字尺测定,鲜质量采用电子天平称量,叶面积=长×宽×0.643 5,根体积采用排水法测定。以上农艺性状测定完毕后将凤仙花植株105 ℃杀青 30 min,65 ℃烘干至恒质量,记录干物质累积量。
1.4.2 光合色素含量及植株水分利用测定 光合色素含量测定:选取第6张(从上往下数)完全展开叶测定光合色素含量,光合色素包含叶绿素a、叶绿素b及类胡萝卜素,三者皆采用丙酮-乙醇混合浸提,采用紫外分光光度计分别在665、649、470 nm处测定,具体步骤参照李合生的方法。
凤仙花植株的叶片水势()采用TP-PW-Ⅱ自动植物水势仪(数显式)测定。植株水分利用效率(WUE)=DW/用水量,式中:DW代表干质量;植株相对含水量(RWC)采用烘干称质量法测定,RWC=(FW-DW)/(TW-DW)×100%,式中:FW、DW、TW分别为鲜质量、干质量、膨压质量。
1.4.3 植株渗透物质及氧化酶活性测定 凤仙花的丙二醛、脯氨酸、过氧化氢含量及超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶活性均采用南京建成生物工程研究所生产的相应试剂盒测定。
1.4.4 脯氨酸合成基因相对表达水平测定 采用植物DNA提取试剂盒对凤仙花进行基因组总RNA的提取。通过在0.7%琼脂糖凝胶上电泳并使用Nanodrop 2000分光光度计评估总RNA的浓度和质量。第1链cDNA合成参照PrimerScript RT试剂盒说明书进行。借助Primer Express 3软件设计扩增引物(表1),以肌动蛋白基因()为内标进行qRT-PCR分析。使用SYBR Premix ExⅡ (TliRNaseH Plus;TaKaRa生物公司,日本)在主循环仪系统(ABI,生物系统,美国)上进行qRT-PCR分析。反应程序、反应条件及反应体系参照Safari等所述。实时定量试验结果采用2-ΔΔ算法进行相对表达水平计算。

表1 脯氨酸合成基因的qRT-PCR引物序列信息
1.5 数据处理与统计分析
采用Excel2016进行数据整理,采用SPSS19.0软件进行单因素方差分析(ANOVA),采用邓肯氏多重比较进行统计分析(=0.05),采用Origin 8.5进行图形绘制。
2 结果与分析
2.1 干旱胁迫下水杨酸对凤仙花生长的影响
由表2可知,不同基质含水率处理(WW)在地上部生长参数(株高、有效叶数、叶面积、茎粗、地上部干质量)、根系生长参数(根长、根体积、根系干质量)的规律基本一致,即同一水杨酸浓度处理(SA)下,随着基质含水率的降低,地上部、根系生长参数随之降低。而同一基质含水率处理下,不同水杨酸浓度处理在不同生长参数指标中表现不一。特别地,在上述生长参数中,整体皆以水杨酸处理(SA1、SA2)下的WW95处理生长最佳,在株高、有效叶数及根长中,最大值皆为SA1-WW95处理,而在叶面积、茎粗、根体积、地上部干质量、根系干质量中,峰值皆出现在SA2-WW95处理,而在干旱胁迫处理(WW75、WW55)中,整体而言,以水杨酸处理(SA1、SA2)的生长参数数值大于无水杨酸处理(SA0)。在株高、有效叶数及根长中,其他处理较SA1-WW95处理分别降低3.38%~45.57%、5.32%~77.43%及10.46%~23.38%;在叶面积、茎粗、根体积、地上部干质量及根系干质量中,其他处理较SA2-WW95处理分别降低35.08%~66.42%、3.35%~54.24%、12.66%~82.76%、15.45%~83.96%及10.42%~79.17%。
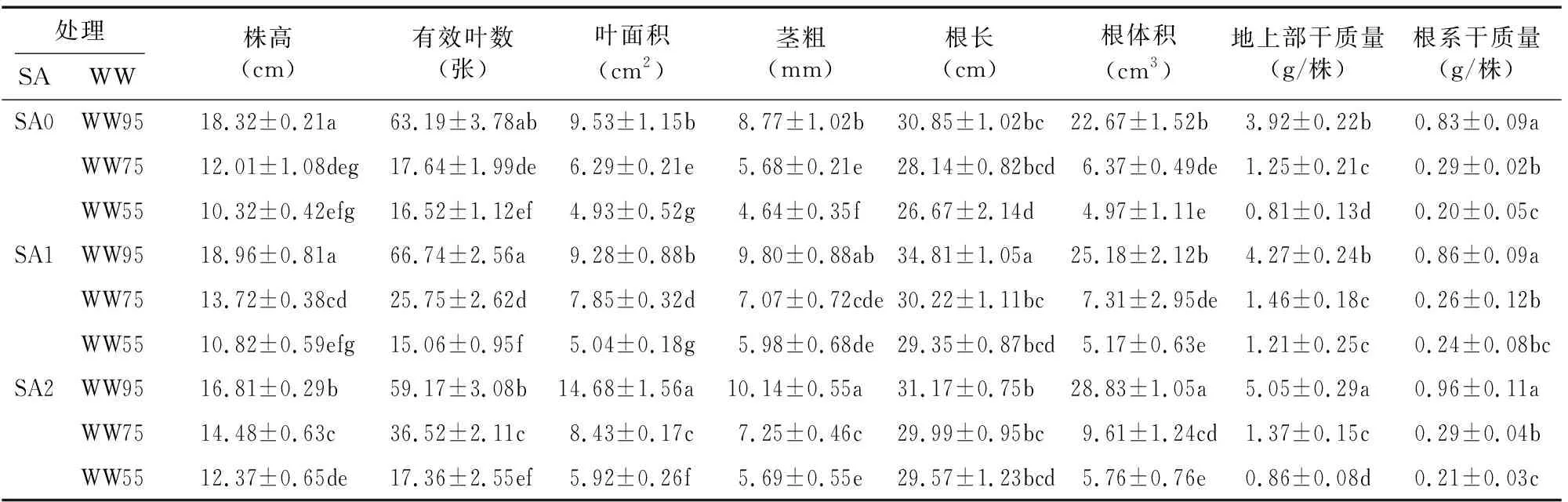
表2 干旱胁迫下水杨酸对凤仙花生长参数的影响
2.2 干旱胁迫下水杨酸对凤仙花水分利用及光合色素含量的影响
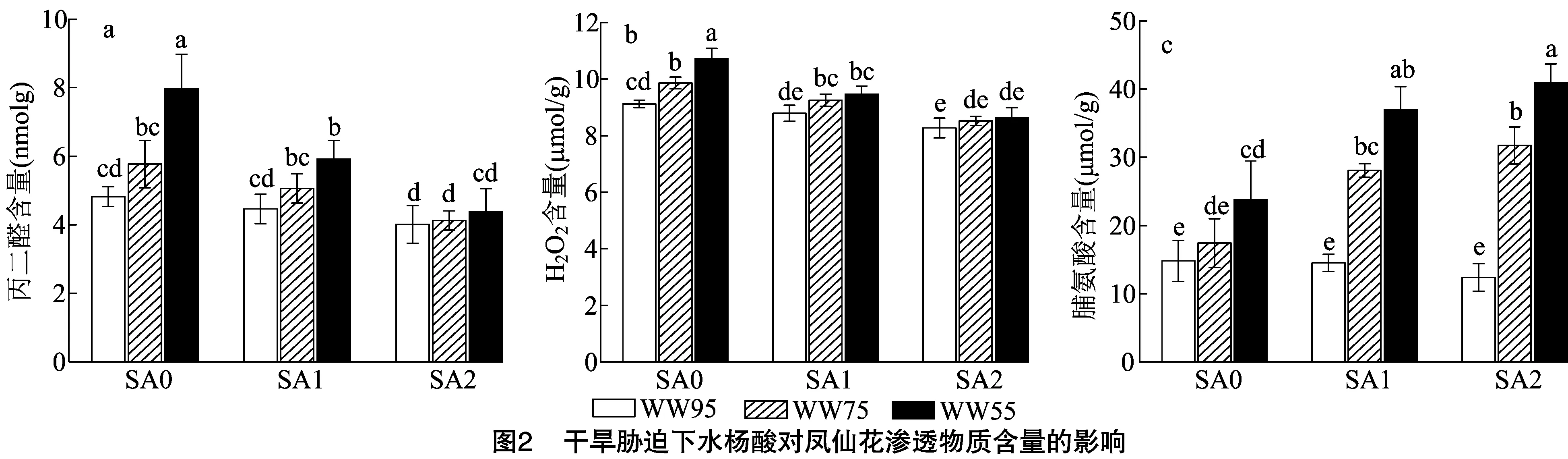
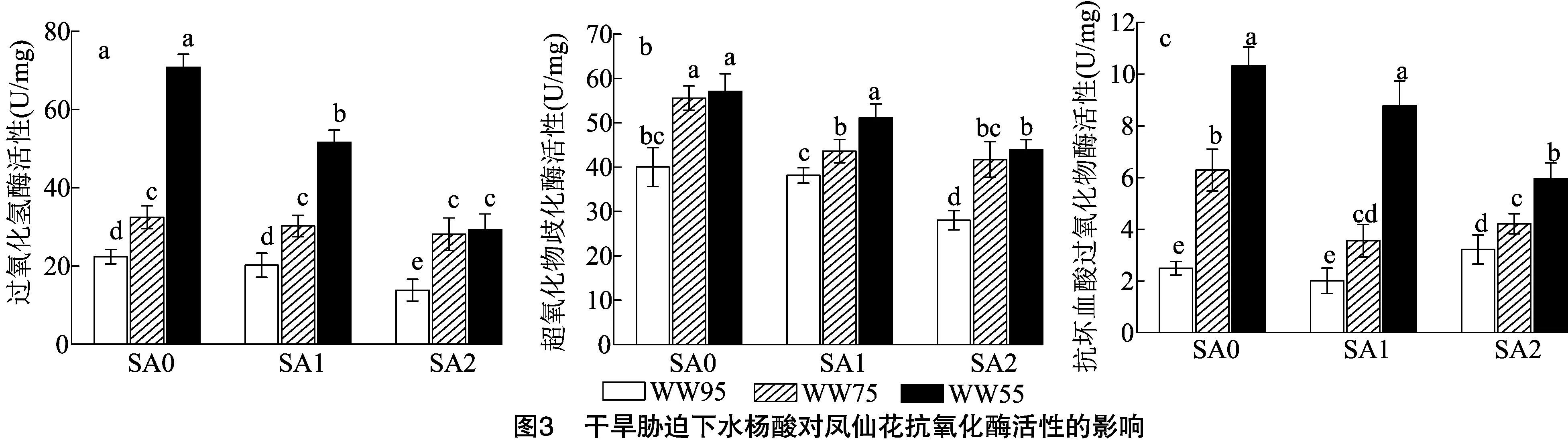
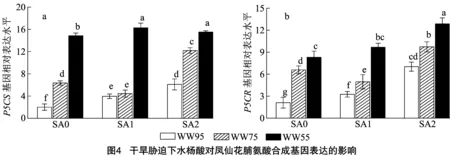
由图1-a可知,在凤仙花光合色素(叶绿素a、叶绿素b、类胡萝卜素)中,各色素含量呈叶绿素a>叶绿素b>类胡萝卜素。在SA与WW的组合处理中,当水杨酸浓度一定时,随着基质含水率降低,上述光合色素含量均呈降低趋势;相反地,当培养基质含水率不变时,随着水杨酸浓度增加,上述光合色素含量均呈升高趋势。此外,皆以SA2-WW95处理的叶绿素a、叶绿素b、类胡萝卜素含量最高。由图1-b可知,在凤仙花水分利用效率中,同一水杨酸浓度处理下,随着基质含水率降低,WUE呈显著降低趋势,同一培养基质含水率处理下,随着水杨酸浓度增加,WUE呈升高趋势,且相应基质含水率的SA2处理皆显著大于SA0处理。由图1-c可知,在凤仙花相对含水率中,当水杨酸浓度处理一定时,随着基质含水率降低,RWC呈降低趋势,均表现为WW95屯WW75处理无显著差异,但WW95处理显著大于WW55处理,且就WW55处理而言,以SA1、SA2处理显著大于SA0处理。由图1-d可知,在凤仙花叶水势中,SA0处理下,基质含水率处理间呈WW95>WW75>WW55;在SA1、SA2处理中,则皆呈WW55 由图2-a可知,在凤仙花丙二醛含量中,随着水杨酸浓度水平提高,MDA含量整体呈下降趋势,且SA处理(SA0、SA1、SA2)下,基质含水率处理均呈WW95 由图3-a、图3-b可知,各处理的过氧化氢酶、超氧化物歧化酶活性规律基本一致,SA处理不变条件下,基质含水率处理(WW)表现为WW95 由图4-a可知,在Δ1-吡咯啉-5-羧酸合成酶基因()中,SA0、SA1、SA2条件下皆以WW55处理显著高于WW75和WW95处理,其中在SA0处理中WW95、WW75处理较WW55处理分别显著降低86.46%、57.14%,同理,在SA1处理中分别显著降低75.66%、72.65%,在SA2处理中分别显著降低60.76%、21.52%;整体来看,以SA1-WW55处理相对表达水平最高,除与SA2-WW55处理无显著差异外皆显著大于余下处理。由图4-b可知,脯氨酸还原酶基因()中,随着水杨酸施用水平增加,表达水平整体呈增加趋势,且任一SA水平处理中,基质含水率处理均表现为WW55>WW75>WW95,且两两处理间均差异显著;此外,整体来看,以SA2-WW55处理表达水平最高,余下处理较其显著降低24.40%~83.61%。 干旱胁迫是植物面临的主要非生物胁迫之一,干旱会抑制植株的生长、生理代谢及产量形成。水杨酸是植物莽草酸代谢途径中的酚酸物质,对植株生长发育、开花及信号传导等一系列生理生化过程具有显著影响。本研究中,生长参数(株高、有效叶数、叶面积、茎粗、根长、根体积、地上部干质量、根系干质量)及光合色素(叶绿数a、叶绿数b、类胡萝卜素)中,任一水杨酸浓度处理下,随着基质含水率降低,生长参数、光合色素随之降低,即表现为WW95>WW75>WW55,参数峰值均出现在WW95处理;表明随着干旱程度加剧,植株长势受到严重影响。此外,就试验数据来看,干旱胁迫处理(WW75、WW55)下,整体皆以SA1、SA2处理的长势参数大于SA0处理,且整体来看SA2处理长势优于SA1处理。 植株水分利用强度是反映植物水分状况和脱水生理的重要表征,且植株含水量可一定程度上反映植物细胞活力。本研究中,各处理凤仙花水分利用效率及水分相对含量规律基本一致,即WW处理中均呈WW95>WW75>WW55,SA处理中表现为SA2、SA1>SA0;且整体来看,同一基质含水率条件下,SA2处理在上述2个指标皆显著大于SA0处理(<0.05)。前人研究表明,外源施用水杨酸可有效提高苜蓿的相对含水量,维持植株生长。本研究结果与前人研究结论基本一致,这可能是由于外源水杨酸为信号小分子物质,可介导气孔关闭,从而重分配水分及维持植株含水量的缘故。干旱条件下维持较高叶水势的能力是植物抗旱性的重要机制。本研究中,SA0处理下,随着基质含水率降低,叶水势随之减小,而在SA1、SA2处理下,皆以WW75处理水势最大,这从侧面说明,当轻度干旱胁迫处理下,外源喷施水杨酸是较为理想的抗旱策略。 干旱胁迫会破坏电子传递链,导致叶绿体、线粒体、过氧化物酶体以及质膜中电子传递副产物ROS含量增加,积累的ROS会损害蛋白质、核酸、膜脂和其他细胞成分,从而导致氧化应激。本研究中,与WW95处理相比,WW75和WW55处理的MDA和HO含量更高,表明轻度、中度干旱皆对凤仙花造成了过氧脂质损伤。进一步研究表明,各处理CAT、SOD、APX活性与MDA、HO含量呈相同趋势,且随着水杨酸施用水平升高,抗氧化系统相关酶活性随之降低。这意味着干旱条件下,SA可调节抗氧化酶活性从而降低凤仙花植株的ROS累积及膜脂过氧化损伤,这与相关研究结果趋于一致。 为了应对水分不足,植物细胞可以通过生物合成和积累相容溶质(如脯氨酸)来降低其渗透势并保持细胞膨压,脯氨酸的生物合成涉及谷氨酸(Glu)和鸟氨酸(Orn)途径。谷氨酸可以通过Δ1-吡咯啉-5-羧酸合成酶还原为谷氨酸-半醛,并自发地转化为Δ1-吡咯啉-5-羧酸,然后被Δ1-吡咯啉-5-羧酸还原为脯氨酸还原酶。本研究中,各处理的Pro含量与抗氧化酶(CAT、SOD、APX)活性规律呈相反趋势,SA的外源应用刺激了干旱胁迫植物中脯氨酸的积累,尤其表现在中等干旱程度处理(WW55)。在脯氨酸合成的2个酶基因(、)中,随着干旱程度加剧,、被诱导上调表达,且同一干旱程度水平下,SA处理(SA1、SA2)整体大于SA0处理,尤其表现在SA2处理。再次表明高水平的水杨酸施用处理效果较优。综上,干旱胁迫下外源叶施水杨酸可有效改善凤仙花的生长发育,保护光合膜和色素防止叶绿素降解。此外可提高抗氧化酶活性,上调、基因表达从而提高脯氨酸含量,减少干旱胁迫导致脂质过氧化和氧化损伤。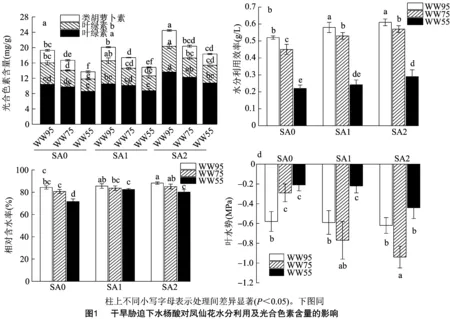
2.3 干旱胁迫下水杨酸对凤仙花渗透物质含量的影响
2.4 干旱胁迫下水杨酸对凤仙花抗氧化酶活性的影响
2.5 干旱胁迫下水杨酸对凤仙花脯氨酸合成基因表达的影响
3 讨论与结论
