甜菜夜蛾U6 snRNA的克隆及其表达稳定性分析
2022-09-23刘志成张钧博吴庆珊翁庆北
刘志成, 张钧博, 方 正, 吴庆珊, 翁庆北,2
(1.贵州师范大学生命科学学院,贵州贵阳 550001; 2.黔南民族师范学院,贵州都匀 558000)
在真核生物基因转录后加工过程中,核内小RNA(small nuclear RNA,snRNA)通过与剪接体蛋白组装成主要剪接体(major spliceosome)和次要剪接体(minor spliceosome),在该过程中发挥着重要的作用。snRNA作为真核生物主要剪接体的重要组分,其结构高度动态,形成主要剪接体的大部分催化核心,通过与其他snRNA、前mRNA底物(pre-mRNA)和超过25个蛋白质伴侣有序的相互作用,保证mRNA剪接过程的顺利进行。
研究基因和microRNA(miRNA)在特定条件下的表达是挖掘它们生物学功能的重要手段之一。反转录定量PCR(reverse transcription-quantitative PCR,RT-qPCR)作为一种常用的基因表达检测方法也广泛应用于鉴定各物种miRNA的表达。在RT-qPCR试验中,为了校正试验过程中由于RNA质量、反转录效率和PCR酶扩增效率等因素造成的试验误差,通常使用肌动蛋白基因()、甘油醛-3-磷酸脱氢酶基因()和18S rRNA基因等表达稳定的管家基因作为内参基因。但由于这些基因远大于miRNA,不适合作为miRNA RT-qPCR检测的内参基因。已有报道表明,snRNA在不同物种中十分保守,序列较小,且在生物体内各种细胞中的表达水平相对稳定,因而被广泛用于各物种miRNA RT-qPCR的内参基因。
甜菜夜蛾()属于鳞翅目(Lepidoptera)夜蛾科(Noctuidae)昆虫,作为一种杂食性害虫,可危害茄果类、瓜类、绿叶菜类等超过80多种农作物,具有食量大、破坏性强、繁殖速度快等特点,对每年世界各地农业生产造成重大损失。对甜菜夜蛾生长发育机制和病原免疫机制的了解对开发有效的甜菜夜蛾防治措施具有重要意义。近年来,许多研究发现miRNA通过调节靶基因的表达影响昆虫的生长发育和病毒-宿主相互作用。因此,研究miRNA在甜菜夜蛾生长发育和抗杆状病毒机制中的作用对该害虫的防治具有重要意义。目前已报道多种昆虫miRNA的表达研究中使用snRNA作为内参基因。但迄今,甜菜夜蛾的snRNA序列及其作为内参基因的研究尚未见报道。
本研究从Se301细胞基因组的测序注释数据中筛选甜菜夜蛾snRNA,克隆其全长序列,并进行系统进化分析。进一步地分析除虫菊提取物、高温培养和甜菜夜蛾核型多角体病毒(multiple nucleopolyhedrovirus,SeMNPV)感染胁迫下snRNA的表达稳定性。本研究旨在为甜菜夜蛾miRNA表达检测时内参基因的选择提供了依据,为甜菜夜蛾miRNA功能研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 甜菜夜蛾、Se301细胞与SeMNPV 甜菜夜蛾幼虫购自河南省济源白云实业有限公司。甜菜夜蛾细胞系Se301细胞由荷兰瓦赫宁根大学的Just M. Vlak教授惠赠,SeMNPV-US1(SeMNPV美国加利福尼亚分离株)由美国加州大学Riverside分校的Brian. A. Federici 教授惠赠。
1.1.2 试剂 Grace完全培养基(Gibco)购自于赛默飞世尔科技有限公司。小RNA提取试剂盒(miRNA Kit)购于OMEGA公司。琼脂糖凝胶DNA回收试剂盒、miRNA反转录试剂盒(miRcute miRNA First-Strand cDNA Synthesis Kit)和miRNA荧光定量PCR试剂盒[miRcute Plus miRNA qPCR Detection Kit (SYBR Green)]购于天根生化科技(北京)有限公司。高保真DNA聚合酶(PrimeSTAR Max DNA 聚合酶)和A-T克隆试剂盒(DNA A-Tailing Kit和pMD 18-T Vector Cloning Kit)购自宝日医生物技术(北京)有限公司。大肠杆菌DH5α感受态购自北京擎科生物科技有限公司。99.8%除虫菊提取物原药购自上海易恩化学技术有限公司。
1.2 方法
1.2.1 细胞培养 在25 cm细胞培养瓶中接种1.5×10个Se301细胞,加入Grace完全培养基 5 mL,置27 ℃细胞培养箱中培养约5 d,待细胞密集程度约90%时,进行细胞传代。
1.2.2 小RNA提取与cDNA合成 2020年12月分别取笔者所在实验室培养的Se301细胞1×10个或甜菜夜蛾幼虫血淋巴150 μL,按照miRNA提取试剂盒说明书提取细胞或血淋巴的小RNA,微孔紫外分光光度计检测小RNA浓度和纯度后,置于 -80 ℃ 保存。以提取的小RNA为模板,利用miRNA反转录试剂盒进行miRNA反转录获得cDNA。
1.2.3 甜菜夜蛾snRNA克隆 根据甜菜夜蛾Se301细胞基因组测序数据(笔者所在实验室未公开发表)注释设计甜菜夜蛾snRNA全长序列扩增引物对,-F(G T A C T T G C T T C G G C A G T A C A T A T)和-R(A A A A A T G T G G A A C G C T T C A C G A)。以Se301细胞小RNA反转录获得的cDNA为模板,RT-PCR 扩增甜菜夜蛾snRNA全长序列,反应体系如下:cDNA 1 μL,-F和-R(10 μmol/L)各0.5 μL,2 × PrimeSTAR Max Premix 10 μL,ddHO补至20 μL。PCR反应程序:98 ℃ 30 s;98 ℃ 10 s,57 ℃ 20 s,72 ℃ 10 s,30个循环;72 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳检测后,利用琼脂糖凝胶DNA回收试剂盒回收目的DNA片段,连接pMD18-T载体,转化感受态大肠杆菌DH5α。经菌落PCR鉴定后,送生工生物工程(上海)股份有限公司测序。
1.2.4 甜菜夜蛾snRNA的多序列比对与系统进化分析 使用MEGA7软件的Clustal W算法对甜菜夜蛾等不同物种的snRNA进行多序列比对,GeneDoc进行展示。使用MEGA7软件的最大似然法(Maximum Likelihood Tree)构建系统发育树,重复抽样检测1 000次。
1.2.5 除虫菊提取物处理对甜菜夜蛾Se301细胞中snRNA表达的影响 铺1×10个Se301细胞于直径35 mm的细胞培养皿中,贴壁过夜。加入含除虫菊提取物终浓度为半数致死浓度(lethal concentration 50,LC)的培养基溶液,孵育24 h,提取细胞小RNA,反转录为cDNA。以不含除虫菊提取物的培养基溶液培养细胞为空白对照,按miRNA荧光定量试剂盒说明书,荧光定量PCR方法分析snRNA表达情况。
1.2.6 高温处理对甜菜夜蛾Se301细胞中snRNA表达的影响 铺1×10个Se301细胞于直径35 mm的细胞培养皿中,贴壁过夜。分别置于 36 ℃ 和27 ℃条件下培养1 h后,收取细胞样品,提取小RNA,反转录为cDNA,荧光定量PCR方法分析snRNA的表达情况。
1.2.7 SeMNPV感染对甜菜夜蛾snRNA表达的影响 选取发育状态良好的4龄甜菜夜蛾幼虫20头,用带有SeMNPV多角体(2×10个/幼虫)的人工饲料喂食,以加无菌水的人工饲料喂食幼虫为对照。72 h后收取幼虫血淋巴,提取小RNA,反转录为cDNA,荧光定量PCR方法定量分析snRNA的表达情况。
1.2.8 统计与分析 使用SPSS 21.0软件对试验结果进行独立样本检验分析。数据作图采用GraphPad Prism 7软件。
2 结果与分析
2.1 甜菜夜蛾U6 snRNA的克隆
从笔者所在课题组的甜菜夜蛾Se301细胞的基因组测序数据的注释结果中筛选到了甜菜夜蛾snRNA,其序列为(5′→3′):G U A C U U G C U U C G G C A G U A C A U A U A C U A A A A U U G G A A C G A U A C A G A G A A G A U U A G C A U G G C C C C U G C G C A A G G A U G A C A C G C A A A A U C G U G A A G C G U U C C A C A U U U U U,共107 nt。提取Se301细胞小RNA,通过RT-PCR扩增甜菜夜蛾snRNA。结果显示,以Se301细胞cDNA和DNA为模板,PCR均扩增出约107 nt的目的条带,与预期大小相符(图1)。
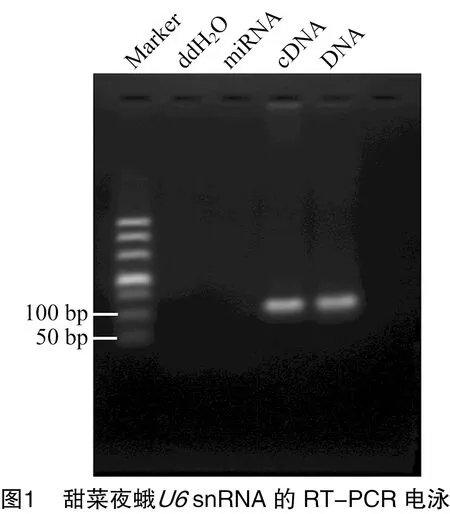
回收目的片段,连接pMD18-T载体并转化大肠杆菌DH5α感受态。使用-F/-R引物进行菌落PCR鉴定,结果见图2-A。挑取阳性克隆,重组质粒pMD18-T-的测序结果表明克隆的snRNA与Se301细胞基因组测序注释结果中snRNA的序列一致(图2-B)。

2.2 甜菜夜蛾U6 snRNA的保守性与系统进化分析
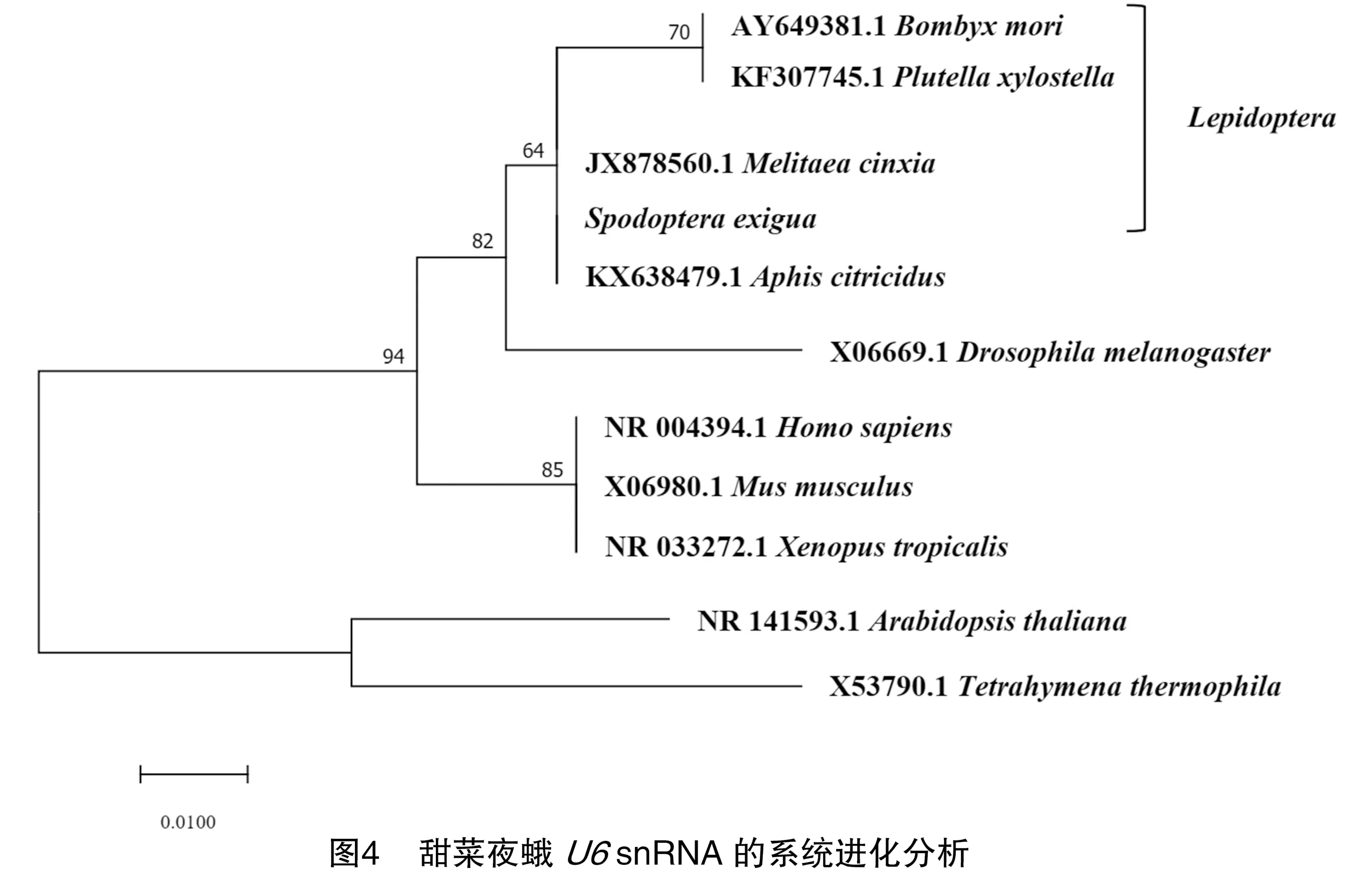
通过MEGA7软件对甜菜夜蛾的snRNA进行系统进化分析。将克隆分析得到的甜菜夜蛾snRNA与从GenBank中搜索获得的人(NR_004394.1)、黑腹果蝇(,X06669.1)、家蚕(,AY649381.1)、小菜蛾(,KF307745.1)、褐色桔蚜(,KX638479.1)、拟南芥(,NR_141593.1)、庆网蛱蝶(,JX878560.1)、小鼠(,X06980.1)、四膜虫(,X53790.1)和非洲爪蟾(,NR_033272.1)的snRNA序列进行多序列比对,结果见图3。多序列比对结果表明snRNA在不同物种中是高度保守的。

对不同物种snRNA的系统进化分析表明,甜菜夜蛾的snRNA与家蚕、小菜蛾和庆网蛱蝶这3个鳞翅目昆虫的snRNA进化关系最近,说明甜菜夜蛾snRNA与其他鳞翅目昆虫snRNA同源性最高。此外,鳞翅目昆虫的snRNA的同源性与同为昆虫纲物种的褐色橘蚜和黑腹果蝇也比较高。在系统进化分析中可以看出由于甜菜夜蛾snRNA与四膜虫snRNA的系统进化关系最远,其snRNA同源性最低,结果见图4。该结果反映了甜菜夜蛾snRNA的系统进化情况,进一步证实甜菜夜蛾snRNA序列的正确性。
2.3 除虫菊提取物处理对甜菜夜蛾Se301细胞中U6 snRNA表达的影响
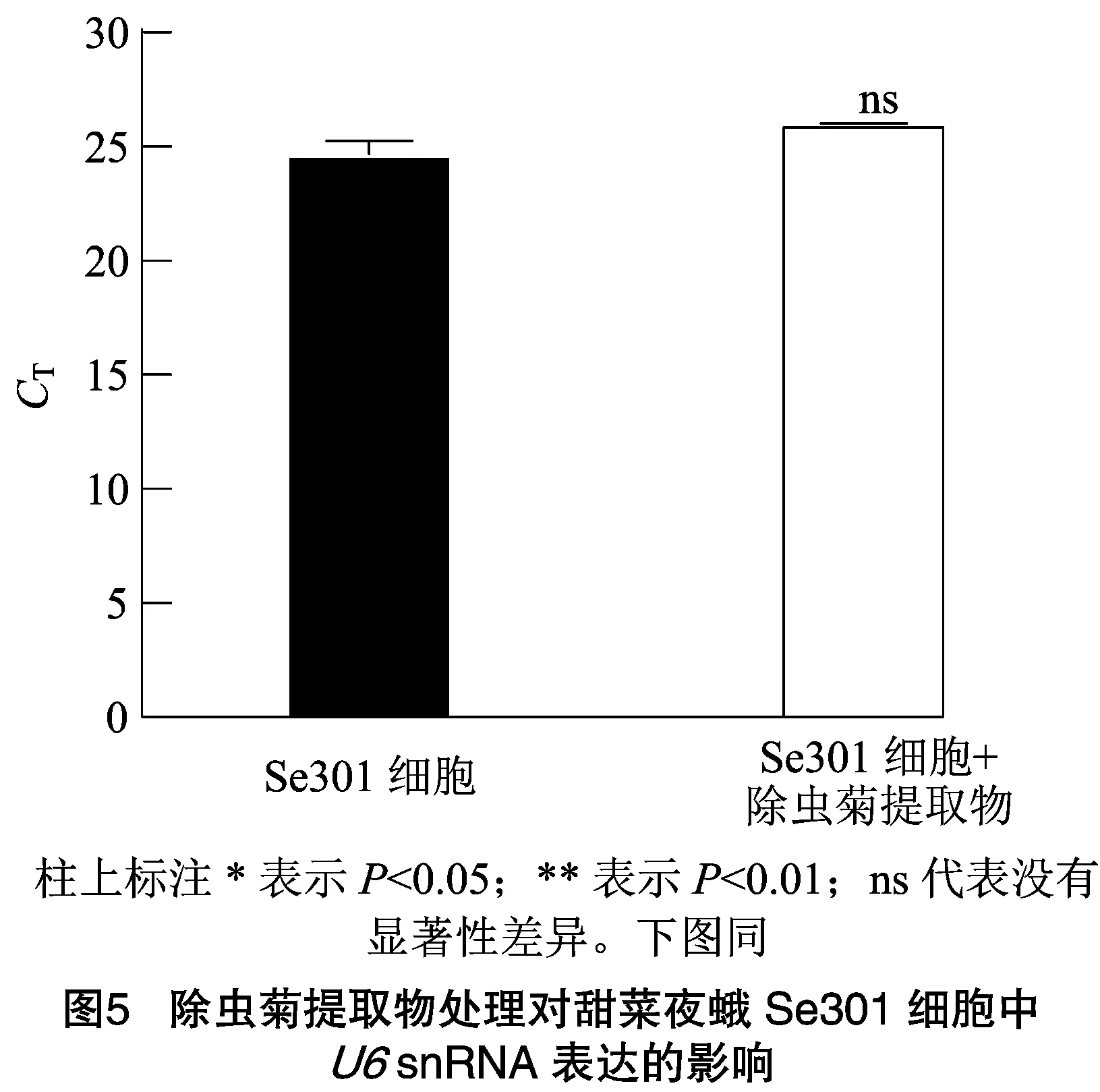
分析除虫菊提取物农药胁迫下,Se301细胞中snRNA的表达稳定性。前期分析测定表明,除虫菊提取物处理Se301的LC为0.29%(体积分数)。使用含0.29%(体积分数)除虫菊提取物培养基处理Se301细胞后24 h,提取细胞小RNA,RT-qPCR检测snRNA表达结果显示(图5),除虫菊提取物处理细胞(值为26.00)与无药物处理的Se301细胞对照(值为24.67)中snRNA表达量相当。表明除虫菊提取物LC浓度处理对Se301细胞中snRNA的表达无显著影响(=0.057>0.05)。
2.4 高温处理对甜菜夜蛾Se301细胞中U6 snRNA表达的影响
检测高温培养(36 ℃)对Se301细胞中snRNA表达的影响。结果表明,Se301细胞在36 ℃和27 ℃培养1 h后,细胞snRNA的表达量相当,值分别为25.04和25.06(图6)。表明36 ℃高温处理1 h对Se301细胞中snRNA表达无显著影响(=0.935>0.05)。

2.5 SeMNPV感染对甜菜夜蛾U6 snRNA表达的影响
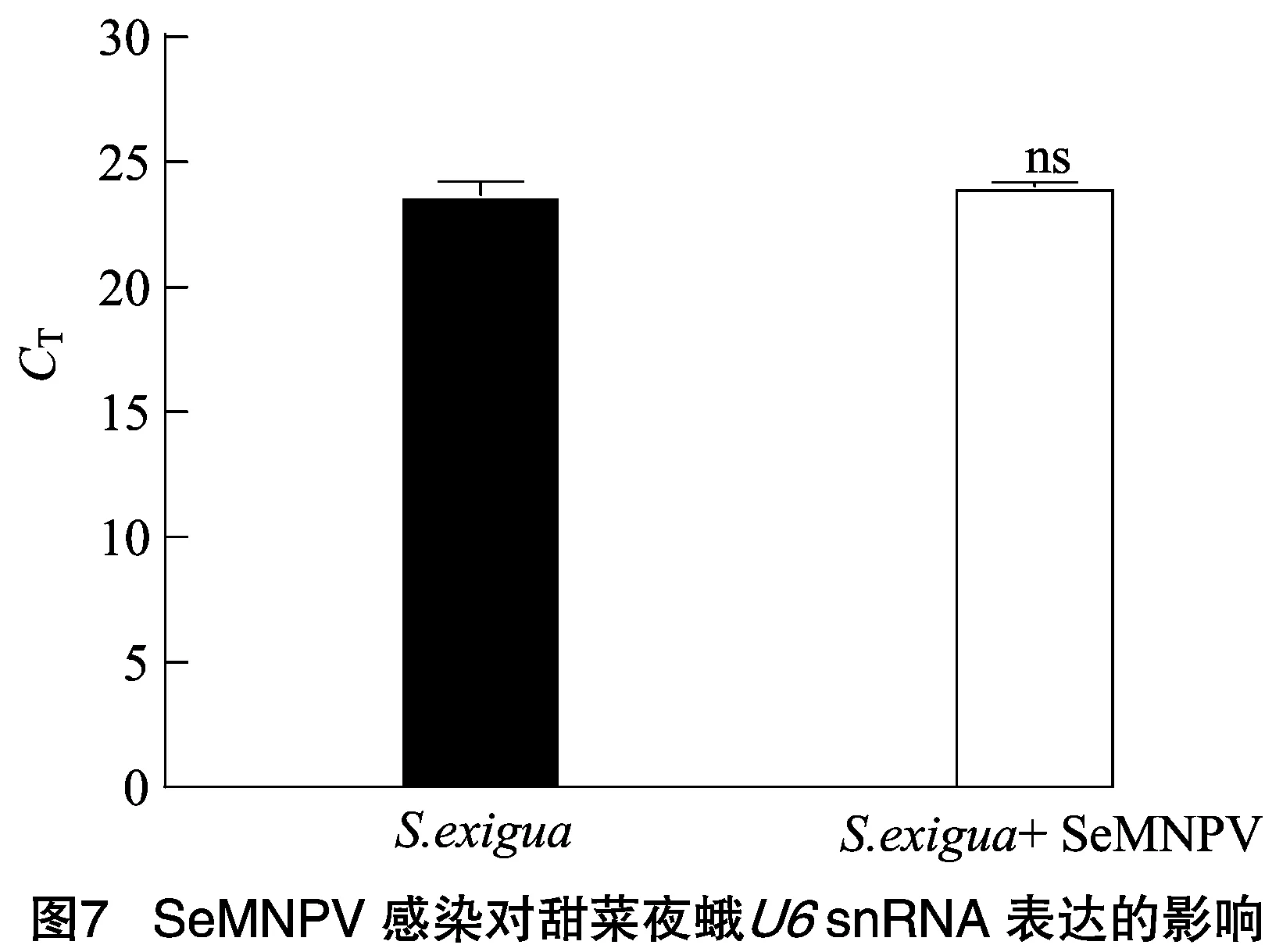
进一步探究生物胁迫SeMNPV病毒感染对甜菜夜蛾snRNA表达的影响。收集SeMNPV病毒感染4龄甜菜夜蛾幼虫72 h后的血淋巴,提取小RNA,RT-qPCR检测snRNA的表达。结果表明,SeMNPV病毒感染对甜菜夜蛾血淋巴中snRNA的表达无显著影响(=0.345>0.05),其中,SeMNPV感染甜菜夜蛾试验组的值为24.03,未感染的甜菜夜蛾对照组值为23.70,结果见图7。
3 讨论与结论
snRNA作为主要剪接体的重要组分,在各种真核生物细胞中的表达较为稳定,常被用作昆虫等物种miRNA表达检测的内参基因。本研究克隆甜菜夜蛾的snRNA序列,分析其系统进化关系以及在不同胁迫条件下的表达稳定性,为其作为内参基因的使用提供依据。
本研究克隆获得全长为107 nt的甜菜夜蛾snRNA序列。与已报道的果蝇等其他物种序列相同,甜菜夜蛾snRNA 3′末端为5个U的特殊终止序列,符合RNA聚合酶Ⅲ的转录产物特征。由于基因转录后加工的可变剪接在真核生物中是普遍存在的,snRNA作为主要剪接体的重要组分,在不同真核生物中的进化保守性高。进化分析表明甜菜夜蛾snRNA与家蚕、小菜蛾和庆网蛱蝶这3个鳞翅目昆虫及同翅目昆虫褐色橘蚜的snRNA亲缘关系最近。目前昆虫snRNA序列克隆报道尚不多,snRNA在夜蛾科及昆虫纲中的保守性和进化关系有待更多物种的snRNA序列分析研究。
选择在不同生理和环境条件下都能稳定表达的内参基因对定量分析结果的准确性十分重要。封冰等研究发现小菜蛾snRNA在幼虫各发育阶段和马拉硫磷等9种农药的胁迫下能稳定表达。已报道snRNA作为内参基因用于果蝇、家蚕、草地贪夜蛾和褐飞虱等昆虫miRNA表达检测。本研究利用除虫菊提取物处理、36 ℃高温培养和SeMNPV感染处理,细胞或幼虫受胁迫条件下,甜菜夜蛾snRNA表达均未受到显著影响,能稳定表达。结果表明甜菜夜蛾snRNA适合作为内参基因用于甜菜夜蛾细胞和昆虫miRNA表达定量检测的内参基因,以校正因样品处理和试验操作等原因造成的试验误差。进一步可分析snRNA在甜菜夜蛾不同发育时期、不同组织细胞、不同病原菌侵染和不同时相等条件下的表达稳定性。
