微小RNA-203预测胃癌肝转移及预后的临床价值
2022-09-22姜孝奎李振想孟鑫李韶山
姜孝奎,李振想,孟鑫,李韶山
胃癌(gastric cancer,GC)是一种高发病率和高死亡率的恶性肿瘤,被列为癌症相关死亡的第二大诱因,并在全球造成较大的健康负担[1]。尽管在GC的治疗上已经取得了较大的进步,但由于频繁复发和远处转移使GC病人的预后仍令人沮丧,肝脏是晚期胃癌血行转移的常见部位[2-3]。为了克服这些临床问题,显然需要识别早期复发或预后不良的生物标志物[4]。miR-203对胃癌转移和临床预后的评估价值还未有研究,本研究通过细胞实验证实miR-203为外泌型miRNA,检测病人外周血中miR-203的水平,分析不同病理特征间的表达差异及对胃癌肝转移和术后3年死亡的预测价值。
1 资料与方法
1.1 一般资料收集2015年1月至2017年12月在新乡医学院第三附属医院接受手术治疗的胃癌病人115例,男74例,女41例,年龄(56.7±11.3)岁,范围为32~75岁。纳入标准:①术后经病理学诊断为胃癌;②原发性胃癌;③术前未经过放化疗。排除标准:①有传染性疾病、自身免疫病或其他肿瘤;②术后未完成放化疗;③失访病人。同时收集健康志愿者40例为非胃癌病人组,男23例,女17例,年龄(54.7±12.6)岁,范围为34~70岁。
1.2 临床资料收集及术后随访收集病人的一般临床资料,主要包括:性别、年龄、原发肿瘤(T)分期、淋巴结(N)分期、远处转移(M)分期、原发肿瘤、淋巴结、远处转移(TNM)分期、胃癌肝转移、腹膜转移、肿瘤长径、术后3年存活情况。以门诊和电话相结合的方式进行术后随访,最短随访时间14个月,最长随访时间36个月。
1.3 qRT-PCR检测外周血中miR-203 的表达水平收集病人外周血5 mL,以3 000 r/min的速度离心15 min,留取上清放置-80℃冰箱中待用。TRIzol法提取细胞总RNA,使用miRNA分离试剂盒从血清和培养基样品中提取miRNA,经紫外分光光度计鉴定,OD260/OD280为1.8~2.0时视为合格品,将提取的总RNA逆转录为cDNA。逆转录条件:40℃、40 min,30℃、10 min。以cDNA为模板。引物序列:miR-203正 向 引 物 序 列 为5′-CTTGCTACTTCATTCAACCAC-3′、反 向 引 物 序 列 为5′-AGTTTGACGTTAGTCCAA-3′,U6正向引物序列为5′-CTGCGTAATCCTCTGCCTAT-3′、反向引物序列为5′-GTCCCACCGTGTGGTAACCG-3′。PCR反应体系共25 μL:2×Taq PCR MasterMix 12.5 μL,模板DNA 1 μL,上下游引物各1 μL,双蒸水9.5 μL。反应条件:95℃、20 s,95℃、10 s、60℃、20 s共40个循环,最后70℃、10 s。反应结束,统计每样本循环阈值(CT)。以U6为内参,采用2-ΔΔCt法计算miR-203相对表达量。实验重复3次,取平均值。
1.4 统计学方法采用SPSS 21.0软件,计量资料行正态性检测,符合正态分布的资料以表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验的方法,计数资料以例(%)表示,组间比较采用χ2检验,单因素和多因素logistic回归分析和Cox回归分析检测影响胃癌肝转移和胃癌术后3年内死亡的危险因素,ROC分析miR-203对胃癌肝转移和胃癌术后3年内死亡的预测价值。P<0.05表示差异有统计学意义。
2 结果
2.1 胃癌病人外周血中miR-203 的表达水平与病人临床病例特征的关系胃癌病人外周血中miR-203的表达水平为0.482±0.107,低于非胃癌病人外周血中的水平1.529±0.154(t=8.20,P<0.001)。胃癌病人的N分期、M分期、TNM分期、肝转移、腹膜转移、术后3年存活情况与miR-203的表达水平有关(P<0.05),见表1。
表1 胃癌115例外周血中miR-203的表达水平与临床病例特征的关系/

表1 胃癌115例外周血中miR-203的表达水平与临床病例特征的关系/
病例特征年龄<60岁≥60岁性别男女T分期T1/T2 T3/T4 N分期N0 N1/N2/N3 M分期M0 M1 TNM分期Ⅰ~ⅡⅢ~Ⅳ肝转移阴性阳性腹膜转移阴性阳性肿瘤长径<3 cm≥3 cm术后3年存活情况存活死亡例数60 55 74 41 37 78 67 48 84 31 58 57 90 25 103 12 81 34 93 22 miR-203水平0.504±0.185 0.402±0.143 0.471±0.114 0.435±0.107 0.481±0.154 0.425±0.130 0.691±0.251 0.215±0.117 0.652±0.273 0.254±0.105 0.745±0.214 0.235±0.084 0.705±0.087 0.201±0.207 0.734±0.063 0.172±0.102 0.487±0.124 0.419±0.082 0.594±0.110 0.312±0.104 t值1.95 1.02 0.95 5.30 5.02 6.34 6.32 6.82 1.35 4.32 P值0.098 0.132 0.541<0.001<0.001<0.001<0.001<0.001 0.105<0.001
2.2 logistic回归分析影响胃癌肝转移的因素以胃癌是否发生肝转移为自变量,将表1中的因素和miR-203水平代入logistic单因素回归模型中,结果显示T分期、N分期、M分期、TNM分期和miR-203对胃癌肝转移有影响,将对胃癌肝转移有影响的因素代入logistic多因素回归模型中,结果显示N分期、M分期、TNM分期和miR-203为影响胃癌术后肝转移的独立危险因素,见表2。
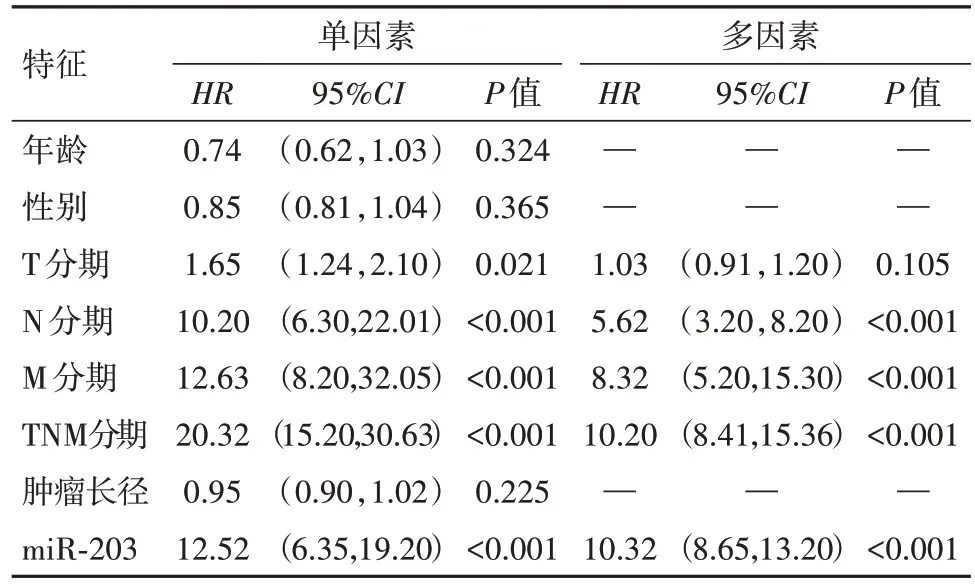
表2 胃癌115例术后肝转移单因素和多因素logistic回归分析
2.3 Cox回归分析影响胃癌术后3年死亡的因素以胃癌术后3年内是否死亡为自变量,将表1中的因素和miR-203水平代入Cox单因素回归模型中,结果显示N分期、M分期、TNM分期、肝转移、腹膜转移和miR-203对胃癌术后3年内死亡有影响,将对胃癌术后3年内死亡有影响的因素代入Cox多因素回归模型中,结果显示N分期、M分期、TNM分期、肝转移、腹膜转移和miR-203为影响胃癌术后3年内死亡的独立危险因素,见表3。

表3 胃癌115例术后3年死亡单因素和多因素Cox回归分析
2.4 外周血中miR-203 预测胃癌肝转移、胃癌术后预后不良的临床价值外周血中miR-203预测胃癌术后肝转移的曲线下面积(95%CI)为0.91(0.86,0.92),特异度为81.4%,灵敏度为80.3%。预测胃癌术后3年内病人死亡的曲线下面积(95%CI)为0.85(0.81,0.89),特异度为72.4%,灵敏度为89.3%。
3 讨论
胃癌是一种致命的恶性肿瘤,临床治疗面临巨大挑战[5-6]。尽管人们对遗传和表观遗传学的癌症事件的了解越来越多,但缺乏早期评估GC转移和预后的非侵入性方法或生物标记物。非编码RNA特别是miRNA进入“癌症领域”已有10多年的历史,miRNA是内源性的小非编码RNA分子,长度为19-22个核苷酸[7]。超过50%的人类miRNA位于脆弱位点,这些位点与癌症的发生和发展有关[8-9]。多项研究显示,胃癌组织中多种miRNA表达失调,更重要的是有些可以在体循环中被检测到。循环系统中miRNA水平的改变可能与GC病人的生理和病理改变直接相关[10-12]。
MiR-203是公认的抑癌基因,也是启动子甲基化过度的靶标,已被证实可以抑制多种肿瘤细胞的增殖、侵袭、迁移和肿瘤血管生成[13-15]。尽管miR-203在GC中已有报道,对miR-203的上皮间质转化和侵袭有影响,但未有研究探讨其作为血清生物标志物的可行性[16]。本研究外周血中miR-203表达水平与N分期、M分期、TNM分期、肝转移、腹膜转移、术后3年存活情况有关,此结果与以往的研究结果有相似之处[17-18]。本研究显示在肝转移、淋巴结转移、腹膜转移和远处转移的病人血清miR-203水平均较低,说明miR-203水平降低有利于转移。MiR-203发挥肿瘤抑制作用[19-20],可能在GC细胞中被下调,因此GC细胞不能在细胞外环境中产生足量的miR-203,导致其在外周血中的水平降低。以上结果表明,发生肝转移和胃癌术后3年内死亡的病人外周血中可检测到低水平的miR-203,临床对外周血中miR-203监测,对预测GC转移和术后的存活可能具有一定的临床价值。同时回归分析显示,miR-203为胃癌肝转移和胃癌术后3年内死亡的独立危险因素,miR-203对胃癌肝转移和胃癌术后3年内死亡具有一定的预测价值。
综上所述,miR-203在胃癌外周血中的表达水平降低对胃癌肝转移和胃癌术后3年内死亡具有一定的预测价值。
