YAP1在稽留流产绒毛中的表达及对JAR细胞生物学行为的影响
2022-09-20王华倩余亚君潘海滔
王华倩 余亚君 张 涛 潘海滔 何 尧
(1.绍兴文理学院 医学院,浙江 绍兴312000;2.绍兴市妇幼保健院,浙江 绍兴 312000)
稽留流产(Missed Abortion,MA)是指胚胎或胎儿死亡后未及时排出者[1].近年来,随着三胎政策放开后高龄孕妇的增多,其发病率逐年上升[2],给广大育龄妇女及其家庭造成了很大的心理负担[3].人胎盘滋养细胞分化障碍是导致多种妊娠并发症的关键因素[4].
Hippo通路是指近年来研究较多的参与组织发育、干细胞分化和细胞凋亡等的信号通路,其核心成分L 型氨基酸转运载体(L-Type Amino Acid Transporter,LAT)[5]、Yes相关蛋白(Yes-Associated Protein, YAP)[4]、TEA 结构域转录因子 4(TEA Domain Transcription Factor 4,TEAD4)[6]等已经被证实在胚胎植入中发挥重要作用.YAP1作为该通路下游主要的效应分子,在Hippo信号通路中的某些分子出现突变时,会处于超激活状态,促进滋养细胞增殖、迁移与侵袭[7].余超等[8]研究发现,YAP1的突变体与稽留流产的发生发展有一定关系,敲除YAP1的卵母细胞虽然能够正常成熟和受精,但胚胎发育迟缓,并在3~4天内死亡,表明YAP1可能参与了早期胚胎的形成.
JAR细胞与其起源的滋养细胞保持着极为相似的生物学特性,如侵袭组织及血管,被很多学者用来研究滋养细胞功能相关的调控机制[9],Biswarup等[10]研究发现YAP在人胚胎干细胞和JAR细胞均有强烈表达.因此,本研究拟通过建立人胎盘绒毛癌JAR细胞模型,采用siRNA技术干扰下调模型中YAP1的表达,探讨YAP1蛋白对滋养细胞生物学行为的调控作用及其与稽留流产发病的可能机制.
1 材料与方法
1.1 对象
选择2018年7月在绍兴市妇幼保健院确诊为稽留流产的患者4例为实验组(MT),稽留流产的诊断标准以第9版《妇产科学》为主,经超声检查证实停育,孕周小于12周,平均年龄26岁,孕次1~3次.选择同期自愿在该院行人工流产术的正常早孕妇女为对照组(MC).两组孕妇的年龄、孕周、合并症比较无统计学差异(P>0.05).本研究方案已获医院伦理委员会批准,所有受试者均已签署知情同意书.
1.2 主要试剂与仪器
JAR细胞株购自美国ATCC公司;siRNA购自锐博生物,RPMI 1640培养基、胎牛血清、Matrigel购自美国BI公司,Lipo6000、FastKing一步法除基因组cDNA第一链合成预混试剂、BeyoFast SYBR Green qPCR Mix(2X,High ROX)、SDS-PAGE凝胶配置试剂盒、YAP1(AF1615)、PI3-k(AF1966)、Caspase-3(AF1213)、Caspase-9(AF1264)、Bax(AF0054)、MEK1/2(AF1057)、Akt1(AF0045)、IRS1(AF2587)、GAPDH小鼠单抗(AG019)、Tubulin抗体(AT819)均购于碧云天.二氧化碳培养箱购自美国Thermo,实时无标记细胞分析仪(RTCA)购自ACEA,PCR仪型号为珠海黑马Hema9600.
1.3 实验方法
1.3.1 Western Blot试验及实时荧光定量PCR(qRT-PCR)验证YAP1在稽留流产绒毛中的表达水平
将临床收集到的两组绒毛用RIPA蛋白裂解液提取总蛋白,冰上裂解30 min,4 ℃ 14 000 rpm高速离心4 min,上清液过膜,提取细胞裂解液.按BCA蛋白浓度测定试剂盒说明书步骤检测YAP1蛋白浓度.取样本进行SDS-PAGE凝胶配置、电泳、转膜、剪膜,根据测定的蛋白分子量,分别孵育一抗,4 ℃过夜,12 h后TBST洗膜3次加入二抗,室温孵育1 h,再洗涤,滴入ECL显色液2 min后,采用软件Sage Capture曝光显影分析各条带的灰度值.将提取的总RNA按FastKing一步法除基因组cDNA第一链合成预混试剂说明书进项操作获得cDNA,测定浓度后,根据BeyoFast SYBR Green qPCR Mix(2X,High ROX)说明,并以β-actin作为内参基因检测YAP1 mRNA的表达.
1.3.2 细胞培养及转染
采用RPMI1640培养基(含10% FBS),在37 ℃ 5% CO2恒温细胞培养箱中常规培养JAR细胞,待细胞密度达到70%~80%时,添加含0.25%EDTA的胰蛋白酶进行消化传代.以2×105个/孔的密度将第三代对数生长期细胞接种于培养板上,随机分为空白组(NC)、试剂对照组(Li)和转染siRNA-YAP1组(siRNA-YAP1),根据Lipo6000说明书操作,将转染试剂加入细胞中,在37 ℃ 5% CO2恒温细胞培养箱中孵育6 h更换完全培养基.转染后采用qRT-PCR与Western Blot检测JAR细胞中YAP1 mRNA与蛋白表达变化.
1.3.3 在细胞水平验证YAP1下调表达对JAR细胞特性的影响
收集转染后的JAR细胞,消化离心后配置成细胞悬液,计数后配置成细胞数目为1×104个/100μL的细胞悬液,室温放置30 min后,在37 ℃ 5% CO2恒温细胞培养箱中,使用RTCA检测细胞增殖能力变化.装配CIM板,同上述方法进行细胞悬液的细胞计数、细胞悬液配置,然后在测好基线的CIM 板的上室孔中加入100 μL混合均匀的无血清细胞悬液,置于RTCA检测.采用预冷的无血清培养基稀释Matrigel进行细胞侵袭能力检测,用倒吸法加入20 μL Matrigel包被CIM-Plate上室,置于培养箱中约4 h包被至其凝固,后续与迁移实验操作一致,检测细胞侵袭能力.
1.3.4 凋亡及胚胎植入相关重要信号通路关键蛋白的检测
实验方法同上,分别以Tubulin、GAPDH为内参,采用Western Blot检测凋亡相关蛋白BAX、caspase-3、caspase-9和胚胎植入相关重要信号通路关键蛋白IRS、PI3-k、Akt1、MEK1/2蛋白的表达情况.
1.4 统计学处理
采用Graphpad Rrism 6进行统计分析,计量资料均以(¯x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义.所有数据以三次重复的平均值±SEM表示.
2 结果
2.1 YAP1在稽留流产和正常早孕人流绒毛组织中的表达
qRT-PCR和Western Blot结果均显示,与正常组织对照相比,稽留流产绒毛组织样本中YAP1在基因水平和蛋白水平的表达均明显上调,如图1,故选择下调YAP1表达的人JAR细胞进行后续研究.
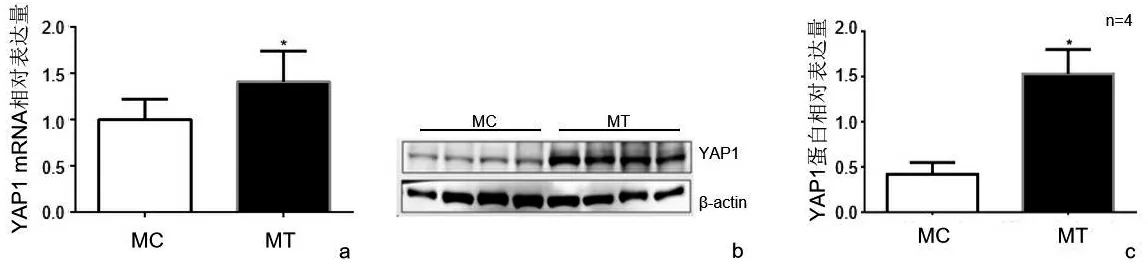
(a)实时荧光定量PCR检测;(b、c):Western Blot 检测;MC:正常对照组,MT:稽留流产组;P<0.05
2.2 转染siRNA-YAP1后JAR细胞活性比较
与NC组和Li组相比,转染后的JAR细胞中YAP1的表达水平显著低于NC组和Li组,如图2所示,表明YAP1的siRNA在JAR细胞系中成功敲减了靶蛋白YAP1,可以进行敲低后的JAR细胞增殖、迁移和侵袭的后续分析.
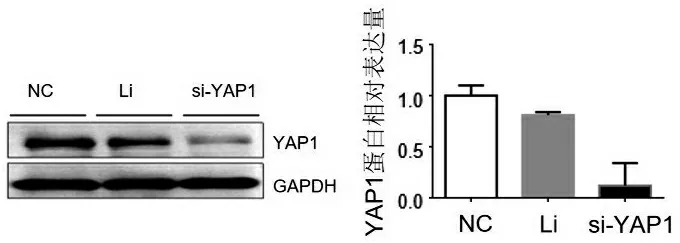
图2 YAP1-si-RNA可明显抑制JAR细胞中YAP1 的表达
2.3 下调YAP1表达抑制JAR细胞的增殖、迁移和侵袭能力
随着培养时间的延长,与NC组和Li组相比,si-YAP1组的增殖、迁移和侵袭能力都明显受到了抑制,如图3所示.
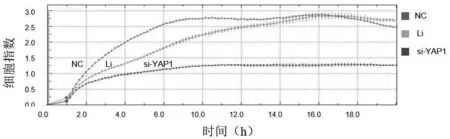
(a)YAP1调节细胞增殖实验结果
2.4 下调YAP1表达对凋亡相关蛋白及胚胎植入相关重要信号通路关键蛋白的影响
Western Blot实验结果显示,YAP1的表达下调后,caspase-3和9未见明显变化,但BAX蛋白表达上调,BAX上调可促进细胞凋亡发生,见图4.胚胎植入相关重要信号通路关键蛋白中除MEK1/2未见明显变化,其余IRS1、PI3K和Akt均表达异常,IRS1上调表达,PI3K和Akt下调表达,见图5.这表明YAP1可能通过调控凋亡及胚胎植入相关重要信号通路影响JAR细胞的增殖、迁移和侵袭.
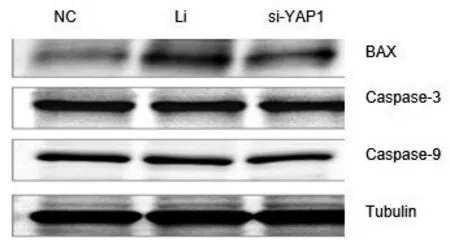
图4 下调YAP1表达对凋亡相关蛋白的影响
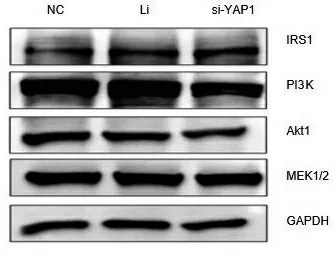
图5 下调YAP1表达对胚胎植入相关重要信号通路关键蛋白的影响
3 讨论
稽留流产的病因错综复杂,目前认为主要与母体、胎盘、胎儿和遗传因素相关[11],其中,滋养细胞功能受损导致的胎盘发育和功能不良发挥重要作用[12].细胞凋亡是机体为维持内环境稳定、由基因编码的细胞主动死亡过程[13],几乎发生在所有的血管内壁细胞.绒毛组织血管腔的形成和稳定需要适度的滋养细胞凋亡,当细胞“增殖-凋亡”的动态平衡被打破时,会引起胎盘发育不良和母胎循环障碍,从而影响妊娠结局.
YAP1是一种抗凋亡蛋白,在子痫前期的胎盘中低表达,参与滋养层细胞的增殖和凋亡[14].穿梭于细胞质与细胞核之间,在缺氧等不利条件下,会被上游磷酸化,阻滞于细胞质中,抑制增殖相关靶基因的转录[15].有研究[16]指出,YAP磷酸化就像胎盘发育的“刹车”,会随着孕周的增加而升高,但过高的磷酸化水平会限制YAP向细胞核的移动,影响下游基因的转录,导致滋养细胞功能障碍,从而引起胎儿生长受限等病理妊娠.但是,目前国内外有关YAP1表达对凋亡、及滋养细胞生物学行为的调控机制与稽留流产发病相关性的研究报道较少.
Wang等研究[16]指出,YAP蛋白异常表达会削弱滋养细胞的侵袭和迁移能力,影响胎盘功能从而引起胎儿生长.Liu等[17]通过检测重度子痫前期胎盘中YAP1的表达水平,发现明显减少,且过表达YAP1会明显增强滋养细胞的侵袭能力,证明Hippo-YAP1信号通路可能在重度子痫前期中通过调节滋养细胞的侵袭和增殖能力发挥致病作用.有研究[18,19]指出,YAP和PI3K通路的级联反应在滋养细胞增殖与凋亡中相互影响、共同调节,进而影响妊娠早期的胚胎植入过程.王细先等[20]研究发现,BAX表达水平高易引发妊娠胎盘组织的异常凋亡, 导致绒毛功能障碍和蜕膜变性坏死,参与稽留流产的发生.
本文实验结果显示,YAP1下调表达显著抑制了JAR细胞的增殖、体外迁移和侵袭能力,结果与其他学者的研究结果一致.同时,检测到YAP1下调表达的JAR细胞中促凋亡蛋白的表达明显上调,胚胎植入相关重要信号通路关键蛋白表达下调,这与本文前期实验中YAP1下调表达后JAR细胞的生物学行为受到显著抑制具有一致性与延续性.
但在临床样本中却检测到稽留流产患者绒毛组织中YAP1蛋白和YAP1-mRNA的表达水平明显高于正常早孕.通过查看其他学者的研究[16],了解到过高的磷酸化水平会限制YAP1向细胞核的移动,影响下游基因的转录,也会导致滋养细胞功能障碍,引起胎儿生长受限等病理妊娠的发生.
综上所述,本研究从细胞水平阐明YAP1参与稽留流产发病机制的一个可能的分子机制,即YAP1蛋白异常表达,无论是异常上调,还是异常下调,都会导致滋养细胞凋亡失调,损害该细胞侵袭与迁移能力,影响子宫螺旋动脉的重塑和胚胎植入,参与稽留流产发生.
但是,稽留流产发病的具体机制是复杂的,还需要进一步的研究.本研究未进行过表达实验和动物模型实验验证,在后续研究中有必要补充丰富.随着越来越多学者对胎盘中相关蛋白不断的深入研究,稽留流产相关发病机制也会越来越明朗,这将为临床工作的早期诊断和预防提供新的理论依据.
