幽门螺杆菌悉尼标准菌株传代培养方法研究
2022-09-18樊玉娟李福兴程明璟熊苗苗赵卫东
樊玉娟,李福兴,王 黎,程明璟,肖 敏,熊苗苗,赵卫东
(大理大学临床医学院,云南大理 671000)
幽门螺杆菌(Helicobacter pylori,H.pylori)于1984年由Marshall和Warren首次从胃黏膜组织成功分离〔1〕。近40年,随着对H.pylori研究的深入,发现H.pylori感染是严重胃炎相关疾病的重要危险因素,包括消化性溃疡、胃黏膜相关淋巴组织淋巴瘤以及胃癌〔2〕。据流行病学统计,在中国,约70%的人感染H.pylori,其中15%~20%的感染者出现临床症状;在发展中国家,70%~90%的人在10岁前携带H.pylori;但在发达国家,H.pylori感染的流行率从25%~50%不等〔3〕。世界卫生组织将H.pylori列为胃癌的一类致癌因子〔3〕。虽然目前临床已有多种检测H.pylori的方法,但H.pylori培养仍是诊断其感染的金标准。由于H.pylori的培养条件高、对环境要求极其严苛,并且不能与其他细菌在同一实验室培养,故目前国内外常采用的培养H.pylori的方法成本较高。幽门螺杆菌悉尼标准菌株(SS1菌株)是最常见的H.pylori菌株之一,目前主要用于动物模型的建立以及细胞模型的感染〔4〕。本文通过对SS1菌株进行传代培养,旨在寻找一种廉价、简单、有效、快捷的H.pylori培养方法。
1 材料
幽门螺杆菌悉尼标准菌株(SS1菌株)购买于广州微生物所(GDMCC 1.1820);哥伦比亚血平板(郑州安图生物工程股份有限公司);胎牛血清(天杭生物科技股份有限公司);脑心浸润液(青岛海博生物技术有限公司);厌氧产气包(青岛海博生物技术有限公司);密封厌氧袋(青岛海博生物技术有限公司);MGCC-31 2.5 L密封培养罐(三菱瓦斯化学株式会社);CO2培养箱(赛默飞世尔科技有限公司);MVS-38立式压力蒸汽灭菌器(日本松下电器产业株式会社);禾信康元CMI-1600飞行时间质谱仪(广州禾信仪器股份有限公司);一次性接种环(唐人康医疗器械有限公司);OLYMPUS CX21FS1显微镜(日本奥林巴斯株式会社)。
2 方法
2.1 前期准备 将SS1菌株甘油冻存液1 mL迅速解冻,分装于5支冻存管中,200 μL/支,放入-80℃冰箱。配制脑心浸润液:称取3.85 g脑心浸润液肉汤,溶解于100 mL去离子水中,缓慢、充分搅拌至完全溶解。准备50 mL甘油倒入玻璃瓶中,将甘油和自配的脑心浸润液高温高压灭菌30 min。甘油和自配脑心浸润液按照1∶4的体积比配制成液体培养基,分装在经高温灭菌的10 mL离心管中,备用。
2.2H.pylori培养方法
2.2.1 方法一 向哥伦比亚血平板(10个)中加入50 μL脑心浸润液,取出SS1菌株冻存液,37℃水浴解冻,使用无菌一次性接种环(10 μL)分别沾取5次菌液(共50 μL),均匀地将SS1菌株接种在哥伦比亚血平板上,随后放入装有厌氧产气包的密封厌氧袋中,每个袋子中置入1个已完成接种的哥伦比亚血平板,密封后放入CO2培养箱,观察3~14 d。
2.2.2 方法二 向哥伦比亚血平板(5个)中加入50 μL脑心浸润液和50 μL解冻菌液,使用无菌一次性接种环均匀涂布。在密封培养罐中培养,需要检查密封培养罐的密封性是否良好,然后在密封培养罐对应的凹槽中倒入灭菌后的去离子水,并放置1个厌氧产气包,最后放入已完成接种的哥伦比亚血平板,密封后放入CO2培养箱中,观察3~14 d〔5〕。
2.2.3 方法三 向哥伦比亚血平板(5个)中加入50 μL脑心浸润液和50 μL解冻菌液,使用无菌一次性接种环均匀涂布。在方法二的基础上使用烛缸法消耗密封培养罐中的氧气,即在密封培养罐中加入1支点燃的蜡烛,盖上盖子,待蜡烛熄灭后放入CO2培养箱中,观察3~14 d〔6〕。
2.2.4 方法四 向哥伦比亚血平板(5个)中加入50 μL脑心浸润液和50 μL解冻菌液,使用无菌一次性接种环均匀涂布。培养条件同方法三,与之不同的是需要每天在密封培养罐中点燃1次蜡烛。
2.3 复苏实验 使用无菌一次性接种环缓慢刮拭哥伦比亚血平板上的菌落,将菌落溶于液体培养基,并分装于1 mL冻存管中,置于-70℃冰箱保存备用。复苏当天,随机取出1支冻存管,37℃水浴解冻,并接种于哥伦比亚血平板中,使用方法四进行培养,观察3~14 d。
2.4H.pylori菌株鉴定(1)菌落形态:观察哥伦比亚血平板中的菌落形态是否典型。(2)革兰染色:滴1滴0.9%氯化钠溶液于干净载玻片上,用无菌一次性接种环刮取少许菌落在0.9%氯化钠溶液中涂开,制成厚薄适宜的细菌涂片。涂片用火焰固定,待涂片冷却后,滴加结晶紫进行初染,染色1 min,清水洗净涂片;滴加碘液进行媒染,染色1 min,清水洗净涂片;滴加丙酮乙醇进行脱色,直至无蓝紫色液体流出,清水洗净涂片;滴加稀释复红进行复染,染色30 s,清水洗净涂片,干燥后使用油镜观察染成紫红色的待测菌涂片。(3)质谱检测:将H.pylori菌液直接涂布至靶板,用甲酸破坏细菌细胞壁,添加适量仪器配套基质,干燥后放入靶仓,进行检测。根据细菌质核比(m/z),计算机软件分析得到最匹配菌株。
3 结果
3.1H.pylori菌株培养及鉴定 采用上述4种方法均能成功培养出H.pylori菌株。从哥伦比亚血平板中均观察到大小不一、半透明状、圆形菌落,此为H.pylori菌株肉眼观察的典型形态。见图1A。为进一步验证是否为H.pylori菌株,将其做成细菌涂片,并进行革兰染色。镜下可见革兰染色阴性,细菌形态呈S形、弧形弯曲、海鸥状〔7〕。见图1B。在复苏实验中观察到相同菌落,证明本实验中冻存菌株的方法是可行的。
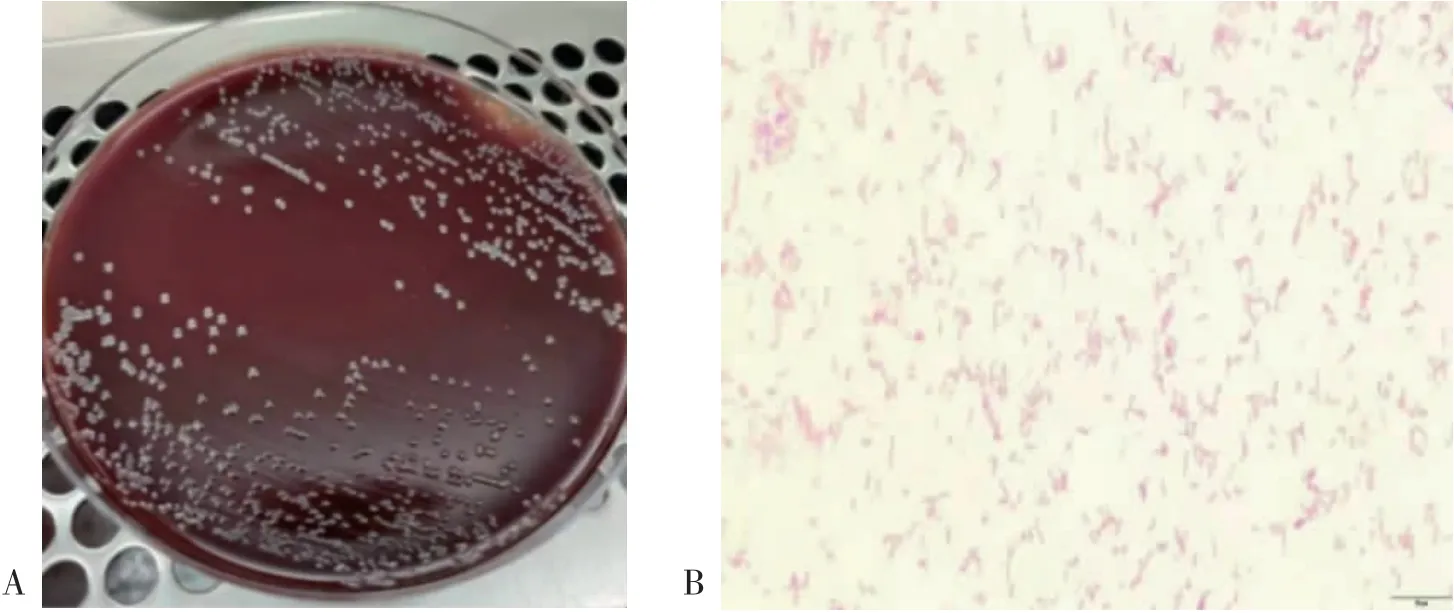
图1 H.pylori菌株鉴定
3.2H.pylori菌株质谱检测结果 飞行时间质谱仪是一种新型的微生物鉴定仪器,与传统检测方法相比,具有灵敏度高、特异性强、分析速度快的优势。相关研究表明,当细菌最高峰位处于m/z值6 900~7 000时,该菌株即为H.pylori〔8〕。本实验中,细菌最高峰位m/z值为6 964.1,与文献〔10〕报道一致,确定该菌株为H.pylori。见图2。
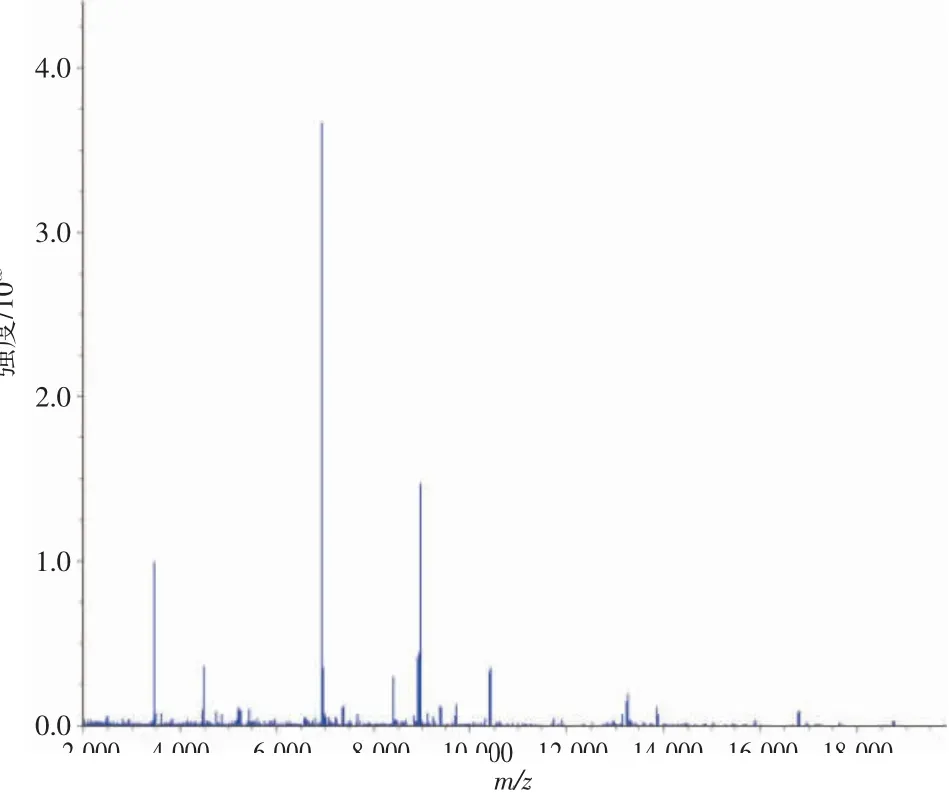
图2 H.pylori质谱检测结果
3.3 不同培养方法生长速度比较4种方法均能成功培养出H.pylori菌株,通过测定哥伦比亚血平板上的菌落数,对4种培养方法的生长速度进行比较。结果显示,在达到同等菌落数量的情况下,方法四用时显著少于其他3种方法,差异有统计学意义(P<0.05)。见表1。
表1 4种培养方法生长速度比较(d,±s)

表1 4种培养方法生长速度比较(d,±s)
注:方法四与方法一比较*P<0.05;方法四与方法二比较#P<0.05;方法四与方法三比较△P<0.05。
?
4 讨论
H.pylori是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的细菌,革兰染色阴性,有动力,在胃黏膜上皮细胞表面常呈典型的螺旋状或弧形,与本实验革兰染色镜下观察的菌落形态相一致。肉眼观察呈灰白色、半透明、颗粒状菌株,与哥伦比亚血平板中呈现的菌落形态相一致。H.pylori菌株的培养条件相对较为严格,通常需要在特定的培养基中培养,并且需要在培养基中添加一定的营养物。研究报道表明,脑心浸润液和胎牛血清可以作为首选的培养基营养物,对H.pylori的生长起着重要的促进作用〔9-10〕。同时,H.pylori的生长与环境中的气体有着密切的关系,因此,还需要严格把控气体浓度〔9-10〕。正常情况下,空气中O2占21%、CO2占0.03%,H.pylori的标准培养环境是在三气培养箱(O2:2%~8%,CO2:10%~15%,N2:85%)中进行培养,这种培养箱可以严格控制O2和CO2浓度,从而为H.pylori的生长提供适宜环境,但是三气培养箱价格高昂,使其应用受限。有研究者采用烛缸法培养H.pylori,此方法成本较低,可有效进行H.pylori菌株的传代培养,但操作较为复杂〔6〕。
H.pylori对培养环境的要求极为严格,特别是低氧环境,在本研究中,方法一仅使用了装有厌氧产气包的密封厌氧袋,袋内气体由厌氧产气包产生,它可以消耗袋内的O2产生CO2,但湿度不够,由于袋内气体达到适宜比例的速度较慢,导致传代时间长;方法二是在密封培养罐中培养,罐中相应凹槽内放入去离子水,培养罐内气体主要由厌氧产气包产生,它可以消耗罐内的O2产生CO2,由于仅存在厌氧产气包,罐内气体达到适宜比例的速度仍较慢,故菌株培养时间也比较长,但优于方法一;方法三是在密封培养罐内点燃蜡烛,蜡烛燃烧可以消耗O2产生CO2和水,这样可以保持低氧环境和适宜比例的CO2,使得罐内气体快速达到H.pylori生长的最适比例,但随着细菌生长繁殖消耗掉一定量的CO2,使得气体比例不断发生变化,因此,H.pylori生长并未达到最理想的效果;方法四是在方法三的基础上增加蜡烛点燃次数,即每天都打开密封培养罐的盖子点燃1次蜡烛,这样可以使罐内持续保持H.pylori生长的最适气体环境,因此,H.pylori生长效果较好。但本实验也有相对局限性,首先由于不具备合适的培养箱,为了选择较为合适的培养环境,只选择了CO2培养箱进行培养,而未在普通空气培养箱中进行实验,在未来的研究中,将进一步探索使用普通空气培养箱的培养方法。
综上所述,通过比较SS1菌株的传代培养方法,找到一种操作简便、价格低廉的H.pylori培养方法,可有效节约H.pylori感染的研究成本,具有较强的应用前景,值得推广。
