微小RNA在早发性卵巢功能不全中的研究进展
2022-09-17袁秀秀赵鹏伟王煜
袁秀秀,赵鹏伟,王煜
(1.内蒙古医科大学,呼和浩特 010000;2.内蒙古医科大学基础医学院微生物与免疫学研究室,呼和浩特 010000;3.内蒙古医科大学附属医院,呼和浩特 010000)
早发性卵巢功能不全(premature ovarian insufficiency,POI),曾称卵巢早衰(premature ovarian faliure,POF),是指女性在40岁之前出现卵巢功能减退,常伴月经紊乱、FSH水平升高(FSH>25 U/L),而POF为POI的终末阶段,FSH升高更为显著(FSH>40 U/L),患者常伴闭经、潮热多汗、性功能减退、骨质疏松等围绝经期临床表现[1]。近年来,随着生活方式改变和婚育年龄的推迟,POI的发病率逐年升高,发病趋于年轻化,是女性不孕的重要原因之一。POI病因复杂,90%以上病因不明。POI按卵巢功能下降程度分为隐匿期、生化异常期和临床衰竭期3个阶段。目前,临床用激素替代疗法来改善症状,但POI患者卵巢功能减退不可逆转,故POI发病机制研究成为国内外热点。微小RNA(miRNA)是一类内源性非编码小RNA,其通过完全互补或不完全互补结合方式与靶基因3’UTR miRNA结合,抑制靶基因表达。miRNA可调控人类1/3的基因,值得注意的是,1个miRNA可调节多个基因,而多个miRNAs也可调控同一个基因[2]。近年来,随着转录后调控机制研究迅速兴起,miRNA为生殖系统的研究带来了新视角,许多功能性miRNAs被证实参与调控卵巢功能。miRNA在女性生殖疾病中的作用,尤其是在POI中的作用正逐渐被深入研究。本文将对miRNA调控POI分子机制的最新研究进展进行综述。
一、miRNA多态性与POI
POI是常见的异质性性腺病,遗传因素约占POI总病因的10%~20%。POI的遗传物质异常不仅发生在染色体水平,还可能源于单基因异常。单核苷酸多态性(SNP)是由单个核苷酸碱基的转换或颠换而引起的DNA序列多态性,是人类可遗传变异中最常见的一种。目前,已发现基因突变和SNP通过不同的致病途径影响卵巢功能,且SNP与POI密切相关。研究发现,miRNAs在POI中起着重要的调控作用,其通过靶向与卵巢功能相关的基因如,调控细胞色素P450家族17亚家族A成员1(CYP17a1)、抗苗勒管激素(AMH)、抑制素亚基βA(INHBa)、细胞色素P450家族19亚家族A成员1(CYP19a1)、透明带(ZPS)、骨形态发生蛋白15(BMP-15)和生长分化因子9(GDF-9)等发挥作用[3]。Cho等[4]研究发现,miR-146a的SNP(C>G)转染人颗粒细胞后,miR-146a的表达水平降低并影响叉头框蛋白O3(FOXO3)、叉头框蛋白 L2(FOXL2)和Cyclin蛋白家族(CCND2)等POI相关基因的表达。Cho等[5]研究发现,在143例POI患者血浆中miR-938的正常和变异等位基因与GnRHR3’UTR的识别存在差异,与miR-938的正常基因型(GG)相比,杂合型(GA)变异有更高的POI发生风险,此外,miR-938多态性影响人颗粒细胞中GnRHR的表达,推测miR-938多态性通过调控靶基因从而参与调控POI发生。可见,miRNA多态性研究可为POI遗传性病因机制的研究提供新思路。
二、miRNA参与调控POI 的途径
1.miRNA在颗粒细胞中参与调控POI:卵巢颗粒细胞是卵巢的主要功能细胞,miRNAs通过调控颗粒细胞的生物功能参与POI的发生。研究发现,POF模型小鼠卵巢颗粒细胞中miR-181b、miR-15a和miR-30d表达显著升高,其中miR-15a表达升高最为显著;荧光素酶报告证实miR-15a的靶基因为Last1,当miR-15a表达升高时,抑制Hippo-YAP/TAZ通路及效应器Lats1的表达,抑制颗粒细胞的增殖,促进颗粒细胞凋亡,促进POF发生[6]。在高脂高糖饮食建立的POF小鼠模型中,高糖高脂饮食激活Dab2ip/Ask1/p38-Mapk信号通路,抑制miR-146b-5p表达,诱导γH2A.X磷酸化,诱导卵巢颗粒细胞老化和POF发生[7]。Klotho基因是一种抗衰老基因,位于人类第13条染色体上,其中α-Klotho是一种主要的Klotho蛋白。在环磷酰胺诱导的POF小鼠模型中α-Klotho基因表达显著降低,敲除α-Klotho基因后卵巢中闭锁卵泡数显著增加而正常卵泡数量显著减少,miR-15b表达上调时,内源性α-Klotho基因表达水平降低并激活下游TGF-β1/Smad信号通路,诱导POF发生[8]。研究发现,在牛颗粒细胞中过表达miR-424和miR-503时,Smads家族蛋白7(SMAD7)和激活素A受体ⅡA(ACVR2A)表达显著下降,促进牛颗粒细胞增殖[9]。用微阵列分析生化卵巢功能不全(bPOI)患者颗粒细胞发现,miR-379-5p表达上调,miR-379-5p靶向作用于聚腺苷二磷酸核糖聚合酶1(PARP1)和X射线修复互补缺陷修复基因6(XRCC6)调控颗粒细胞增殖,为bPOI提供表观遗传学依据[10]。miR-127-5p在bPOI患者血浆中表达上调,miR-127-5p直接靶向高迁移率族蛋白 B2(HMGB2)调控颗粒细胞增殖,证实miR-127-5p在POI中有预测价值,HMGB2可作为POI的新候选基因[11]。研究发现,在猪、鼠、羊等不同物种中miR-1306、miR-30d-5p、miR-202-5p、miR361-5p、miR-1275、miR-126*分别靶向作用于转化生长因子-β受体II(TGFβR2)、Smad2、TGFβR2、血管内皮生长因子(VEGFA)、肝受体源蛋白-1(LRH-1)、促卵泡激素受体(FSHR),并调控卵巢颗粒细胞凋亡[12-17]。在化疗诱导的小鼠POF模型中Let-7a表达下调,体外实验将Let-7a模拟物转染到出生后第3天的小鼠卵巢中,发现Let-7a的表达上调抑制跨膜蛋白分子配体(FASL)表达,使化疗诱导的凋亡颗粒细胞数减少,表明Let-7a可能在化疗诱导的卵巢损伤中起关键作用[18]。研究发现,在POI患者血清中miR-483-5p表达显著升高,在人和小鼠颗粒细胞系中过表达FK506结合蛋白(FKBP4)可以抑制miR-483-5p升高,引起的颗粒细胞凋亡[19]。从POI患者血中检测到的差异表达miRNAs可做为预测POI发生发展的非侵入性生物标志物。研究发现,功能性miRNA通过作用于相应靶基因参与调控颗粒细胞自噬,如miR-21a和miR-21-3p分别靶向于自噬小体标志物蛋白轻链3(LC3B-II)和VEGFA,从而影响卵巢功能[20-21]。但尚无研究报道证实这些与颗粒细胞自噬相关的miRNA是否在人卵巢内也有类似功能进而影响POI的发生。在卵巢中与类固醇激素合成和分泌有关的miRNA,如miR-4463和miR-214-3p分别靶向作用于CYP19A1、雌激素受体α(ESR1)和核受体亚家族5A成员(NR5A1),调控雌激素的合成[22-23]。上述与POI相关的miRNAs在卵巢颗粒细胞中的具体调控机制总结见表1。
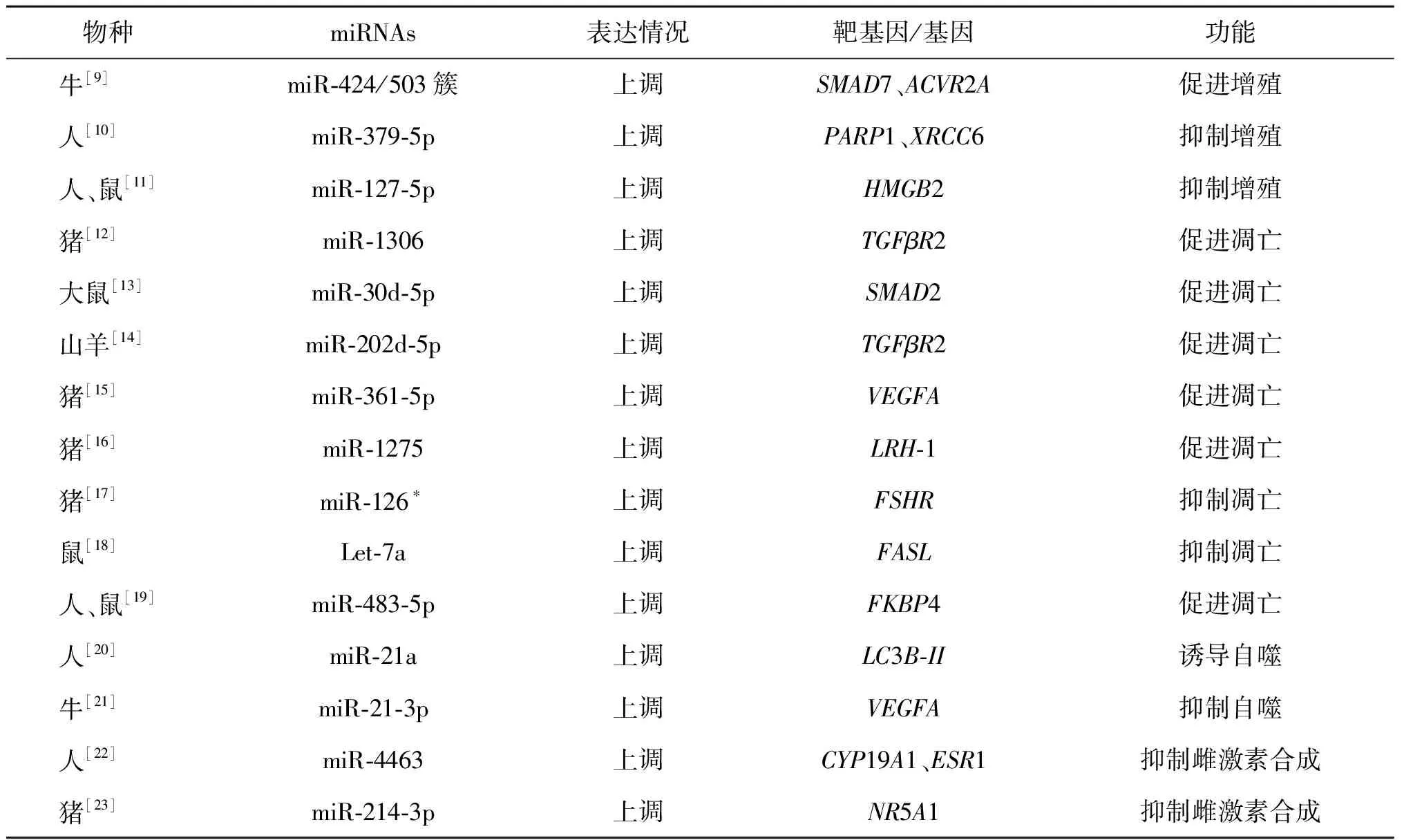
表1 miRNA在颗粒细胞中的调控作用
2.miRNA在卵泡膜细胞中的作用:卵泡膜细胞参与构成卵母细胞和颗粒细胞发育的微环境。在哺乳动物中miRNA参与调节卵泡膜细胞的增殖、分化、合成等功能。牛卵泡膜细胞中miR-221表达水平显著高于颗粒细胞,卵泡膜细胞可能是牛卵泡中miR-221的主要来源,体外实验证实用成纤维细胞生长因子9(FGF9)治疗牛卵泡膜细胞后,卵泡膜细胞中miR-221的表达水平增加,可抑制类固醇激素生成[24]。当鸡卵泡膜细胞中miR-135a-5p的表达受到抑制时,Krüppel样因子4(KLF4)、ATP酶磷脂转运8A1(ATP8A1)和复合蛋白-1(CPLX1)表达水平显著上调,参与调控鸡卵巢卵泡膜细胞的增殖和分化[25]。目前,影响卵泡膜细胞功能的miRNA是否参与调控POI的发病机制的研究报道还比较少。在哺乳动物中被证实的有功能的miRNAs需要继续在人类细胞中进行研究,探讨其在POI中的发病机制。
3.miRNA在卵泡发育中参与调控POI:POI是常见的卵泡发育障碍性疾病之一,POI患者卵巢储备功能降低。卵泡发育是指原始卵泡发育为成熟卵泡的过程,卵泡成熟障碍或卵泡闭锁加速影响卵泡发育,致使卵巢功能下降。多项研究发现,miRNAs调控卵泡发育[26-27]。在小鼠卵泡中用慢病毒转染过表达miR-378后,细胞凋亡相关基因(Bax/Bcl2)表达水平显著增加而卵泡发育相关基因BMP15和GDF9表达显著降低,推测miR-378可能通过调控其靶基因影响卵泡的成熟[28]。在人卵丘细胞中miR-145-5p的表达水平与卵母细胞成熟呈负相关[29]。miR-21过表达促进猪卵母细胞成熟[30]。miR-23a-3p可能靶向调控缝隙连接蛋白43(Gja1)的表达,调控大鼠卵泡发育及闭锁[31]。研究发现,miR-378-3p的表达随着原始卵泡的增多而升高,过表达miR-378-3p后可使原始卵泡百分比增加,敲除miR-378-3p后可使原始卵泡百分比降低,并证实miR-378-3p通过靶向磷酸肌醇依赖的蛋白激酶 1(PDK1)和半胱氨酸蛋白酶(Caspase9),参与调节原始卵泡池的大小,影响POI发生[32]。研究发现,牛闭锁卵泡中miR-21-5p/-3p、miR-150、miR-409a、miR-142-5p、miR-378、miR-222、miR-155和miR-199a-5p的表达水平显著高于健康卵泡,以上这些miRNAs在卵泡膜细胞中的表达水平均显著高于颗粒细胞[33]。在牛卵泡膜细胞中miR-155和miR-222的靶基因为转录因子(ETS1),miR-199a-5p和miR-155的靶基因分别为Jagged1和错配修复蛋白(MSH2),在颗粒细胞中miR-199a-5p、miR-150和miR-378的靶基因为VEGFA[33],上述与卵泡发育过程密切相关的miRNAs及其靶基因可能参与调控 POI的发生发展,但具体调控机制有待深入研究。此外,有研究发现,在自身免疫性POI患者血清中miR-21的表达显著降低,miR-21与E3泛素连接酶(Pellino-1)呈正相关,推测miR-21在卵巢卵泡发生中可能发挥重要作用[34]。
三、miRNA在POI治疗中的潜在价值
目前,国内外学者试图通过调控miRNA来改善患者的卵巢功能。Zhang等[35]研究发现,在POF小鼠模型中注射人羊膜上皮细胞(hAECs)来源的外泌体后小鼠卵泡数量增加且卵巢功能可得到改善,hAECs外泌体通过转移功能性miRNA(如miR-1246)显著抑制化疗诱导的颗粒细胞凋亡。研究发现,从小鼠中分离得到的骨髓间充质干细胞来源的外泌体携带的主要功能性miRNA有miR-644-5p[36]和miR-144-5p[37],其分别作用于p53和磷酸酶(PTEN)基因,从而抑制卵巢颗粒细胞凋亡,改善卵巢功能。Ding等[38]研究发现,人脐带间充质干细胞来源外泌体富集miR-17-5p后,沉默信息调节因子(SIRT7)、基因修复关键基因PARP1、磷酸化的染色体组蛋白H2A(γH2AX)和XRCC6的表达下调,抑制活性氧的积累,改善POF小鼠卵巢功能。综上所述,干细胞来源的外泌体作为POI的新治疗方法,其主要机制是通过miRNA调控颗粒细胞功能从而改善卵巢功能,这为使用miRNA替代直接使用干细胞治疗POI的无细胞治疗方案成为可能。
四、总结和展望
随着基因测序技术及再生医学的发展,miRNAs在POI中的分子调控机制逐渐被认识。其中,miRNAs多态性与POI靶基因表达密切相关,使得miRNA在POI遗传性病因中的调控机制不断被证实。学者们通过体内、外细胞实验发现,在POI患者卵巢中存在差异表达miRNAs,这些miRNAs通过作用于特定的靶基因参与卵泡成熟和闭锁等过程,但它们是否与人POI发生有关有待继续验证。随着与POI相关的功能性miRNAs、靶基因及调控网络不断被发现,证实miRNAs在POI发病机制中扮演重要角色。此外,通过外泌体转移的miRNAs可以通过调控颗粒细胞功能从而改善卵巢功能。以上研究说明,miRNAs在POI发生发展及中起关键作用,与POI密切相关的miRNAs可能成为潜在治疗靶点。
