下肢静脉压升高与血小板活化程度的相关性
2022-09-17刘凯颜京强张鲲齐浩山赵俊成李大林
刘凯,颜京强,张鲲,齐浩山,赵俊成,李大林
(青岛大学附属青岛市市立医院血管外科,山东 青岛 266071)
血小板在止血、炎性反应、血栓形成以及器官移植排斥等生理与病理反应中具有重要作用,而其活化不当可导致许多疾病,如血栓性疾病、出血性疾病、心脑血管疾病、恶性肿瘤、糖尿病、风湿免疫性疾病、运动诱导血小板活化等[1]。目前认为,血小板的异常活化与血管内皮损伤、高血流量剪切力、低氧、血液淤积等诱因密不可分,在动脉压波动及血流剪切力的作用下血小板的活化程度发生了明显的改变[2-3]。而静脉压增高是否会影响血小板活化甚至影响管壁重塑尚未见相关报道。本研究通过建立后肢静脉高压大鼠模型,探讨静脉高压对血小板活化和管壁重塑的影响。
1 材料与方法
1.1 实验动物与分组
选取6~8周龄雄性SD大鼠30只,体质量(282.66±20.23)g,SPF级(杰思捷实验动物实验中心)。适应性饲喂4周后随机分为3组,每组10只。A组为下肢静脉高压+生理盐水灌胃组;B组为假手术组;C组为下肢静脉高压+氯吡格雷灌胃组。
1.2 下肢静脉高压模型制备及各组处理方法
A组、C组应用髂静脉、股静脉缩窄法建立大鼠后肢静脉高压模型:大鼠用6 g/L的戊巴比妥钠(35 mg/kg)腹腔注射麻醉,仰卧位固定于鼠板,备皮后消毒,正中切口进入下腹腔,显微镜辅助下于上1/3处分离右髂外动静脉,在游离段髂外静脉腔外表面置一直径0.25 mm超滑导丝(与之平行),用1号丝线结扎静脉与导丝后,抽出导丝;同法环缩右股静脉,以可吸收缝线分层关腹。B组手术方法同上,但丝线置于管壁周围不作结扎[4]。模型构建成功后,3组大鼠均饲喂于20~24 ℃的恒温环境中,饮水、饲料均一致。C组大鼠以氯吡格雷25 mg/(kg·d)连续灌胃2周,A组和B组大鼠以等量生理盐水连续灌胃2周。
1.3 出血时间检测
将无菌生理盐水加入50 mL的试管中,在37 ℃的水浴中加热1 h。饲喂2周后的SD大鼠尾尖褪毛消毒后剪去远端的10 mm,将尾尖浸泡在37 ℃预温生理盐水中,记录出血时间(从有清晰可见的血流持续流动开始至无明显血流为止)。为了防止实验大鼠因失血过多而死亡,全部出血试验在20 min后停止。
1.4 标本采集
建模2周后,大鼠以6 g/L戊巴比妥钠(35 mg/kg)腹腔注射麻醉,仰卧位并固定四肢于鼠板。备皮后消毒,依次打开胸腹腔,首先以1 mL空针于心脏左心室取血收集于含有柠檬酸钠抗凝管中,后由左心室置灌洗导管于升主动脉并结扎。开放右心耳后,先后以4 ℃的PBS及甲醛进行循环冲洗,待灌洗液澄清后,于右髂外静脉两结扎位点远端取股髂静脉组织,置于40 g/L多聚甲醛固定液中,4 ℃恒温环境中保存待染色。
1.5 检测指标及方法
1.5.1血小板和单核细胞流式细胞术检测 ①血小板:获取血标本马上以1 600 r/min离心10 min,上清即为富血小板血浆(PRP),将PRP以1 000 r/min离心6 min,去除沉淀,将所得上清液再次以5 600 r/min离心5 min即可获得纯化血小板。穿膜处理后按流程孵育抗体(Anti-PF4、ab49735)后,流式细胞仪检测血小板内残余血小板因子4(PF4)含量,以评估血小板活化比例。②单核细胞:获取大鼠循环血后,按照文献方法[5]离心获得单核细胞,抗体孵育后,流式细胞仪检测CD115-CD41双阳性单核细胞,以获得血小板-单核细胞聚合比例(P-M)。以Flowjo V10软件分析获取原始数据。
1.5.2静脉组织Masson和CD115免疫组化染色将静脉标本石蜡包埋、切片后,按照文献方法[6]行CD115免疫组化、Masson染色,以Image J软件进行图像定量分析,观察静脉管壁CD115表达及纤维化面积比例。
1.5.3巨噬细胞迁移实验 制备含血小板条件培养液:选取6~8周雄性C57小鼠15只,随机分3组,各5只。PRP+凝血酶(thrombin)+氯吡格雷(clopi)组以氯吡格雷10 mg/(kg·d)灌胃,PRP组及PRP+thrombin组以等量的生理盐水灌胃,7 d后各组小鼠均内眦取血,所得血样组内合并,各取5 mL两次离心法获得PRP。将PBS及3组PRP分别与无血清DMEM混匀制成体积分数0.05条件培养液。共培养:选取RAW264.7小鼠腹腔巨噬细胞,饥饿24 h后,选用直径6.5 mm、孔径0.5 μm的24孔板,以每孔1×105个细胞的密度种植于4个Transwell小室上方,然后分别加入4种新制备的条件培养液,共培养24 h(其中PRP+thrombin组和PRP+thrombin+clopi组在共培养前30 min按照1∶9的体积比加入激活剂(0.5 mol/L氯化钙+100 kU/L牛凝血酶thrombin),培养后以40 g/L多聚甲醛固定小室,棉签擦掉上方细胞,以1 g/L结晶紫染色观察。拍照后,应用Image J软件进行图像定量分析。
1.6 统计学处理
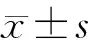
2 结 果
2.1 各组血小板内残余PF4及P-M比较
A组血小板内残余PF4低于B组,C组高于A组和B组,差异有显著性(F=26.40,P<0.01)。3组P-M比较,差异有统计学意义(F=32.77,P<0.01),其中A组最高,B组最低。见表1。
2.2 各组出血时间比较
各组断尾出血时间比较,C组明显长于A组和B组,差异有统计学意义(F=243.10,P<0.01);A组与B组比较,差异无显著性(P>0.05)。见表1。

表1 各组血小板内残余PF4、P-M和断尾出血时间比较
2.3 各组静脉管壁CD115表达及纤维化面积比例比较
各组的静脉管壁CD115表达荧光强度及纤维化面积比例差异有统计学意义(F=32.67、38.68,P<0.01),其中A组CD115表达荧光强度及纤维化面积比例明显高于B组和C组,差异有统计学意义(P<0.01);B组与C组间比较,差异无显著性(P>0.05)。见图1、2和表2。

A、B、C分别为A组、B组、C组。放大200倍。

A、B、C分别为A组、B组、C组。放大200倍。

表2 各组静脉管壁CD115表达及纤维化面积比例比较
2.4 各组巨噬细胞Transwell跨膜迁移数量比较
PBS组、PRP组、PRP+thrombin组、PRP+thrombin+clopi组细胞迁移数分别为(139.0±17.6)、(188.0±13.7)、(323.7±43.5)、(221.0±17.8)个,4组间差异有统计学意义(F=25.70,P<0.01),其中PBS组细胞迁移数少于PRP组,PRP+thrombin组明显多于PRP+thrombin+clopi组,差异有统计学意义(P<0.01)。
3 讨 论
在全球范围内,由血栓问题引起的心脏和外周血管系统的紊乱已经成为危害人类健康的头号杀手[7]。深静脉血栓形成(DVT)是一种临床常见病、多发病,多数是由于血流速度缓慢、血管内皮损伤、血液高凝状态等因素所诱发[8]。早期DVT可以并发肺动脉栓塞(PE),有较高的致死率,存活者若未得到及时治疗,随病情发展其中有20%~50%发展为血栓后综合征(PTS),更有多达5%的病人发展为不可逆性PTS[9],严重影响病人生活质量[10-11]。PTS病情进展的实质是静脉管壁的慢性重塑,这种重塑的首要诱因便是静脉高压[12]。关于静脉高压诱导管壁重塑机制至今仍未完全明确,本文应用大鼠后肢静脉高压模型对血小板活化所引起的管壁纤维化机制进行了初步探索。
1948年CONLEY等学者发现,肝素在循环血小板含量下降的病人体内的敏感度明显增高,推断很有可能是血小板所释放的某种蛋白质对抗了肝素的抗凝性。此后的数年间此种蛋白逐渐被认识并命名为PF4[13]。PF4主要是在巨核细胞内合成,隐藏在α颗粒内部,它的释放是血小板活化及巨核细胞成熟的直观体现[14]。释放入血的PF4作为趋化因子CXC家族的一员,一方面因不具备ELR(Glu-Leu-Arg)结构域造就了其抑制血管新生、抑制内皮细胞增殖、抑制造血的负性功能[15];另一方面,PF4可以通过阻止单核细胞凋亡和介导分化标志物的上调来诱导单核细胞向巨噬细胞的分化[16]以及巨噬细胞的募集[17]。已有研究显示,高血压病人血小板活化和P-M明显升高,且其升高幅度与血压呈正相关[18-19]。本文动物实验显示,术后14 d静脉高压+生理盐水灌胃组大鼠血小板内剩余PF4及P-M明显少于假手术组和静脉高压+氯吡格雷灌胃组,推断血小板的活化和P-M会在静脉性高压作用下异常增高,而静脉高压+氯吡格雷灌胃组血小板内PF4残余高于假手术组,而P-M低于假手术组,均证实氯吡格雷能在一定程度上抑制此类病理过程。
血小板主要通过两种机制介导血管炎症反应。①血小板内部的α颗粒作为趋化因子、细胞因子和生长因子的富集体,在血小板活化时可以向血液循环和血管壁释放大量的炎症递质,促进内皮细胞损伤[20-21]或血管平滑肌细胞增殖[22-23],引起管壁重构。②血小板可以通过血小板-单核巨噬细胞结合促进炎症反应[24]。有研究显示,在心肌梗死、血压过高因素诱导下,血小板和单核巨噬细胞可在心脏组织中富集[25-26]。提示异常活化的血小板与巨噬细胞向周围组织的迁移及慢性炎症浸润关系密切。本研究巨噬细胞Transwell跨膜迁移实验结果显示,PRP组(富血小板血浆条件培养液)迁移细胞数量明显多于PBS组;同时PRP+thrombin+clopi组细胞迁移量少于PRP+thrombin组,提示活化血小板对巨噬细胞的迁移功能有明显的促进作用,氯吡格雷可以通过抑制血小板活化而减弱其对巨噬细胞迁移的趋化作用。
巨噬细胞集落刺激因子受体(M-CSFR)又名集落刺激因子1受体(CSF1R)或CD115。CD115作为蛋白酪氨酸激酶Ⅲ(PTKⅢ)家族中的一员,在哺乳动物中,其主要通过与CSF1和IL-34两种配体之间的相互作用发挥其对巨噬细胞增殖、活化及分化功能的干预[27]。有研究发现,CD115相关信号通路在巨噬细胞介导组织慢性炎症的过程中起到了至关重要的作用[28],因此CD115表达情况可以作为巨噬细胞浸润及其所介导组织慢性炎症程度的重要指标。本研究组织染色结果显示,静脉高压+生理盐水灌胃组术后14 d大鼠后肢股静脉CD115荧光强度和纤维化程度都明显高于假手术组以及静脉高压+氯吡格雷灌胃组,提示在静脉高压的持续作用下,静脉管壁中巨噬细胞的浸润及其所介导的炎症反应均有显著增加,而这种慢性炎症的长期存在,也最终导致了静脉管壁纤维化程度的加重。
噻吩吡啶类药物通过抑制ADP受体达到抗血小板活化作用[29],氯吡格雷作为该类药物的代表,除了有抗血栓形成作用外,在临床上合理应用氯吡格雷也大大降低了支架置入术病人血清中各种炎症细胞因子的水平[30-31]。也有研究表明,长期规律服用氯吡格雷可以减少高血压引起的心肌纤维化[32]。然而,氯吡格雷改善血管炎症的作用机制尚不清楚。有研究发现,血小板活化所释放的PF4参与了巨噬细胞的极化过程[33],并最终增加了巨噬细胞向M1型[34](促炎型)、M4型[35](新型促炎)极化的比例。本文研究结果也显示,氯吡格雷对静脉高压大鼠外周血小板活化、血小板-单核细胞聚合均有抑制作用,更为关键的是氯吡格雷干预显著减少了静脉高压所引起的管壁纤维化,抑制了管壁重塑,推测这很有可能是其通过抑制血小板活化减少PF4释放所带来的结果。
综上所述,静脉压增高可以引起循环血小板以释放PF4的形式异常活化,释放入血的PF4可以通过促进血小板-单核细胞聚合的方式干预单核细胞分化、巨噬细胞迁移和极化,进而引起高压静脉段管壁中巨噬细胞浸润及慢性炎症的加剧,并最终引起纤维化加重。至于PF4具体是通过何种信号通路干预并改变了巨噬细胞的极化,管壁组织中巨噬细胞的极化亚型及比例具体如何,有待进一步探讨。
