超声内镜下胃肠道间质瘤征象与Ki-67指数的相关性
2022-09-17杨雪莲刘华李航李晓宇徐永红
杨雪莲,刘华,李航,李晓宇,徐永红
(青岛大学附属医院消化内科,山东 青岛 266003)
胃肠道间质瘤(GIST)是消化道最常见的间叶源性肿瘤,占消化道肿瘤的0.1%~3.0%,其生物学行为复杂,有潜在恶性倾向[1-3]。Ki-67是一种增殖细胞核抗原,与肿瘤细胞增殖密切相关[4-5]。有研究结果显示,Ki-67指数可以用于评估GIST的恶性潜能[6-7]。GIST常用的检查方法有CT、普通内镜和超声内镜(EUS)。当肿瘤较大(>5 cm)或消化道出血时,CT为首选检查方式[8]。CT对胃GIST的识别受胃的充盈度的影响,检出率较低[9]。普通内镜只能观察GIST的黏膜形态,无法确定其起源层次。EUS不仅可以观察病变的形态,还可以确定肿瘤的起源、是否有钙化及液化等特征。因此,EUS对GIST的检出率优于CT[10]。目前有学者通过探讨CT征象与Ki-67指数的相关性来评估GIST的恶性潜能。但尚无EUS征象与Ki-67指数的相关性研究。本研究通过分析上消化道GIST的EUS征象、病理与Ki-67指数的关系,探讨EUS征象、Ki-67指数对评估GIST恶性潜能的价值。
1 资料和方法
1.1 一般资料
收集2012年6月—2019年10月就诊于我院的原发性上消化道GIST病人,根据纳入、排除标准,最终有196例病人纳入研究。纳入标准:①经手术或内镜下切除获得标本且经病理学检查确诊为GIST;②相关临床资料及EUS图像资料齐全;③术后病理资料及免疫组化资料齐全;④行EUS检查前或手术前未接受过任何治疗。排除标准:①合并其他恶性肿瘤;②术前及行EUS检查前已发生远处转移;③标本由EUS引导下细针穿刺活检获得。本文研究经我院医学伦理委员会批准。
1.2 EUS检查
应用EUS(Olympus UM-DP20-25R或者GF-UCT260),观察并记录GIST的EUS征象,包括生长方式(管腔内生长、管腔外生长、混合性生长)、起源层次(固有肌层、黏膜肌层、黏膜下层、起源不清)、异质性(回声均匀、回声不均匀)、肿瘤边界(边界规则、边界不规则)、回声模式(低回声、混合回声、高回声),肿瘤发病部位(胃、食管、十二指肠)、钙化(是、否)、表面溃疡(是、否)、黏膜桥(是、否)和液化(是、否)。EUS图像由两名具有10年以上经验的内镜医师阅读并记录。如有争议,则与第三位更高年资内镜医师进行讨论并得出结论。
1.3 危险分级
采用2008年改良版NIH危险分层标准,根据肿瘤大小、肿瘤部位、核分裂象数以及肿瘤破裂情况,将所有病例分为极低危组、低危组、中危组和高危组[11]。
1.4 统计学分析
2 结 果
2.1 GIST病人临床病理特征和EUS征象
本文196例GIST病人中,男88例(44.9%),女108例(55.1%),男女之比为1∶1.2;年龄21~83岁,平均(58.8±9.3)岁。肿瘤直径5.0~70.0 mm。188例(96.0%)GIST原发于胃,1例(0.5%)位于食管,7例(3.5%)来源于十二指肠。根据2008年改良版NIH危险分层标准,高危组6例(3.0%),中危组25例(12.8%),低危组100例(51.0%),极低危组65例(33.2%)。Ki-67指数>5%者30例(15.3%),Ki-67指数≤5%者166例(84.7%)。核分裂象数>5者共23例(11.8%),核分裂象数≤5者共173例(88.2%)。EUS检查显示,116例(59.2%)GIST内部回声不均质,32例(16.3%)有表面溃疡,有36例(18.3%)发生液化,47例(24.0%)内部钙化,19例(9.6%)边界不规则,31例(15.7%)有黏膜桥。
2.2 Ki-67指数与GIST临床病理特征的相关性
单因素分析结果显示,不同肿瘤直径、核分裂象数和危险分层GIST的Ki-67表达差异有显著意义(t=-5.411,χ2=27.322~37.975,P<0.05),且Ki-67指数与核分裂象数、肿瘤直径和危险分层正相关(r=0.259~0.373,P<0.05)。不同年龄、性别病人Ki-67指数差异无显著性(P>0.05)。见表1。
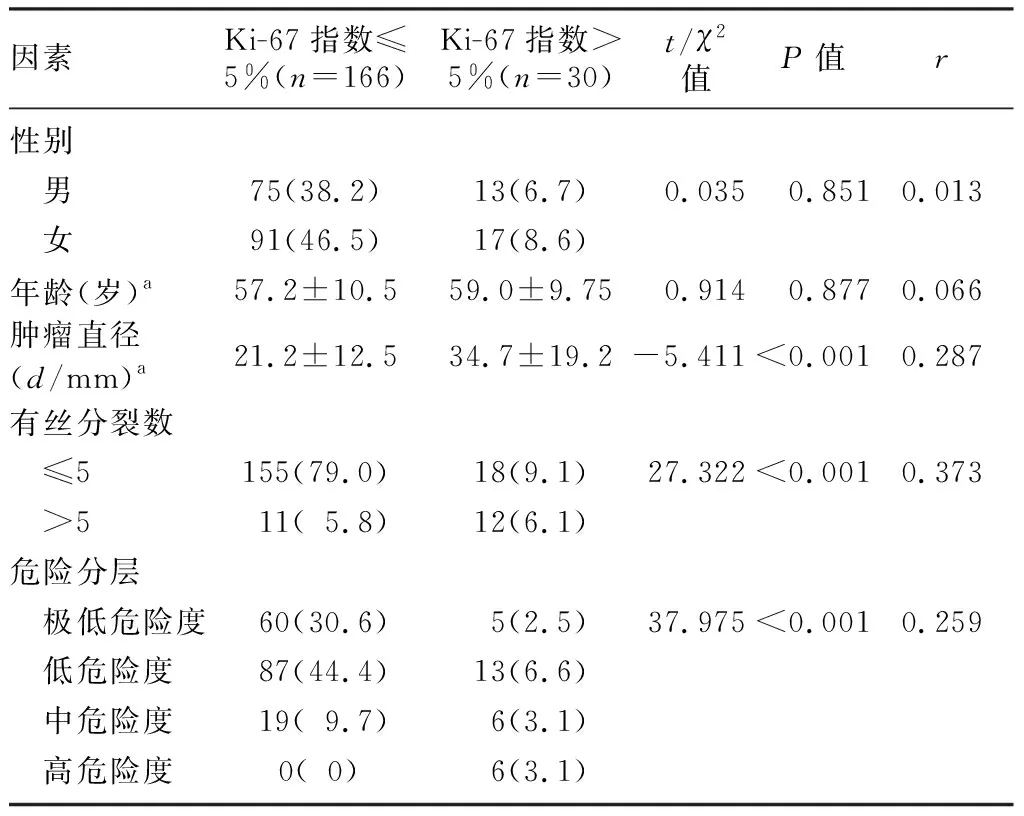
表1 Ki-67指数与GIST临床病理特征相关性(例(χ/%))
2.3 EUS征象与Ki-67指数的相关性
单因素分析显示,Ki-67指数≤5%和Ki-67指数>5%病人GIST的瘤体内部是否均质(χ2=4.482,P<0.05)、有无液化(χ2=18.920,P<0.01)和有无表面溃疡(χ2=18.912,P<0.01)差异有显著性;不同Ki-67指数病人肿瘤的生长方式、有无黏膜桥、有无钙化、起源层次、边界是否规则、肿瘤发生部位和回声模式差异无统计学意义(P>0.05)。GIST肿瘤液化、表面溃疡与Ki-67指数呈中度正相关(r=0.311、0.309,P<0.05),GIST肿瘤回声不均质性则与Ki-67指数呈低度正相关性(r=0.151,P<0.05)。见表2。将在单因素分析中差异具有统计学意义的EUS征象作为自变量纳入二元logistic回归分析。因变量赋值如下:Ki-67指数≤5%赋值=0、Ki-67指数>5%赋值=1。自变量赋值:①表面溃疡:否=0,是=1;②液化:否=0,是=1;③异质性:回声均匀=0,回声不均匀=1。分析结果显示,肿瘤直径(OR=1.045,95%CI=1.011~1.080,P<0.05)、肿瘤液化(OR=3.219,95%CI=1.116~9.287,P<0.05)及表面溃疡(OR=3.009,95%CI=1.094~8.275,P<0.05)是预测Ki-67表达的独立危险因素。见表3。

表2 EUS征象与Ki-67指数的相关性(例(χ/%))
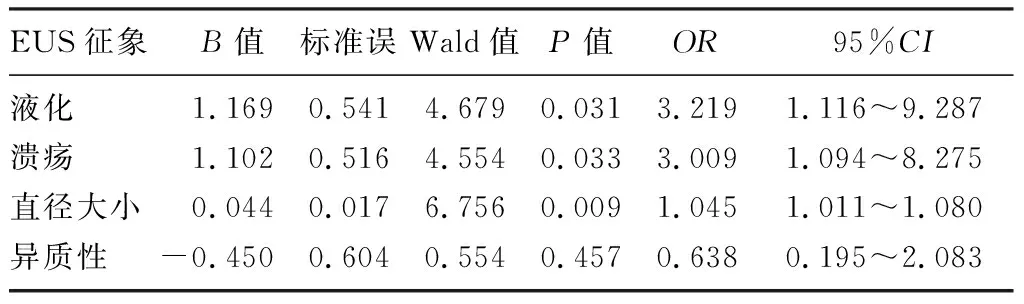
表3 二元logistic回归分析
2.4 列线图的建立与验证
基于二元logistic回归分析结果建立预测Ki-67表达水平的列线图模型,找出各EUS征象对应轴上的点,过该点做横轴的垂线,垂线在评分标尺上所对应的数值则为该EUS征象的分数。各项EUS征象的分数相加即得总分,总分在风险值上对应的数值为Ki-67指数>5%的风险概率(图1)。列线图模型预测Ki-67表达水平的曲线下面积(AUC)为0.739(95%CI=0.619~0.858)(图2)。用Boot-strap自抽样方法对列线图模型验证,重复抽样及内部验证过程1 000次,得到校准曲线(图3),结果显示该列线图模型预测Ki-67指数>5%的风险与实际Ki-67指数>5%的风险一致性良好。
3 讨 论
GIST是胃肠道最常见的间叶源性肿瘤,可以发生于任何年龄,60岁及以上的老年人多见,男女患病率相同[12]。GIST好发于胃(50%~60%),其次为小肠(20%~30%)、结直肠(5%~10%)、食管(5%),少见于腹腔内其他部位[13]。本研究中病人年龄范围为21~83岁,平均(58.8±9.3)岁,男女之比为1∶1.2,与上述研究结果一致。因本研究主要探讨上消化道GIST(包括胃、食管、十二指肠)的EUS征象与Ki-67指数的相关性,188例(96.0%)肿瘤原发部位为胃,仅1例(0.5%)位于食管,7例(3.5%)来源于十二指肠,考虑本研究样本量少,因此胃GIST的比例高。

图1 预测Ki-67>5%风险的列线图模型 图2 列线图模型的ROC曲线 图3 列线图模型的校正曲线
GIST在生物学行为上可从良性发展到恶性,侵袭性较难评估[14-15]。目前主要采用2008年改良版的NIH分级标准评估其恶性潜能,该分级标准包括肿瘤大小、肿瘤部位、核分裂象数和肿瘤是否破裂等[11]。核分裂象数被认为是预测GIST恶性潜能最重要的参考指标[16]。但即使处于同一危险分级,病人的复发风险和预后也不尽相同。Ki-67为一种高表达于肿瘤细胞的DNA结合核蛋白,除了G0期,在细胞增殖的G1、S、G2和M期均可检测到[7]。与仅代表有丝分裂M期的核分裂象数相比,Ki-67指数是评价细胞增殖活性更全面的指标,可更好地评估肿瘤细胞的增殖能力[17-18]。
近年来,大量国内外研究均发现Ki-67可作为预测GIST恶性程度可靠并且独立的标志物[19-20]。ZHAO等[21]研究显示,Ki-67指数≤5%是GIST肿瘤无复发生存的重要预后因素。JEONG等[17]发现,Ki-67指数>5%病人的GIST复发风险高于Ki-67指数≤5%病人,5%可能是Ki-67评估GIST危险分级及预后的重要临界值。本研究将196例病人分为Ki-67指数>5%和Ki-67指数≤5%两组进行比较,结果显示GIST病人的Ki-67指数与核分裂象数同为高值或同为低值者167例(85.2%),Ki-67指数在不同核分裂象数组间差异有显著性,且与核分裂象数呈中度正相关。与相关研究GIST的Ki-67高表达与高核分裂象数有关的结论一致[22]。有研究显示,GIST病人Ki-67的表达水平与危险分层呈正相关[23-24]。本研究结果示,Ki-67的表达水平从低危险分层到高危险分层逐渐升高,Ki-67指数越高,肿瘤的危险分层越高,恶性潜能越大。本研究还显示,有18例(9.2%)GIST病人核分裂象数≤5,其中8例为极低危,7例为低危,2例为中危,1例为高危,而18例病人的Ki-67指数均>5%,提示Ki-67指数可作为修改后的NIH分层标准的有效补充。
本文研究又进一步探讨了上消化道GIST的EUS征象与Ki-67指数的关系,结果显示Ki-67指数≤5%组的肿瘤平均直径小于Ki-67指数>5%组,差异有统计学意义,提示随着肿瘤直径的增大,Ki-67表达水平升高,恶性程度升高。JIANG等[25]研究显示,随着肿瘤直径的增大,GIST病人的Ki-67表达率升高,恶性程度升高。LI等[26]研究显示,GIST的肿瘤表面溃疡、肿瘤液化与Ki-67的高表达有关,为评估Ki-67表达的独立危险因素。本研究结果显示,Ki-67指数>5%病人的肿瘤溃疡、液化的发生率较Ki-67指数≤5%病人更高,且肿瘤直径、表面溃疡、肿瘤液化是预测Ki-67表达的独立危险因素。与上述研究结果一致。BELEV等[27]研究显示,GIST肿瘤回声不均质为预测Ki-67指数的独立危险因素。本文研究单因素分析显示,肿瘤是否均质这一超声特征在Ki-67指数>5%和Ki-67指数≤5%两组间差异有统计学意义,但回归分析显示其并不能作为预测Ki-67指数的独立危险因素,考虑肿瘤回声是否均匀主要依靠内镜医师的主观判断,易受其内镜知识以及肉眼鉴别能力的影响,不同研究可有一定偏差。本文结果还显示,不同Ki-67指数分组GIST的发生部位、钙化、边界、起源层次、黏膜桥和回声模式等差异无统计学意义,不能作为预估GIST的Ki-67水平及恶性潜能的参考指标。
列线图预测模型可较直观地展示各指标对于预测值的影响,已广泛应用于肝癌、肺癌、宫颈癌等多种恶性肿瘤的风险预测及预后的评估。目前,较多的是采用CT放射组学联合临床病理特征建立列线图模型评估GIST的Ki-67水平,而应用EUS的征象建立列线图模型的研究则较少。本研究根据二元logistic回归分析结果,筛选出可影响Ki-67表达的3个EUS征象(肿瘤直径、表面溃疡、肿瘤液化),建立列线图来预测上消化道GIST的Ki-67表达水平。结果显示,该列线图模型ROC曲线的AUC为0.739(95%CI=0.619~0.858);校正后的曲线较趋近于理想曲线,证明该列线图模型对预测Ki-67表达的准确性及一致性均良好。
综上所述,上消化道GIST的Ki-67指数越高,细胞增殖活性越大,肿瘤的危险分层越高。Ki-67指数可作为修改后的NIH分层标准的补充指标。上消化道GIST的EUS征象肿瘤直径、表面溃疡、肿瘤液化为预测其Ki-67表达的独立危险因素。基于上述EUS特征建立的列线图模型对于预测上消化道GIST的Ki-67表达水平具有较好的准确性及一致性,可为术前评估其恶性潜能提供参考依据。
