无症状性颈动脉狭窄病人支架成形术前后Lp-PLA2动态变化及其与相关危险因素的关系
2022-09-17荣婷滕文慧丁鸿斐姜英李广文王乃东
荣婷,滕文慧,丁鸿斐,姜英,李广文,王乃东
(青岛大学附属医院神经介入科,山东 青岛 266003)
无症状性颈动脉狭窄(ACAS)是指既往6个月内未发生颈动脉狭窄所致的卒中或短暂性脑缺血发作等临床症状的颈动脉狭窄,仅部分病人存在轻微头痛或头晕。在≥80岁男性中,ACAS的发病率约为10.6%,男性发病率高于女性[1]。因其起病隐匿,故而易被忽视。ACAS最常见的病理基础是动脉粥样硬化(AS)[2],多种炎症递质,如血浆脂蛋白相关磷脂酶A2(Lp-PLA2)、低密度脂蛋白(LDL)等参与了AS的形成与发展[3]。Lp-PLA2主要由巨噬细胞、淋巴细胞合成和分泌,参与LDL代谢为溶血磷脂酰胆碱(lyso-PC)、氧化型游离脂肪酸(ox-FFA)的过程[4],通过诱导加强氧化应激反应、破坏血管内膜完整性等机制,在AS的几个主要阶段中都起到重要作用[5]。在ACAS病人行支架成形术和球囊扩张术的过程中AS斑块可能会破裂,在这些易损斑块中,可检测到Lp-PLA2高表达[6]。然而,在介入手术过程中Lp-PLA2的动态变化未见文献报道。故本研究拟探讨ACAS支架成形术前后Lp-PLA2活性的动态变化,并分析Lp-PLA2活性与LDL、高密度脂蛋白(HDL)和超敏C反应蛋白(hs-CRP)的相关性。现将结果报告如下。
1 资料与方法
1.1 对象与分组
选取2019年6月—2021年3月在青岛大学附属医院神经介入科住院,依据2011年美国卒中协会推荐的颈动脉诊治指南[7]诊断为ACAS的病人。依据所实施的介入手术治疗方式,将入选ACAS病人分为单纯造影组37例、支架成形组54例、球囊扩张组28例;3组病人在术前均接受了正规的治疗,术中均皮下注射低分子肝素钙。以同期我院体检中心的55例健康体检者作为健康对照组。研究对象共174例,其中男性90例,女性84例;平均年龄为(66.32±2.87)岁。
1.2 纳入与排除标准
纳入标准:①单纯造影组、支架成形组和球囊扩张组病人在颈动脉超声检查中发现颈动脉狭窄程度大于70%;②对照组为同期健康体检者,颈动脉狭窄小于50%。排除标准为:①严重的肝肾疾病(或者转氨酶超过正常上限值3倍,血清肌酐清除率<30 mL/min);②急性感染性疾病(如重症肺炎、急性阑尾炎等);③自身免疫性疾病;④心肌病、心脏瓣膜病、严重的心力衰竭(NYHA Ⅲ~Ⅳ级)等器质性心脏病;⑤恶性肿瘤及病情危重长期卧床者;⑥重度意识障碍、痴呆以及精神障碍者;⑦出血性脑卒中,梗死后出血;⑧各种凝血机制异常、血液系统疾病及高黏血症所致的脑梗死,先天发育异常所致的脑梗死;⑨有血管内支架置入术、动脉造影术和球囊扩张术的禁忌证;⑩依从性差,病人以及家属不配合者。
1.3 研究方法
收集所有研究对象的基线临床资料,包括年龄、性别、冠心病史、糖尿病史、高血压史、吸烟史、饮酒史以及血浆LDL、HDL、总胆固醇(TC)、三酰甘油(TG)、hs-CRP、Lp-PLA2等生物标志物的水平。所有研究对象均在清晨空腹状态下,采集肘静脉血10 mL,分别置于常规生化管和EDTA抗凝管中(各5 mL)。常规生化管用于检测LDL、HDL、TC、TG、hs-CRP,其中,hs-CRP用乳胶增强免疫比浊法测定,剩余生物标志物用全自动生化分析仪测定。EDTA抗凝管离心(3 000 r/min、30 min)后,取上清液置于EP管中,-80 ℃保存待测Lp-PLA2活性。Lp-PLA2活性测定采用酶联免疫吸附试验双抗体夹心法。另外,单纯造影组、球囊扩张组、支架成形组分别于术后2 h内、1 d、3 d、15 d各采集肘静脉血4 mL,同法检测血浆Lp-PLA2活性。先比较各组基线临床资料,再比较支架成形组、球囊扩张组、单纯造影组术前以及术后2 h内、1 d、3 d、15 d血浆Lp-PLA2活性变化,分析支架成形组病人血浆Lp-PLA2活性与LDL、HDL、hs-CRP的相关性。
1.4 统计学方法
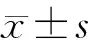
2 结 果
2.1 各组基线临床资料的比较
单纯造影组、球囊扩张组、支架成形组病人有高血压史、吸烟史者的比例均高于健康对照组(χ2=15.35、13.27,P<0.05);4组年龄、性别、冠心病史、糖尿病史、饮酒史等一般资料比较差异无统计学意义(P>0.05)。球囊扩张组、支架成形组病人血清LDL、hs-CRP水平明显高于单纯造影组和健康对照组,且支架成形组高于球囊扩张组,单纯造影组高于健康对照组(F=30.08、32.90,P<0.05)。球囊扩张组、支架成形组、单纯造影组病人血清HDL水平均低于健康对照组,且球囊扩张组、支架成形组低于单纯造影组和健康对照组,支架成形组低于球囊扩张组(F=30.29,P<0.05)。4组TC、TG水平比较差异均无统计学意义(P>0.05)。见表1。
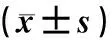
表1 各组基线临床资料相关指标的比较
2.2 各组不同时间血浆Lp-PLA2活性的比较
术前24 h内,健康对照组血浆Lp-PLA2活性为(119.58±22.54)μg/L,单纯造影组、球囊扩张组、支架成形组病人血浆Lp-PLA2活性均高于对照组,差异有统计学意义(F=36.87,P<0.05);而行介入手术治疗3组组间比较差异无显著性(P>0.05)。术后2 h内,行介入手术治疗3组组间比较差异无统计学意义(P>0.05)。支架成形组、球囊扩张组术后1、3 d的血浆Lp-PLA2活性均较同组术前升高,术后15 d较术前下降(F时间=212.96,P<0.05);支架成形组、球囊扩张组术后1、3、15 d时的血浆Lp-PLA2活性均较单纯造影组明显升高(F组间=8.83,P<0.05),支架成形组与球囊扩张组比较则差异无显著性(P>0.05)。见表2。

表2 各组不同时间血浆Lp-PLA2活性的比较
2.3 Lp-PLA2与LDL、HDL、hs-CRP的相关性
将单因素分析中差异有统计学意义的LDL、HDL、hs-CRP与血浆Lp-PLA2活性进行Pearson相关分析,结果显示,支架成形组病人的血浆Lp-PLA2活性与LDL、hs-CRP水平呈正相关(r=0.72、0.66,P<0.05),与HDL水平呈负相关(r=-0.63,P<0.05)。
3 讨 论
脑卒中是导致人类残疾最常见的脑血管疾病之一。有研究结果显示,ACAS占脑卒中发病原因的20%~25%[8]。针对ACAS的最佳治疗方式,目前尚无定论。一项长达15年的随访研究表明,支架成形术在预防脑卒中和降低再狭窄率、复发率和死亡率方面效果尚可[9]。目前,支架成形术的保护装置已经相对完善,安全性已经与内膜剥脱术相当[10],其疗效优于内膜剥脱术[11],再狭窄率也低于内膜剥脱术,且具备内膜剥脱术没有的优点,如微创、无需阻断体内循坏、病人耐受性好、适应证较广、能较大程度改善病人术后认知功能等[12]。
ACAS的形成过程,与Lp-PLA2等多种炎症因子有关,这些炎症因子可作为ACAS诊断、治疗等的炎性标志物[13]。包括鹿特丹研究在内的众多研究结果表明,ACAS与心血管疾病危险因素几乎是一致的[14],高脂血症、高血压、糖尿病、吸烟等传统因素引起的AS是造成ACAS的主要原因[15],其他常见原因还有颈动脉夹层分离、Takayasu大动脉炎和放疗等[16]。事实上,在临床中,很多ACAS病人没有上述危险因素的存在,但潜在患病风险仍然导致病人出现了AS和ACAS。因此,寻找颈动脉狭窄新的生物标志物和潜在的干预靶点、提高疗效,已经成为学界关注的重点,这些新的生物标志物中就包括Lp-PLA2[17]。
Lp-PLA2为磷脂酶A2超家族中的一员,是一种非Ca2+依赖性的丝氨酸酯酶,由441个氨基酸组成,分子量为45 000。在血浆中80%的Lp-PLA2与LDL结合,发挥致炎作用,其余的20%与HDL结合,发挥抗炎作用[18-19]。Lp-PLA2是一种主要由成熟巨噬细胞、淋巴细胞合成和分泌的炎症递质,可水解氧化型低密度脂蛋白(ox-LDL),生成ox-FFA、lyso-PC两种较强的致炎物质,ox-FFA和lyso-PC通过氧化应激反应损伤内皮细胞,诱导黏附因子表达,促进巨噬细胞吞噬ox-LDL成为泡沫细胞,同时刺激血管平滑肌细胞增殖,促进AS斑块形成,还能引起多种炎性因子释放,刺激AS斑块内产生更多的Lp-PLA2,形成恶性循环[20],加速颈动脉狭窄的发生和进展。Lp-PLA2与HDL结合,可水解血小板活化因子,被认为具有抗炎作用,因而又被称为血小板活化因子乙酰水解酶(PAF-AH)[21]。近年来,将Lp-PLA2视为颈动脉狭窄的独立危险因素和大AS斑块破裂生物标志物的研究越来越多[22]。而探讨ACAS支架成形术后Lp-PLA2的活性变化,以及ACAS中Lp-PLA2与其他因子(如LDL、HDL等)的关系也很有必要。
本研究旨在观察ACAS病人在血管成形术破坏斑块稳定性以后血浆Lp-PLA2活性的动态变化,探讨ACAS病人Lp-PLA2活性与LDL、HDL、hs-CRP等传统危险因素的关系。结果显示,单纯造影组、球囊扩张组和支架成形组病人术前血浆Lp-PLA2活性均显著高于对照组。其原因可能为:Lp-PLA2催化生成的促炎产物(如ox-FFA和lyso-PC)涉及AS和缺血性心脑血管疾病的各个阶段[23],与易损性AS斑块密切相关[24]。在稳定性比较好的AS斑块内,Lp-PLA2活性较低[25]。支架成形术组术后各时间点血浆Lp-PLA2活性与球囊扩张组相比,差异均无统计学意义。提示支架对Lp-PLA2活性的影响不是很大,Lp-PLA2活性动态变化极大可能与球囊扩张术和支架成形术改变斑块稳定性、诱发斑块内核细胞释放Lp-PLA2入血,继而诱发炎症级联反应有关。本研究中,ACAS病人在行球囊扩张术、支架成形术后2 h内,循环中Lp-PLA2活性水平即较术前升高,但差异无显著性,在术后2、3 d时Lp-PLA2活性较术前显著升高,而术后15 d时较术前有所下降,可能与AS斑块稳定性恢复、服用阿司匹林等药物等有关。此结果与心肌梗死病人行经皮冠状动脉介入治疗术后检测到的Lp-PLA2活性动态变化趋势一致[26-27]。在斑块稳定性良好的单纯造影组病人中,术后Lp-PLA2活性与术前相比无明显改变,表明Lp-PLA2活性的动态变化和造影无关。本研究之所以排除脑梗死病人,只纳入ACAS病人,主要是考虑到脑梗死对血浆Lp-PLA2活性的影响[28]。在ACAS中,Lp-PLA2的致炎、致AS亦或是抗炎、抗AS的作用主要取决于Lp-PLA2和哪一种脂质蛋白结合,有研究发现,Lp-PLA2的结合可以在LDL与HDL之间发生转移,这使得Lp-PLA2生物学功能更加多样化[4]。hs-CRP是机体受到微生物入侵或者组织损伤等炎症性刺激时肝细胞合成的一种非特异性的急性蛋白,可以经内皮素、一氧化氮、白细胞介素-6等途径引发AS。本文研究结果显示,hs-CRP水平与Lp-PLA2活性变化趋势一致,二者呈正相关。结合既往文献报道,考虑hs-CRP可能参与了Lp-PLA2活性调节以及HDL和LDL的含量调控,并可能通过激活炎症反应加剧AS病情的进展[29]。然而,hs-CRP对Lp-PLA2活性调节的具体机制仍需进一步探索。
本研究的不足之处为不能实时监测循环中的Lp-PLA2活性,且本研究为单中心临床研究,因此,结论存在一定的局限性,希望今后能找到更好的检测方法进一步深入研究。
综上所述,颈动脉球囊扩张术、支架成形术术后Lp-PLA2活性一过性升高可能与破坏AS斑块稳定性以及诱发炎症反应等有关,ACAS病人的血浆Lp-PLA2活性与HDL、LDL和hs-CRP水平相关。检测血浆中的Lp-PLA2活性,可指导临床进一步干预措施,值得推广应用。
