昆虫几丁质合成关键酶功能及其RNAi技术在害虫防治中的研究进展
2022-09-15许静静李思琪任梦圆薛雨欣李永强
许静静,李思琪,任梦圆, 薛雨欣,李永强
(西北农林科技大学 植物保护学院, 农业部西北黄土高原作物有害生物综合治理重点实验室, 陕西 杨凌 712100)
几丁质是昆虫体内一种天然含量仅次于纤维素的氨基多糖[1],主要存在于昆虫表皮、气管和围食膜中,起支撑和渗透屏障的作用,使虫体减少或免于机械损伤和毒素及病原菌的侵染[2~3],因此对昆虫的正常生长发育有着至关重要的作用[3]。由于植物和脊椎动物体内不含几丁质,调控几丁质合成与代谢相关酶便为新型高效杀虫剂的设计和开发提供了潜在的优良靶标。针对这些关键酶的化学抑制剂以及基于RNA干扰(RNA interference, RNAi)技术的害虫防控新途径的研究和开发,一直是近些年农业害虫防治领域的研究前沿和热点[2,4]。苯甲酰基脲类是上个世纪70年代初研究最早、最具代表性的一种昆虫几丁质合成抑制剂,通过结构的不断修饰,已有多个品种实现了商品化[5]。近年随着RNAi技术介导的害虫防治策略的提出[6],凭借其专一性强、潜在靶标多、环境安全等诸多优点,其在害虫防控方面的研究和应用不断取得进展。本文对近些年利用RNAi技术针对几丁质合成关键酶在害虫防控研究及应用中的重要进展、存在问题及潜在的解决途径进行了较为系统的总结和归纳,期望为利用RNAi技术进行害虫防治研究提供有价值的理论指导。
1 几丁质结构与功能
几丁质是N-乙酰氨基葡萄糖组成的线性聚合物,其化学结构与植物纤维素相似,因此也被称为动物纤维素[7]。通过X射线分析发现,几丁质具有α、β和γ三种晶体类型,α晶型中几丁质链以反向平行的方式排列,β晶型中以平行的方式排列,γ晶型则以平行和反向平行交替的方式排列。由于几丁质链反向平行排列产生了大量的氢键,形成的紧密微纤维有助于提高机械强度和稳定性,因此α晶型主要存在于昆虫的体壁中。相比之下,β晶型和γ晶型链间氢键较少、紧密度较低,但二者能与水形成大量氢键,使形成的微纤维更具有可塑性和柔软性,因此其主要存在于昆虫围食膜等中[8]。
几丁质主要与蛋白质等共同形成昆虫的表皮及围食膜,从而起到保持昆虫形态和渗透屏障的作用[3]。但几丁质形成的坚硬体壁在阻碍外源物侵害的同时,也阻碍了昆虫的生长发育。因此,昆虫必须进行几丁质有规律的合成与代谢,保证周期性的正常蜕皮,以适应正常生长发育的需求[9]。在研究果蝇的几丁质合成酶1突变中发现,几丁质的正常合成对表皮的完整性、形态的维持至关重要,同时还发现几丁质合成酶1还参与了角质层色素的沉着过程[10]。而有些昆虫在饥饿或蜕皮时,围食膜可能完全停止形成,直至昆虫再次取食时,并排出旧的围食膜或重吸收产生新的围食膜[3],因此昆虫的生长发育严格依赖于体内几丁质的含量。有研究表明,昆虫蜕皮的干物质中几丁质含量高达40%,而围食膜中的几丁质含量通常在3%~13%之间[3]。
2 几丁质合成途径关键酶
2.1 海藻糖酶
海藻糖酶(Trehalase,Tre)是几丁质生物合成的第一个催化酶,也是昆虫体内唯一一类水解海藻糖的非还原性酶[11],参与昆虫的几丁质的合成和能量代谢过程[12]。昆虫Tre属于糖苷水解酶家族,理论分子量约为63.4~74.2 kD,理论等电点为酸性(4.66~6.23),含有两个氨基酸标签序列:“PGGRFREFYYWDSY”和“QWDYPNAWPP”,以及一个甘氨酸富集区“GGGGEY”。昆虫含有两种海藻糖酶,即可溶性海藻糖酶(Tre1)和膜结合型海藻糖酶(Tre2)。将部分已知昆虫Tre的氨基酸序列利用MEGA6软件中的Align功能进行比对,再通过Neighbor-Joining进行系统进化分析,可以得到已知的昆虫Tre基因的系统进化树(图1)。从该系统发育树可以看出,不同目昆虫的Tre基因均聚为两大类,即Tre1和Tre2。同一种昆虫中二者之间氨基酸序列相似性较低,但二者在不同昆虫中却分别存在较高的相似性。例如鳞翅目昆虫的Tre1和Tre2在系统发育树上各聚为一大类,表明二者之间同源性较低;而同属鳞翅目昆虫的草地贪夜蛾、斜纹夜蛾和甜菜夜蛾的Tre1在系统发育树上所处的位置却较近,表明序列同源性较高(图1)。
通过RNAi技术对海藻糖酶功能进行研究,结果表明Tre1主要与昆虫表皮中几丁质含量高低有关,而Tre 2主要与昆虫围食膜几丁质含量高低有关[13-14],二者的基因沉默会直接影响昆虫的正常生长发育。Chen等[14]通过显微注射法对甜菜夜蛾海藻糖酶SeTre1和SeTre2进行RNAi研究发现,基因转录水平降低60%和80%,且注射dsSeTre1的昆虫角质层几丁质含量显著下降约30%,注射dsSeTre2的昆虫中肠几丁质含量下降约25%。张倩等[13]通过饲喂法干扰灰飞虱海藻糖酶LSTre1和LSTre2,基因转录水平分别降低49%和41%,并导致昆虫体重减轻、死亡率显著升高。由此可见,通过dsRNA干扰海藻糖酶,打破了几丁质合成的平衡可能是导致昆虫蜕皮困难甚至死亡的主要原因[15]。

图1 部分已知昆虫海藻糖酶的系统进化树
2.2 几丁质合成酶
几丁质合成酶(Chitin synthetase,CHS)是几丁质生物合成的最后一个催化酶。大多数昆虫含有两种几丁质合成酶,即几丁质合成酶1(CHS1)和几丁质合成酶2(CHS2)[16],但在褐飞虱、豌豆蚜和大豆蚜等半翅目昆虫中,只发现了CHS1。将部分已知昆虫CHS的氨基酸序列使用MEGA6软件进行同源比对,再使用Neighbor-Joining法进行系统进化分析,从而得到昆虫CHS基因的系统进化树(图2)。从CHS系统发育树可以看出,昆虫的CHS基因也被分成了两大类,即CHS1和CHS2。例如,所有的半翅目昆虫的CHS1形成了一个亚分支,其中桔蚜、大豆蚜和豌豆蚜CHS1同源性较近(图2)。几丁质合成酶是高度保守的大分子跨膜蛋白,属于糖基转移酶家族,理论分子量约为160 ~180 kD,具有约14 ~17个跨膜螺旋,理论等电点偏酸性(5.43~7.08)。CHS含有3个结构域,分别为A、B、C结构域。其中位于中心的结构域B相对较为保守,含有两个特有的识别序列“EDR”和“QRRRW”。
通过RNAi技术对几丁质合成酶的功能进行研究,结果表明CHS1主要负责昆虫的表皮中几丁质的合成,而CHS2主要负责围食膜的几丁质形成[3]。Zhang等[17]对东亚飞蝗几丁质合成酶LmCHS1进行基因沉默后,发现LmCHS1的转录水平降低了约80%;若虫表现为发育迟缓、身体扭曲,无法完成正常的蜕皮,即使完成了蜕皮,新形成的体壁颜色较浅且后足因弯曲而无法正常行走。余志涛等[18]对中华稻蝗OcCHS1进行基因沉默后,若虫龄期普遍增长,多数试虫由于无法完成蜕皮而死亡,少数进入下一龄期的若虫也因无法羽化为成虫而死亡,死亡率高达85%。刘晓健等[19]对东亚飞蝗若虫几丁质合成酶LmCHS2进行基因沉默后,中肠几丁质含量的降低使围食膜残缺不全,进食难以消化和吸收,最终因为饥饿而死亡。此外还发现,CHS2基因在昆虫进食期间高表达,而蛹等非进食期间低表达[20]。这些实验结果均表明两种几丁质合成酶分布和功能的差异性。
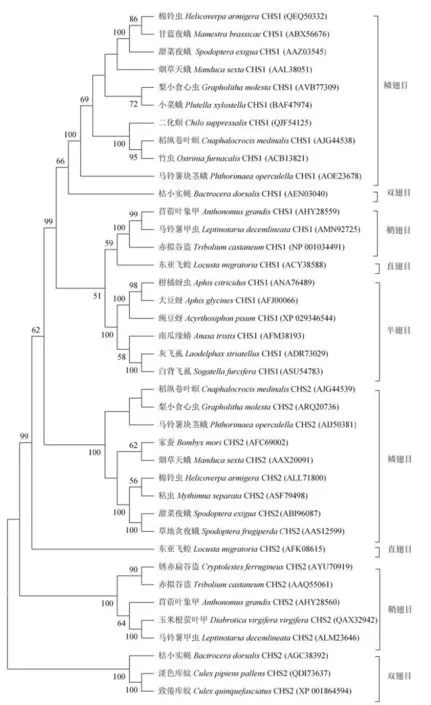
图2 部分已知昆虫几丁质合成酶的系统进化树
除此之外,许多昆虫CHS1基因具有的可变剪接已经被报道,包括褐飞虱[21]、东亚飞蝗[17]和赤拟谷盗[22]等。值得注意的是,迄今尚未发现CHS2有可变剪切机制[22]。CHS1的两个交替外显子编码的多肽长度均为59个氨基酸,且各编码一个高度保守的跨膜结构域。CHS1a主要负责昆虫表皮几丁质的合成,而CHS1b主要负责气管几丁质的合成[12,21]。例如,张传溪等[21]对稻褐飞虱几丁质合成酶NlCHS1基因研究结果表明,使用dsNlCHS1处理的五龄若虫在羽化前全部死亡,而dsNlCHS1a处理的五龄若虫,45%在羽化前死亡,42%的个体在转化成成虫后死亡,仅有13%的个体存活;但NlCHS1b却有高达73%的成虫存活率,表明dsRNA能够降低特定序列表达从而产生特定的效应。在东亚飞蝗中,干扰LmCHS1和其两个可变剪接,也得到了相似的结果[17]。
2.3 几丁质合成途径其它催化酶
几丁质的生物合成是一类高度复杂的生理生化过程,由一系列的酶催化完成,该过程共涉及8种酶,目前几丁质合成通路中研究较多的是Tre和CHS,这两类酶在多种昆虫中已经完成了基因克隆和功能分析。相对而言,与几丁质合成有关的其它酶,例如果糖-6-磷酸转氨酶(Gructose-6-phosphate aminotransferase,Gfat)、葡糖胺-6-磷酸-N-乙酰转移酶(Glucosamine-6-phosphate N-acetyltransferase,GNA)和UDP-N-乙酰葡糖胺焦磷酸化酶(UDP-N-acetylglucosamine pyrophosphorylase,UAP)等酶研究的则相对较少。
Gfat研究主要集中在酵母菌等的重要生物学功能和蛋白修饰方式方面,Gfat在昆虫几丁质合成途径中的作用方面研究较少[23]。张欢欢等[23]研究表明飞蝗的果糖-6-磷酸转氨酶基因LmGfat在虫体表皮高表达,且LmGfat基因沉默后,试虫主要因蜕皮失败而死亡,推测飞蝗LmGfat与几丁质的合成密切相关。而飞蝗的葡糖胺-6-磷酸-N-乙酰转移酶LmGNA在蝗虫各个组织均有表达且干扰后未出现特殊表型,通过与CHS1相似的表达模式,推测可能与几丁质的合成有关。陈洁等[24]对5龄甜菜夜蛾UDP-N-乙酰葡糖胺焦磷酸化酶SeUAP进行干扰,甜菜夜蛾几丁质合成酶SeCHS2表达水平明显的下调,并出现了畸形蛹和死亡的现象。陆承聪等[25]对西花蓟马UDP-N-乙酰葡糖胺焦磷酸化酶FoccUAP进行了基因沉默,西花蓟马的羽化率和存活率均显著降低,并出现了翅膀和腹部等畸形现象。这些试验结果表明几丁质合成相关酶的基因沉默会对昆虫的生长发育产生显著的影响,但这些酶的具体功能还有待进一步研究和阐明。
3 几丁质合成关键酶调控在害虫防治中的研究进展
3.1 针对几丁质合成途径的化学抑制剂
几丁质合成抑制剂的作用相当于生长调节剂,通过对昆虫的几丁质合成关键酶活性产生重要影响,或通过和底物竞争性与Tre或CHS结合,阻断昆虫几丁质的正常合成,从而导致虫体出现畸形和死亡[3]。几丁质合成酶最具代表性的化学抑制剂是苯甲酰基脲类和肽基核苷类化合物(表1),其中苯甲酰基脲类主要抑制昆虫的生长发育,是几丁质合成抑制剂中商品种类最多的一类[26],其致毒方式特别,具有选择性强、作用范围大和残留少等特点,已在害虫防治中得到广泛应用[7]。苯甲酰基脲类杀虫剂主要包括除虫脲、氟虫脲、噻嗪酮和抑食肼等。另一类肽基核苷类化合物,例如多样霉素和尼可霉素,其结构类似于UDP-GlcNAc,作用于CHS的催化部位,具有极高的杀菌活性[27],被认为是有效的杀菌剂。虽然,目前并不认为核苷肽类化合物是杀虫剂,但有研究发现,多氧霉素使蝗虫在羽化时出现死亡,还导致红头丽蝇的围食膜重量减轻[28]。此外,研究还发现,由于这类化合物均是极性分子,较难通过昆虫体壁或取食后被降解,但通过注射,具有显著的抑制效果[26]。
目前,尚未见专门针对昆虫海藻糖酶的化学抑制剂正式登记。不过,有研究发现井冈霉素和海藻唑啉等均被发现具有显著抑制昆虫Tre活性的作用,因此被认为是潜在、有效的海藻糖酶抑制剂型杀虫剂[29-30]。研究发现使用含有井冈羟胺A(Validoxylamine A)的饲料饲喂棉铃虫,试虫表现为取食量减少,体重减轻,繁殖率与存活率下降等症状,表明对棉铃虫的生长发育产生了明显的抑制作用[31]。此外,研究还发现注射了海藻唑啉的蝗虫,首先试虫活动减少,随后取食量减少[29]。尽管作为有效的杀菌剂的井冈霉素和海藻唑啉,对昆虫的Tre离体活性很高,但进一步研究发现对昆虫活体致死效果很差。因而,研究人员希望通过对Tre抑制剂结构的改造来保证其应用效果,从而开发出具有实际应用意义的产品[32]。昆虫生长调节剂的适当应用有利于减少环境污染,促进绿色食品生产,在农业害虫防治中具有重要意义。
3.2 基于RNAi技术的几丁质合成调控
RNAi是指利用双链RNA(doubled-stranded RNA, dsRNA)或者小干扰RNA(small interfering RNA, siRNA)特异性地高效诱导害虫体内重要功能基因的mRNA降解碎片化,而导致该靶基因表达沉默(即后续的翻译表达无法正常进行),产生相应的生理功能缺失,最终导致害虫生长发育受阻甚至致死的一种技术。该现象包含的机制最早于1998年在秀丽隐杆线虫中得以阐明[33]。在2001年,RNAi技术被《Science》杂志评为十大科学进展之一,并位于2002年十大科学进展之首。随后,RNAi成为了昆虫基因功能研究的热点和前沿,越来越多昆虫的功能基因被克隆和鉴定,Mao等[34]在2007年提出将RNAi技术应用于害虫防治中,而Price等[6]在2008年提出将RNAi技术作为新型害虫防治策略,并将之视为第四代杀虫剂。
RNAi介导的害虫靶基因沉默途径具有特异、高效的优点,以及技术过程的简便性,现已被广泛用于重要农业害虫绿色防控新技术研究和开发中。已有研究表明,通过注射或饲喂的方法,均可降低昆虫几丁质的含量,产生预期的效果(表2)。鉴于几丁质合成关键酶的环境安全性和靶标专一性,其做为潜在的开发新型高效绿色杀虫剂的靶标具有巨大的应用潜力。
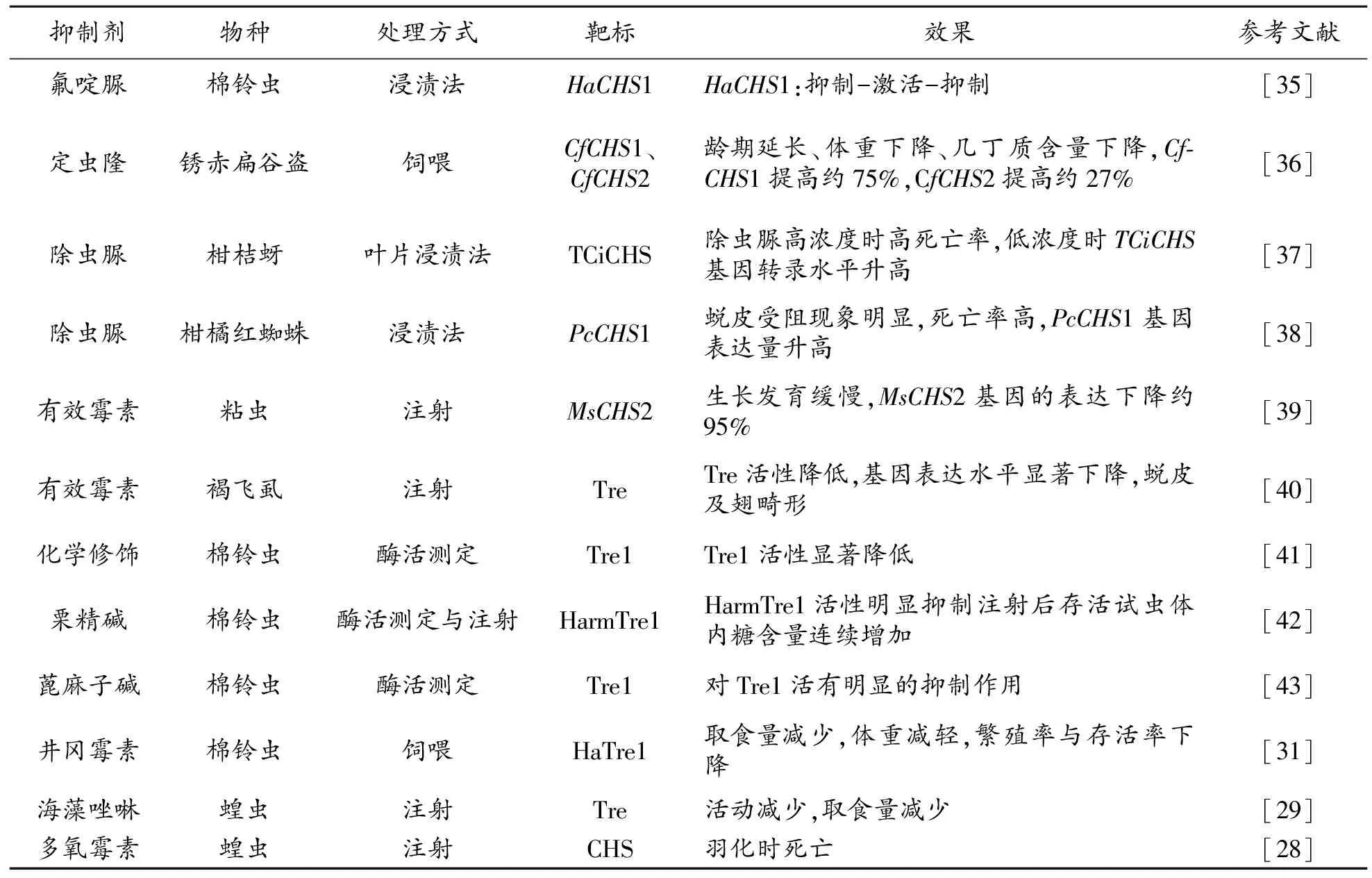
表1 针对几丁质合成的化学抑制剂对昆虫生长发育的影响
3.2.1 植物介导的RNAi(表达dsRNA的转基因抗虫作物)在害虫防治中的应用 RNAi技术应用于害虫防治的研究已取得较大进展。寄主诱导的基因沉默(host-induced gene silencing,HIGS)技术已在稻纵卷叶螟[44~47]、甜菜夜蛾[48]和蚜虫[49~50]等害虫中取得了较大进展(表2)。例如,Tian等[48]在甜菜夜蛾中报道通过饲喂在体壁和气管特异性表达的SeCHS1的dsRNA后,显著抑制甜菜夜蛾的生长发育,并导致昆虫死亡。Zhao等[50]构建了含麦长管蚜几丁质合成酶CHS1基因片段的转基因抗蚜小麦品系,研究发现取食第三代(T3)小麦品系的试虫,其CHS1基因表达水平下降了50%左右,存活和羽化的试虫数量均显著下降。Ye等[51]对豌豆蚜几丁质合成酶ApisCHS进行RNAi研究发现,取食dsApisCHS7 2 h后导致44.7%的试虫死亡,只有51.3%的试虫成功蜕皮。王爽[52]构建了含稻纵卷叶螟海藻糖酶CmTre基因片段的转基因水稻品种,室外活体实验结果发现转基因水稻的卷叶率和白叶率均明显降低,表明含有CmTre的转基因水稻对稻纵卷叶螟具有一定的防治效果。
3.2.2 dsRNA核酸农药 上述研究表明,通过在植物中表达来增强抗虫性是害虫防治的重要手段。但相对于植物转基因技术,直接体外喷洒dsRNA的方法更为简便、快捷。大田喷施核酸用药能够针对不同害虫、不同的发育时期设计特定的dsRNA,而且也能够同时以多个基因为靶标,混合应用或者交替应用提高基因干扰和致死效率[53]。结合实际应用,喷洒及灌根是最为简单、通用的方式。虽然,截止目前尚未有dsRNA在大田喷洒使用的报道,但室内已有用dsRNA重组菌株的菌液涂在萝卜叶片上饲喂小菜蛾,造成其幼虫的死亡、产卵量降低等现象,表明菌液确实对小菜蛾产生了干扰效应[57]。Hunter等[58]通过浸根和注射树干的方式处理果树,在7周后仍能在树苗中检测到dsRNA。Li等[59]通过浸根的方式处理水稻和玉米,饲喂飞虱和玉米螟,昆虫的死亡率明显提高。这些研究结果表明,基于RNAi技术,开发直接喷洒外用的核酸农药(dsRNA)具有很大潜力。

表2 针对几丁质合成途径关键酶的RNAi对昆虫生长发育的影响
4 RNAi技术应用于防治农业害虫面临的主要问题及应对策略
4.1 RNAi技术应用于农业害虫防治面临的主要问题
基于害虫体内关键基因的RNAi技术开发dsRNA作为外用杀虫剂,是新型绿色杀虫剂创制的一个重要方向。核酸农药(dsRNA)用于农业害虫的防治具有以下优点:第一,dsRNA能高效专一控制目标害虫,对天敌昆虫无危害;其次,dsRNA的使用,能有效阻止或减缓害虫抗药性发生;第三,能显著降低化学农药的施用量,保证食品安全;此外,dsRNA属于核酸,对环境无任何污染,是一种真正环境友好型农药,这对减少农残和环境污均具有重要的意义。但是,目前在研究中发现要提高RNAi效率,还有一些瓶颈问题尚需深入研究。
首先,RNAi在不同种类昆虫中基因沉默效率存在差异性,例如研究发现赤拟谷盗等鞘翅目害虫、蝗虫等直翅目害虫,以及蟑螂等蜚蠊目害虫对RNAi较为敏感,RNAi后靶基因沉默效率较高;而棉铃虫、小菜蛾、草地贪夜蛾等鳞翅目害虫,以及蚜虫等半翅目害虫对RNAi较不敏感,对靶基因沉默效率较低[60]。随后研究发现,这可能是与昆虫肠道内含有一种双链RNA酶(dsRNA-specific ribonucleases , dsRNases)有关,因为其可以降解外来的dsRNA。其次,dsRNA进入昆虫体内后的吸收、转运和扩散机制目前还不十分清楚随,这会影响进入昆虫体内的dsRNA/siRNA的有效到达靶标位置,从而影响基因沉默效果[61]。此外,目前实验室中通常制备dsRNA是采用商用试剂盒微量合成,而要作为核酸外施喷洒药剂,则需要制备大量的dsRNA。因此,如何规模化和工厂化生产合成dsRNA,是限制dsRNA作为核酸农药能否最终得到应用的另一重要因素。综上,针对害虫体内的靶标基因的RNAi效率的提高以及如何工厂化大量合成dsRNA还有许多深层问题需要阐明和解决。
4.2 主要解决途径
4.2.1 高效基因的筛选 昆虫体内重要靶标基因筛选和鉴定是RNAi技术应用于害虫防治的先决要素。不是害虫体内所有的基因都能有效沉默基因,也不是所有的基因干扰(沉默)都能杀死害虫。根据RNAi作用的基本原理,要做为新一代高效农药,只有那些对于昆虫生长发育特别重要的基因才有可能作为潜在的杀虫靶标基因。因此,在重要害虫中筛选具有致死作用的靶标基因是将RNAi 技术应用于害虫控制的关键之一[62]。目前普遍认为,作为绿色杀虫剂设计的靶标生物分子(基因)至少要同时具备如下两个特征:①对靶标生物的生长发育至关重要,以保证基于靶标设计的dsRNA杀虫剂具有高效性;②在高等动植物体内不存在或显著区别于高等动植物体内的同源分子,以保证杀虫剂的特异性和安全性[63]。
目前主要是从害虫消化系统(例如唾液腺、消化酶)、生长发育系统(例如几丁质合成和代谢途径、昆虫蜕皮变态过程),以及繁殖系统和免疫系统(例如致育因子、卵黄蛋白)中分离鉴定具有重要功能的靶标基因[64]。通过在蝗虫、蚜虫、棉铃虫、东方粘虫等一些昆虫中的研究,发现除过CHS外,唾液腺蛋白[65](C002)、V-ATP酶[66](V-ATPase)和蜕皮激素受体[67](EcR)等一系列功能蛋白对昆虫的生长发育、繁殖也起着重要的作用。昆虫唾液相关蛋白C002是一种水溶性唾液蛋白,在取食过程中发挥着重要作用。例如,通过对麦长管蚜唾液蛋白C002基因的RNAi研究,发现蚜虫在取食dsRNA后的第八天,死亡率达到64%[65]。Baum等[66]对V-ATPase基因有干扰作用的基因序列(WCR dsRNAs)导入玉米植株中,玉米根叶甲取食转基因玉米植株后导致幼虫发育延缓,明显降低了害虫取食对玉米生长的影响。Shen等[67]近年对棉花红蜘蛛的蜕皮激素受体进行基因沉默(RNAi)后,发现若虫发育为成虫的过程明显受阻,并导致试虫死亡。
有上述可见,随着今后越来越多的昆虫基因组、转录组、蛋白组等数据被公布,更多的重要功能基因也会被鉴定和挖掘出来,所以将会有数量众多的高效靶标基因可通过RNAi技术应用于害虫防治中,这将会加速实现RNAi技术在害虫防治中的真正应用。
4.2.2 促进RNAi应用的有效途径 在实际应用中,许多研究发现无论哪种传递方式,单个关键基因的dsRNA都很难较快达到致死的剂量[62],只能通过调节昆虫的生长发育使其缓慢死亡。因此,多方面的措施联用,可增强防控效果。有助于RNAi在害虫防治中应用的联用措施主要有以下途径。
首先是RNAi技术与现有的杀虫剂联用。RNAi技术通过靶基因的沉默,打破了昆虫的正常生长发育,协助化学或生物杀虫剂突破昆虫体壁或围食膜的阻挡,增强杀虫剂的杀虫效果。通过dsRNA干扰来沉默非洲疟蚊几丁质合成酶AgCHS1基因,使得AgCHS1基因的转录水平和几丁质含量分别降低了62.8%和33.8%,增加了其幼虫对除虫脲的敏感性[68]。郭菊馨等[69]对淡色库蚊海藻糖酶Tre1和几丁质合成酶CHS1进行基因沉默,结果表明试虫对溴氰菊酯的敏感性提高。另外研究发现,RNAi技术与Bt农药联用,可以累积两种作用方式的效应。对甜菜夜蛾3龄幼虫的SeCHS2基因进行沉默后,饲喂Bt毒素发现幼虫对Cry毒素的敏感性显著提高,甜菜夜蛾的高死亡率可能是靶基因SeCHS2的RNAi效应和Cry毒性的协同作用的结果[70]。
其次是多靶基因RNAi。利用多个目标基因同时沉默可进一步提高RNAi效率。赵凤通过农杆菌转化法获得转CmTre和CmCHS基因dsRNA的水稻,以其叶片饲喂稻纵卷叶螟,发现CmTre1、CmTre2、CmCHS1和CmCHS2基因表达量均显著下降,幼虫体型较小,畸形甚至死亡[71]。Tzin等[72]人对蚜虫多个渗透调节基因(水通道蛋白、蔗糖酶、糖转运蛋白)进行组合,联合RNAi对血淋巴渗透压的影响明显大于单个基因的功能。由此可见,同时干扰多个具有相关作用的靶标基因更能导致害虫生物功能的改变和有助于杀死害虫。与现有农药或多靶标的联用,不仅能够减少害虫防治中对dsRNA浓度的要求,同时能够减少杀虫剂的使用剂量,有效防止农药过量使用对环境和人的危害并延缓抗药性的产生。
此外,还有纳米粒子与dsRNA偶联,制备纳米dsRNA农药。纳米材料具有可修饰性强、水溶液分散性好和光催化降解等特点为dsRNA的传递提供了新的思路[73]。为了增强dsRNA在应用中的稳定性,已经研发出了无毒并可降解的纳米材料,dsRNA搭载后稳定性明显提高,喷洒在叶面上不仅耐雨水冲刷且稳定期达30 d[74]。纳米材料的应用,使dsRNA不仅可以通过昆虫取食进入昆虫体内,还可以直接通过体壁渗透。比如,沈杰教授团队开发出利用纳米材料介导dsRNA从蚜虫体壁进入体内的方式,从而达到干扰昆虫生长发育的目的[75]。与通过纳米粒子包被增加dsRNA吸收、传递效率类似的策略,还有脂质体修饰。研究表明,脂质体修饰的dsRNA在德国小蠊、斑翅果蝇等昆虫中RNAi能明显提高靶标基因的沉默效率[76~77]。
4.2.3 利用微生物发酵工程工厂化大规模合成生产dsRNA 利用商用试剂盒合成dsRNA虽然可以得到纯度较高的dsRNA,但是成本太高,而且合成量极为有限,且操作复杂,无法满足田间应用的需求。因此,可以利用大肠杆菌HT115(DE3) 合成多个目的基因的重组dsRNA,这样可以极大降低合成成本,简化合成步骤。策略是设计带有害虫靶标基因序列的RNAi 载体,再将载体转入大肠杆菌感受态细胞中,就可以不断的得到大量目的基因的dsRNA[48,62,78~79]。马中正[78]通过基因工程菌高效合成了靶向异色瓢虫基因的dsRNA。Vatanparast[79]通过大肠杆菌(HT115)合成了甜菜夜蛾胰凝乳蛋白酶SeCHY2基因的dsRNA,并通过超声预处理菌液,从而提高甜菜夜蛾幼虫口服的死亡率。
5 RNAi技术应用于害虫防治的小结与展望
RNAi介导的靶基因沉默途径具有特异、高效的优点,以及技术过程的简便性,现已被广泛用于重要农业害虫绿色防控新技术开发中。昆虫几丁质合成酶,是昆虫几丁质代谢过程中的关键酶之一,由于高等动物及植物体内不存在该酶,而被认为是理想的杀虫剂靶标[3]。目前已有众多Tre、CHS等几丁质合成相关的关键酶基因被鉴定和研究。基于几丁质合成关键酶等的RNAi技术在害虫防治中的应用可通过两种策略实现:一是植物介导的RNAi; 二是直接体外喷洒dsRNA(核酸农药)。虽然基于害虫体内重要基因为靶标的RNAi技术应用于农业害虫潜力巨大、前景诱人,但是目前还面临一些瓶颈问题,比如不同昆虫靶基因的RNAi效率的差异性、dsRNA合成的高成本等问题尚需进一步阐明和解决。此外,纳米材料偶联包被、脂质体修饰、与BT等杀虫剂联用,以及多标靶联用等都需要系统深入开展,以促进RNAi技术在防控害虫中得到广泛应用。相信,随着对几丁质合成途径研究的不断深入,基于该途径的关键酶基因为靶标的RNAi技术在今后害虫绿色防治中将会发挥重要作用。
