蟾酥抗肿瘤临床应用及其疗效机制的研究进展
2022-09-13童明慧郭英球
刘 娟,童明慧,郭英球,李 娟,3*
1湖南中医药大学;2长沙欧邦生物科技有限公司;3湖南省中药活性物质筛选工程技术研究中心,长沙 410208
恶性肿瘤严重地威胁了人类健康及生命,临床上主要以手术、靶向、药物及放化疗等手段综合治疗。中医药在治疗恶性肿瘤中,具有一定优势和特点,中医认为肿瘤的病机主要是正气虚弱,外邪入侵,根据恶性肿瘤的病因病机,中药治疗在辨证论治基础上,分别施以扶正固本、软坚散结、活血化瘀、理气行滞、清热解毒[1]。蟾酥(Bufonis Venenum)为蟾蜍科动物中华大蟾蜍(BufobufogargarizansCantor)或黑眶蟾蜍(BufomelanostictusSchneider)的干燥分泌物。其性味辛,温,有毒、归心经,具有解毒、止痛,开窍醒神之功效,用于治疗痈疽疔疮,咽喉肿痛,中暑神昏,痧胀腹痛吐泻[2],是一味优良的抗肿瘤中药。现代药学研究表明,蟾酥主含蟾蜍内酯类、蟾毒色胺类和甾醇类等化合物,已证明蟾蜍内酯类是蟾酥抗肿瘤的主要药效物质基础,目前,已从蟾酥中分离鉴定出142种该类成分[3]。其主要成分蟾毒灵、脂蟾毒配基和华蟾酥毒基在2020年版《中国药典》蟾酥药材质量标准中作为含量测定的指标成分,规定这三个化合物的总含量不低于7%。由蟾酥单味药材开发的华蟾素三种剂型(注射液、胶囊和片剂)和蟾酥注射液,治疗中、晚期肿瘤具有较好的临床疗效,尤其是对原发性肝癌、肺癌、食管癌和胃癌作用效果显著,能增强机体免疫力,减少放化疗的毒副反应,并提高患者生存质量、延长寿命等[4]。鉴于蟾酥优良的抗肿瘤作用,本文综述了近五年蟾酥及其制剂抗肿瘤的作用机理和临床应用,为蟾酥的深入研究和开发应用提供指导依据。
1 临床应用
蟾酥始载于《药性论》,原名蟾蜍眉脂。古籍《医学入门》记载:“主痈疽疔肿瘰疬,一切恶疮顽癣”;《本草纲目》载:“治发背疔疮,一切恶肿”。在古人用治恶疮肿毒的经验的启发之下,现代中医将其用于各种癌肿,有攻毒抗癌、消肿止痛之效。如《抗癌治验本草》记载,以之与露蜂房、鸦胆子、玳瑁等配伍,治疗肺癌;以之与乳香、没药、雄黄等配伍,治疗乳腺癌等。基于前人的应用基础,采用现代药物制剂技术,将蟾酥开发成多种制剂。目前,已上市销售的用于治疗肿瘤的蟾酥制剂除单味药的华蟾素三种制剂和蟾酥注射液外,还有复方制剂鹤蟾片和仙蟾片等。近年来,国内外学者多采用随机对照的临床试验方法对蟾酥注射液,华蟾素及仙蟾片等进行临床评价,研究证实,蟾酥制剂在各种恶性肿瘤的治疗中效果显著。
1.1 单用蟾酥制剂的临床评价
临床常单用华蟾素制剂治疗多种中、晚期肿瘤,与白介素-2、水飞蓟宾葡甲胺片,以及硫酸吗啡控释片等相比,作用效果显著,不良反应少(见表1)。

表1 单用蟾酥制剂抗肿瘤的临床疗效
1.2 联合应用
蟾酥制剂常与放/化疗方案联用,治疗恶性肿瘤,不仅可以增加化疗药的疗效,显著降低肿瘤标志物水平,而且可以明显缓解临床症状、抑制炎症反应、减少患者复发与转移的作用趋势(见表2)。
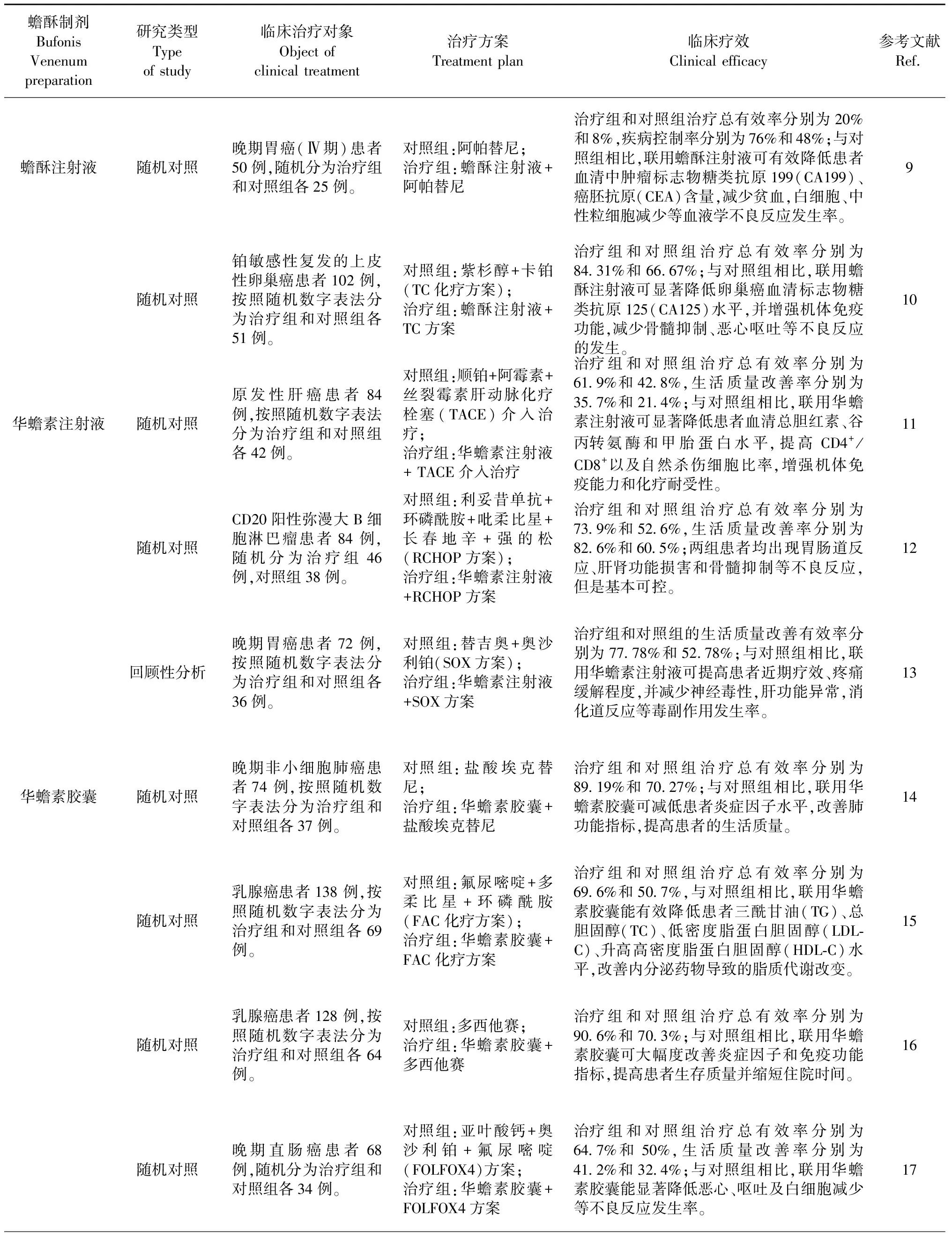
表2 蟾酥制剂联合放/化疗方案抗肿瘤作用的临床疗效
1.3 不良反应
华蟾素注射液中吲哚类生物碱,主要成分5-羟色胺对血管有强烈的刺激和收缩作用,静脉炎是发生率最高的不良反应[22]。少数患者在治疗过程中还会出现皮疹、发热、寒战、过敏性休克等症状,在接受对症处理后所有症状都得以缓解[23]。目前没有华蟾素注射液致死的病例报告[24]。另报道,华蟾素口服制剂给药期间,患者会出现腹痛,腹泻等胃肠道不适,但随着时间延长,这种情况多可耐受[25]。上述研究结果提示,蟾酥制剂在临床应用存在一定的不良反应,但严格遵循说明书用药,加强用药监测,能有效保障其用药的安全性。
华蟾素是临床应用最多的蟾酥制剂,自20世纪80年代投入临床应用以来,已广泛应用于各种中、晚期恶性肿瘤以及癌症疼痛的治疗,为二类中药保护品种,被收录于《国家基本医疗保险、工伤保险和生育保险药品目录》和《国家基本药物目录》中。华蟾素制剂单用时,可有效控制腹水量、改善机体凝血功能、降低肝细胞炎症指标以及缓解疼痛,提高患者的生活质量;与化疗药物或其他治疗手段联用时,不仅可提升化疗药物的抗肿瘤作用,而且可减轻化疗药物引起的恶心呕吐、骨髓抑制、脂质代谢异常、肠胃粘膜损伤等一系列不良反应。蟾酥注射液作为一种肿瘤辅助治疗药物,常与化疗药物联合使用,与单用化疗药物相比,患者血清中CA125、CA199等癌症标志物的含量显著降低,并能有效纠正患者T淋巴细胞亚群比例失调,减轻免疫功能的损害。
2 作用机理研究
药学工作者对蟾酥中单体化合物及其制剂的抗肿瘤作用进行了深入研究。单体化合物主要集中在蟾毒灵、华蟾酥毒基、脂蟾毒配基、蟾毒它灵、沙蟾毒精等蟾蜍内酯类成分,其制剂主要研究华蟾素三种制剂和蟾酥注射液,华蟾素是由中华大蟾蜍干燥皮经水提醇沉和不同工艺制备而成的制剂,主要含有蟾蜍内酯类、生物碱类、多肽类、胆固醇类等成分;蟾酥注射液是由从中华大蟾蜍耳后腺和皮肤腺的干燥分泌物中提取的有效成分精制而成的灭菌水溶液,主含蟾毒内酯类、生物碱类成分。研究发现其主要通过抑制肿瘤细胞的增殖、侵袭和转移,促进肿瘤细胞凋亡、诱导肿瘤细胞自噬,逆转肿瘤多药耐药等方面发挥抗肿瘤的作用。
2.1 诱导肿瘤细胞周期阻滞
细胞周期主要分为DNA合成期(G1期、S期,G2期)和细胞分裂期(M期),蟾酥可以通过调控周期蛋白依赖性激酶、细胞周期蛋白,以及一系列原癌基因的表达将细胞阻滞于不同时期(见表3)。

表3 蟾酥对肿瘤细胞周期的阻滞作用
2.2 诱导细胞凋亡
凋亡是一种基因控制的自杀程序,诱导癌细胞凋亡已被确定为治疗癌症的有效方法之一。目前对凋亡机制的研究主要汇集在三个方面:内源性途径、外源性途径、内质网应激介导凋亡途径。
内源性途径又称为线粒体途径,Bcl-2家族蛋白是控制该途径的主要调节分子。Bcl-2家族蛋白可分为抗凋亡因子(Bcl-2、Bcl-XL、Bcl-x、BAG等)和促凋亡因子(Bax、Bid、Bak、Bad、Bcl-10、Bim等),通过调控Bcl-2家族蛋白引起线粒体膜的通透性增强,细胞色素(cytochrome,Cyto)C的释放,从而诱导细胞凋亡。Han等[36]证实异沙蟾毒精可上调结直肠癌细胞SW620和HCT116中促凋亡蛋白Bax表达,并协同线粒体内膜转运蛋白腺苷酸转运体(adenine nucleotide transporter,ANT)共同增强线粒体的膜通透性,降低线粒体跨膜电位,从而诱导细胞SW620和HCT116通过线粒体途径实现凋亡。活性氧(reactive oxygen,ROS)在细胞的凋亡中起着重要作用,华蟾酥毒基刺激人骨肉瘤细胞U2OS和143B细胞产生过量ROS,诱导线粒体双层膜通透孔开放,进而引起线粒体损伤,最终导致细胞凋亡[37]。Wu等[38]证明蟾毒灵可通过增加人结直肠癌细胞HCT-116和SW620中ROS的蓄积,激活线粒体介导的半胱天冬酶(caspase,Casp)级联凋亡途径,促进凋亡。除上述ROS介导的凋亡,线粒体凋亡信号通路还涉及诸多促凋亡蛋白基因、抑癌基因的表达。蟾毒灵可破坏人恶性胶质瘤细胞U87线粒体膜的完整性,触发氧化应激,进而催化U87细胞DNA双键断裂,诱导下游肿瘤抑制基因p53核转录增加、促使聚ADP-核糖聚合酶(poly-ADP-ribose polymerase,PARP)裂解,上调凋亡相关蛋白Bax、Casp-9的表达,从线粒体途径发挥诱导肿瘤细胞凋亡的作用[39]。
外源性途径又称为死亡受体途径,是一条主要的细胞凋亡调控途径。细胞表面的死亡受体与特定的死亡配体结合后通过信号级联反应激活Casps,导致不同蛋白质的剪切,进而启动细胞凋亡。蟾毒灵能够诱导人膀胱癌细胞T24外源性凋亡,即上调死亡受体(death receptor,DR)-5蛋白水平,激活Casp-8,活化下游效应分子Casp-3、7,并使PARP裂解,从而促使细胞凋亡[40]。Yang等[41]报道不同浓度华蟾素溶液可上调自杀相关因子(factor associated suicide,Fas)及其配体FasL、肿瘤坏死因子(tumor necrosis factor,TNF)-αR、DR-4的蛋白水平诱导人膀胱癌细胞T24和EJ外源性凋亡,并上调Bax/Bcl-2蛋白比例,促使线粒体释放Cyto C激活线粒体途径,放大凋亡信号,促进肿瘤细胞凋亡,从而抑制T24裸鼠异位移植瘤的生长。
内质网是细胞内Ca2+含量最多的细胞器,Ca2+稳态失衡时,细胞内环境被扰乱,引起内质网应激(endoplasmic reticulum stress,ERS),并进一步激发未折叠蛋白反应,诱导下游转录因子C/EBP同源蛋白(C/EBP homologous protein,CHOP)表达,激活c-Jun氨基末端激酶(c-JunN-terminal kinase,JNK)信号通路,并活化Casp-12启动凋亡程序。蟾毒它灵诱导CHOP表达以及蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和跨膜蛋白肌醇需求酶1(inositol-requiring enzyme 1,IRE1)磷酸化,促使Casp-12激活,触发ERS诱导人骨肉瘤骨细胞MG-63凋亡[42]。蟾毒灵可活化肝癌细胞HepG-2和Huh-7,白血病细胞K562和K562/A02中内质网跨膜蛋白IRE1α,增加JNK蛋白磷酸化,通过作用于IRE-JNK通路诱导ERS,致使细胞凋亡[43,44]。
2.3 抑制肿瘤细胞侵袭和迁移
当肿瘤细胞具备高侵袭、高迁移能力时,可从原发部位,经淋巴道,血管或体腔等途径到达其他部位继续生长。这一转移过程涉及细胞外基质(extracellular matrix,ECM)屏障被破坏、原部位肿瘤血管新生、上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)后细胞侵入体循环,从循环系统再植入新的器官组织并随之增殖。华蟾素注射液可抑制人肝癌细胞HepG2中血管内皮生长因子(vascular endothelial growth factors,VEGFs)、基质金属蛋白酶(matrix metalloproteinases,MMPs)-2、9蛋白过度表达,避免ECM屏障被破坏,使肿瘤细胞的侵袭和转移受阻[45]。内皮细胞HUVEC的分裂和增殖是肿瘤血管生成的重要条件,华蟾酥毒基剂量依赖性诱导BALB/c裸鼠结肠肿瘤组织中HUVEC内皮细胞ROS聚积,下调HUVEC细胞中Bcl-2和低氧诱导因子1α(hypoxia inducible factor,HIF-1α)蛋白水平,使蛋白激酶 B(protein kinase B,PKB/Akt)/哺乳动物类雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化减少,阻碍内皮细胞Akt/mTOR/HIF-1α通路,显著减少血管生成数目,抑制裸鼠瘤体生长[46]。蟾毒灵可通过抑制人肝癌细胞BEL-7402糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β)Ser9位点的磷酸化和β-catenin的核转位,下调Wnt/β-catenin信号通路下游分子MMP-7、环氧化酶(cyclooxygenase,COX)-2和Cyc D1蛋白表达,增加细胞膜上肿瘤抑制因子E-钙黏蛋白(E-cadherin,E-Cad)和β-catenin的表达,从而增加E-Cad/β-catenin复合物数量,以阻断EMT[47]。沙蟾毒精(8 nM)显著增加人前列腺癌细胞PC3细胞中E-Cad和胞质紧密粘连蛋白1(zonula occludens-1,ZO-1)表达,降低E-Cad转录抑制因子E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)和波形蛋白(vimentin,Vim)表达,抑制EMT的发生[48]。
2.4 诱导肿瘤细胞自噬
华蟾素可上调自噬标志分子微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)以及p62蛋白表达,提高Bax/Bcl-2的比例,同时触发人膀胱癌细胞T24的凋亡和自噬[49]。蟾毒灵使人结直肠癌细胞LoVo中自噬相关基因(autophagy-related gene,Atg)-5、7,12和Beclin-1蛋白表达增加,同时,LC3-I转化为LC3-II,通过自噬途径发挥抗肿瘤作用[50]。研究表明,ROS-JNK 通路的激活与细胞自噬的关系密切。蟾毒灵在人结直肠癌细胞 HT-29 和 Caco-2 中可促进 ROS 的形成和积累,进而激活 JNK 信号通路,上调细胞中 LC3-II、Beclin-1、Atg-5 蛋白表达,应用 ROS、JNK 抑制剂后,可削弱蟾毒灵诱导自噬的能力,提示蟾毒灵诱导人结直肠癌细胞自噬与 ROS-JNK途径相关[51]。同时,华蟾酥毒基可通过ROS/JNK/p38途径诱导人骨肉瘤细胞U2OS发生自噬[52]。蟾蜍硫堇下调H22肝癌荷瘤小鼠血清中白介素(interleukin,IL)-6水平,抑制肿瘤组织中转录激活因子(signal transducers and activators of transcription,STAT)3和蛋白酪氨酸激酶(janus kinase,JAK)-2的过度激活,发挥抗炎活性,并上调自噬相关蛋白LC3-II、Atg-5、7和Beclin-1表达水平,通过抑制IL-6/JAK/STAT3通路诱导细胞自噬的发生[53]。
2.5 逆转肿瘤多药耐药
多药耐药是肿瘤临床治疗中导致治疗失败和疾病复发的主要原因之一,多药耐药的诱发机制复杂,蟾酥因其多靶点的优势在逆转肿瘤多药耐药应用中有巨大的潜力。华蟾毒它灵可促进鼻咽癌细胞5-8F中抑癌基因FOXO1的表达,进而抑制5-8F细胞相互蛋白非肌性肌球蛋白重链-9(non-muscle myosin heavy chain 9,MYH9)基因的表达,增加顺铂化疗的敏感性,协同抑制鼻咽癌细胞侵袭[54]。华蟾毒它灵与吉非替尼联用,抑制肺癌细胞A549中Cyc A、Cyc D、CDK-2、肝细胞生长因子(hepatocyte growth factor,HGF)的蛋白表达,阻碍肝细胞生长因子受体c-Met进一步扩增,靶向HGF/c-Met通路降低细胞的活力,加速细胞的凋亡进程[55]。肿瘤干细胞具有极强的DNA损伤耐受能力,易对化疗药物产生耐药性。蟾毒灵显著抑制结直肠癌细胞HCT116和LoVo的干性,降低干性标记物跨膜糖蛋白CD133、CD44,八聚体结合转录因子4(octamer-binding transcription factor 4,OCT4)以及耐药蛋白ABCG2的表达,在体内外均可逆转结直肠癌细胞对顺铂的耐药[56]。
综上所述,蟾酥抗肿瘤作用涉及细胞增殖、侵袭、转移、凋亡及自噬等多个方面,从细胞水平研究蟾酥抗肿瘤机理,以蟾酥中蟾蜍内酯类成分为主,蟾毒灵是其中研究最多的化合物,它可以通过促进抑癌基因的表达、调节ROS水平、诱导DNA损伤、阻断EMT的发生,上调自噬基因的表达以及逆转肿瘤细胞对顺铂的耐药性等,在肿瘤发生发展的各个阶段发挥作用。除蟾毒灵外,华蟾酥毒基、蟾毒它灵、沙蟾毒精等亦具有良好的抗肿瘤活性。
3 结语
临床应用中,蟾酥制剂除抗肿瘤作用外,还有显著的机体免疫调节作用,对比机制研究,并未检索到与免疫直接相关的报道,可能与主以蟾蜍内酯类单体化合物研究为主,这类成分无免疫调节作用。蟾酥制剂发挥免疫调节作用可能与华蟾素和蟾酥注射液的制备工艺中保留了大量活性多肽等水溶性物质有关,但相关研究报道极少[57,58]。蟾酥抗肿瘤作用机制的研究报道较多,并涉及肿瘤发生发展的各个过程,但研究大部分集中在体外细胞实验,机制研究缺乏机体完整统一的内环境和神经体液调节。同时,多篇文献报道,蟾蜍内酯类成分在一定浓度范围内,对正常细胞有细胞毒作用,如,华蟾酥毒基对脑神经元细胞HCN-2的IC50值42.5 μmol/L,其抑制作用主要与细胞中ROS以及Ca2+失衡有关[59],并对人肺上皮细胞BEAS-2B的IC50值22.3 μmol/L[60];蟾毒灵和沙蟾毒精对人食管上皮细胞Het-1A的IC50值分别为10.1和11.8 μmol/L[61];脂蟾毒配基抑制胰腺导管上皮细胞HPDE的活力,IC50值58.12 μmol/L[62]。由此分析蟾蜍内酯类既是抗肿瘤的药效物质,又是毒性成分,但毒性是相对的,通过控制安全用药剂量,可降低对正常细胞的毒性作用。因此,在细胞水平的研究基础上,开展动物体内机制研究,明确蟾蜍内酯类成分的治疗剂量和毒性剂量,为指导临床安全、有效用药,是极其必要的。此外,在蟾蜍内酯类成分研究基础上,开展蟾酥多肽和蟾毒色胺类等药效物质和机理研究,进一步研究蟾酥抗肿瘤的量-效-毒作用规律及作用机理,以充分发挥蟾酥扶正固本和清热解毒的治疗优势,为蟾酥抗肿瘤的安全、合理用药,扩大临床适应症提供重要的科学依据。
