LETM2基因在胃癌中的表达及其对胃癌腹膜转移预测和预后的意义
2022-09-13施若云王珺岚张真真
施若云,王珺岚,张真真
胃癌是全球最常见的5种癌症之一,也是全球癌症相关死亡的第三大原因,内镜诊治早期筛查可提高胃癌的治愈率,晚期胃癌患者易在根治性切除术后出现腹膜播散转移,提示预后不良[1]。腹膜播散转移是胃癌相关的死亡原因,且化疗、腹腔内灌注或姑息手术的疗效均有限[2]。此外,当腹水量少或转移灶隐匿时,影像学检查或活检并不能提高腹膜转移的早期检出率。因此,需要新的预测标志物来发现早期腹膜转移,以改善晚期胃癌的预后。加权基因共表达网络分析(weighed gene co-expression network analysis,WGCNA)是鉴定疾病涉及的共表达模块和关键基因的有效方法[3]。本研究基于公共微阵列数据集(GSE62254)通过WGCNA鉴定与胃癌腹膜转移相关的枢纽模块,基于胃癌TCGA和GEO数据集(GSE62254和GSE84437)筛选胃癌预后相关基因,取枢纽模块的基因和单因素COX回归分析有统计学意义的交集基因之一,即含亮氨酸拉链和EF手跨膜蛋白2(leucine zipper and EF-hand containing transmembrane protein 2,LETM2),作为胃癌腹膜转移和预后的候选标志物,通过对胃癌相关组织及腹水或腹腔灌洗液沉渣蜡块进行免疫组织化学染色(immunohistochemical staining,IHC)表达分析,探讨其与胃癌临床病理特征和对腹膜转移的预测意义。
1 材料与方法
1.1 材料 GSE62254和GSE84437芯片数据集从基因表达数据库GEO(www.ncbi.nlm.nih.gov/geo/)下载,分别基于GPL450和GPL6947平台和文献获得300份和454份胃癌样本基因表达和临床数据[4-5]。胃癌癌症基因组图谱分析(TCGA-STAD)转录组数据和临床数据从http://cancergenome.nih.gov/使用Perl软件(https://www.perl.org/;5.32.1版本)下载。通过R软件Limma包和Sva包对数据进行了批量归一化处理。
1.2 方法
1.2.1 共表达网络的构建 使用R软件中的WGCNA包和Limma包对处理后的数据集进行WGCNA分析。首先,通过定义软阈值(β值)的功效建立标准的无标度网络,分析网络模块的平均连通性和尺度独立性。使用网络中每对节点基因与其Pearson 相关系数绝对值构造邻接矩阵,基于TOM(dissTOM)的分层聚类构建分层聚类树状图,合并相关系数>0.75的模块。最后,选择与胃癌腹膜转移相关分析中相关系数最大、P值绝对值最小的模块作为枢纽模块[3]。
1.2.2 基于胃癌数据集分析筛选胃癌预后相关基因 基于不同数据集(GSE62254、GSE84437和TCGA-STAD)的总生存期(overall survival,OS),以不同基因mRNA表达的最佳截断值为临界值,将样品分成高表达组和低表达组,使用R/Bioconductor软件中的Survival包对基因表达进行单变量COX生存分析,选择P<0.05的基因作为预后相关基因。利用VennDiagramR程序包获取深绿色模块与3个数据集预后相关基因的交集基因,并绘制韦恩图,得到与腹膜转移预后相关的基因LETM2和SERPINE2。因目前LETM2在胃癌的研究文献报道有限,本研究选择LETM2作为关键基因进行临床样本的IHC分析。
1.2.3 IHC分析LETM2在胃癌不同部位的表达及临床意义 收集2006年8月—2021年12月胃癌手术患者的福尔马林固定石蜡包埋库存蜡块215例,包括肿瘤原发灶(n=215)、肿瘤周围正常组织(n=215)、淋巴结转移灶(n=141)、肝转移灶(n=6)、腹膜转移灶(n=20)。纳入标准:明确的病理诊断,临床和随访数据完整。排除标准:胃腺癌伴异质性成分;失访者;死于其他疾病而非胃癌者。
采用兔抗人LETM2多克隆抗体(货号:17180-1-AP,1∶100稀释,武汉三鹰生物技术有限公司)以及Envision试剂盒(K4010,丹麦DAKO生物技术有限公司),按照抗体说明书对胃癌LETM2进行两步法IHC检测。PBS作为阴性对照,胎盘组织作为阳性对照。免疫反应评分(IRS)根据染色强度(SI)和阳性细胞(PP)的百分比的乘积计算,即IRS=SI×PP。染色强度分级如下:0,无染色;1,淡黄色;2,棕黄色;3,棕褐色。阳性细胞百分比:0为≤5%,1为6%~25%,2为26%~50%,3为51%~75%,4为>75%。采用X-tile软件(V3.6.1),根据生存数据确定IRS最佳截断值为7,将LETM2表达分为低表达组和高表达组。
1.2.4 腹水细胞沉渣石蜡包埋IHC分析 收集2015年1月—2021年12月就诊的胃癌腹膜转移患者腹水(n=20)和胃癌患者非肿瘤腹水或腹腔灌洗液细胞蜡块(n=60),分别行LETM2 IHC分析。具体操作如下:取200~300 mL 腹水样本,2 500 r/min 离心10 min,弃上清液;血性腹水加入适量的红细胞裂解液继续离心10 min,小钢匙刮取细胞沉渣置于包埋盒中的擦镜纸上,包裹后合盖,置于95%乙醇中固定;经常规脱水处理,石蜡包埋、切片,行苏木精-伊红(H-E)染色和LETM2 IHC分析,每张切片选取10个高倍视野(×200),对照H-E染色细胞形态,LETM2着色阳性肿瘤细胞>5为阳性,以临床和病理诊断最终结果为金标准,评价LETM2在胃癌腹水细胞沉渣蜡块切片IHC分析对胃癌腹膜转移的预测价值[4]。

2 结 果
2.1 基于WGCNA和数据集预后分析筛选胃癌腹膜转移预后相关候选基因 利用WGCNA筛选出与胃癌腹膜转移相关系数最大、P值最小的深绿色模块(r=0.32,P=1.1×10-8,图1)作为关键模块,共包含6 936个基因。根据基因mRNA表达的最佳截断值,GSE62254、GSE84437和TCGA单变量COX回归分析分别得到1 664、1 031和363个预后相关基因(P<0.05),韦恩图确定了深绿色模块基因与3个数据集预后相关基因的交集基因LETM2和SERPINE2,LETM2在不同数据集的K-M生存曲线和Log-rank检验提示,LETM2高表达胃癌患者预后差(图2)。

A:WGCNA分析共获得与胃癌临床病理性状相关的15个关键的共表达模块;B:深绿模块基因与胃癌腹膜转移相关性分析结果(r=0.76,P<0.001);C:模块-特征关系图显示,深绿色模块与胃癌腹膜转移相关系数最大,P值最小,从左到右分别为Lauren分型肠型、弥漫型和混合型;T指AJCC的T分期;N指AJCC的N分期;M指AJCC的M分期;pStage指胃癌病理分期;PM指胃癌腹膜转移,包括癌性腹水或腹膜转移癌结节;Mol为文献提供的ARGC分子分型。图1 基于胃癌数据集WGCNA分析发现胃癌腹膜转移相关的关键模块Fig.1 Identification of key modules related to peritoneal metastasis based on WGCNA analysis and gastric cancer datasets
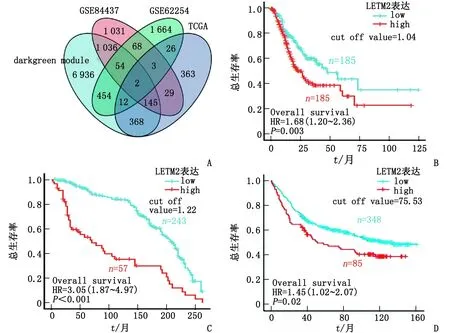
A:韦恩图显示,深绿色模块与3个数据集预后相关基因的数目及交集基因个数;B~D:Kaplan-Merier生存分析曲线显示,LETM2高低表达组胃癌总生存率的差异具有显著性;B:TCGA-STAD;C:GSE62254;D:GSE84437。图2 Kaplan-Merier生存曲线分析LETM2高低表达胃癌患者的总生存时间差异Fig.2 Significant difference between high and low expression of LETM2 in gastric cancer was demonstrated by Kaplan-Merier survival analysis
2.2 LETM2蛋白在不同胃癌组织中的表达分析 LEMT2在癌旁胃黏膜、胃癌原发灶、淋巴结转移灶和肝转移灶中呈异质性表达(图3)。原发灶LETM2的表达高于邻近的正常胃黏膜上皮(6.88±0.24vs2.95±0.13,P<0.000 1);弥漫型胃腺癌中的表达高于肠型(9.29±0.17vs2.84±0.25,P<0.000 1)。此外,LETM2在腹膜转移灶中的表达高于原发灶(9.85±0.47vs6.88±0.24,P<0.05),而原发性灶和肝转移灶表达比较,差别无统计学意义(6.88±0.24vs5.13±0.72,P>0.05);淋巴结转移灶的表达水平低于肿瘤原发灶(3.99±0.21vs6.88±0.24,P<0.05)。

A:癌旁胃黏膜;B:高分化胃腺癌;C:差分化胃腺癌;D:胃癌淋巴结转移灶;E:胃癌腹膜转移灶;F:胃癌肝转移灶。图3 LETM2在胃癌原发灶和转移灶的表达分析(IHC ×200)Fig.3 Immunohistochemical analysis of LETM2 in primary and metastatic loci of gastric cancer (IHC ×200)
2.3 LETM2在胃癌原发灶中表达的临床意义 LETM2高表达与Lauren组织学分型(P<0.001)、pStage(P=0.003)和腹膜转移(P=0.002)呈正相关,与患者年龄、性别、肿瘤大小、淋巴结转移、远处转移无相关性(表1)。LETM2高表达的胃癌患者中位生存时间更短[(85.00±4.23)月vs(93.00±6.78)月,P=0.02],ROC曲线分析显示,胃癌原发灶LETM2 IHC评分对胃癌腹膜转移预测的截止值为6.5,曲线下面积为0.626(95%CI:0.519~0.733),灵敏度为90.0%,特异度为43.0%(图4)。

A:Kaplan-Merier生存曲线显示原发灶LETM2高、低表达组胃癌总生存率差异具有显著性;B:ROC曲线分析原发灶LETM2免疫组织化学染色评分对胃癌腹膜转移灶的预测价值。图4 原发灶LETM2表达水平对胃癌预后及腹膜转移预测评价Fig.4 Evaluation of predictive value of LETM2 expression in primary tumor for prognosis and peritoneal metastasis of gastric cancer
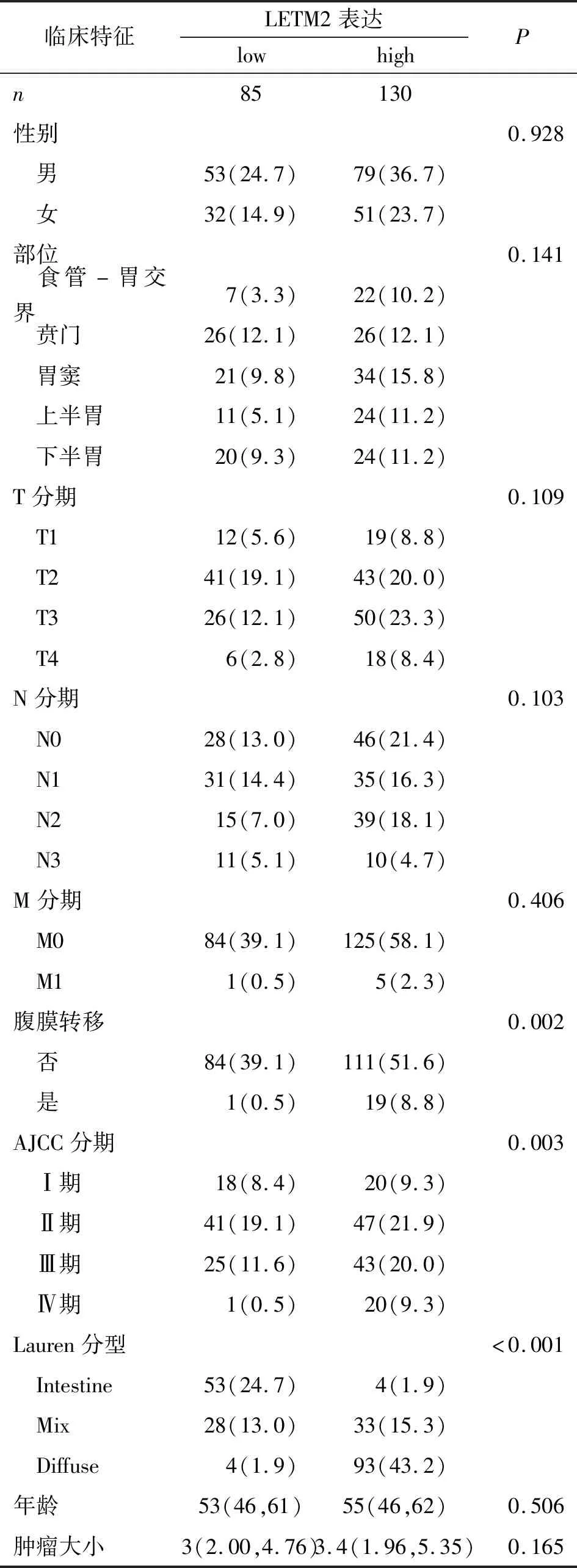
表1 胃癌原发灶LETM2表达与胃癌临床病理特征相关性分析Tab.1 Correlation of LETM2 expression with clinicopathologic characteristics of gastric cancer
2.4 腹水细胞沉渣蜡块LETM2 IHC分析对胃癌腹膜转移的诊断评价 LETM2在胃癌腹膜转移腹水IHC强度大于炎症细胞(图5),以经病理和临床证实阴性的胃癌患者腹腔冲洗液/腹水为阴性对照组,病理和临床诊断明确的胃癌患者腹水细胞沉渣为阳性对照组,LETM2 IHC分析结果显示,20例胃癌腹水细胞LETM2阳性表达率(灵敏度)为15/20(75.0%),阴性表达率为5/20(25.0%);阴性对照组阳性表达率为10/60(16.7%),阴性表达率(特异度)为50/60(83.3%)(表2)。

表2 胃癌腹水转移灶中LETM2免疫组织化学染色检测的灵敏度和特异度分析Tab.2 Sensitivity and specificity of the LETM2 immunohistochemical detection in sections from peritoneal metastatic loci of gastric cancer

A:胃癌患者阴性腹水细胞沉渣蜡块LETM2免疫组织化学染色,右上角为黑框内炎症细胞局部放大;B:胃癌患者阳性腹水细胞沉渣LETM2免疫组织化学染色,右上角为黑框内肿瘤细胞局部放大。图5 腹水沉渣细胞蜡块LETM2免疫组织化学染色(IHC ×200)Fig.5 LETM2 immunohistochemical staining in sections from paraffin-embedded blocks of cells from ascites(IHC ×200)
3 讨 论
腹膜转移是胃癌患者复发和死亡的主要原因之一,预示预后不良,治疗方式选择有限[2]。开发用于早期检测的生物标志物有助于晚期胃癌患者的个体化临床化疗方案选择和改善临床预后。本研究旨在通过生物信息学数据分析和IHC检测,寻找新的腹膜转移预测的敏感和特异性分子标志物。首先基于胃癌数据集GSE62254和WGCNA分析发现腹膜转移相关的枢纽模块,其次基于3个数据集基因表达谱数据(GSE62254、GSE84437和TCGA-STAD)和患者生存数据确定胃癌预后相关的关键基因,二者的交集基因之一LETM2被确定为胃癌腹膜转移和预后相关的候选基因。相比于正常胃黏膜和高分化胃腺癌,IHC在原发灶和腹膜转移中检测到LETM2蛋白在弥漫型胃腺癌和腹膜转移灶中高表达。胃癌原发灶LETM2过表达与胃癌分化程度、病理分期和腹膜转移呈正相关。3个胃癌数据COX回归分析和临床样本IHC分析均发现,LEMT2过表达的胃癌患者总体生存时间短,可能是胃癌患者总生存率的潜在预测指标。
LETM2基因位于第8号染色体,约含有27 000个碱基,编码线粒体内含有LETM1结构域的蛋白2(LETM2),具有4个选择性剪接变异亚型。其中Q2VYF4-1被认为是经典序列,包含胞外螺旋卷曲、转运肽、跨膜区和跨膜螺旋4个基序,而Q2VYF4-2丢失1~47氨基酸,Q2VYF4-3分别丢失1~47和168~215氨基酸,Q2VYF4-4丢失1~214氨基酸,215位氨基酸出现了错义突变(p.Lys215Met)(https://www.uniprot.org/uniprot/Q2VYF4#Q2VYF4-1)。
LETM2在睾丸组织中表达最高,也可以在内分泌组织、胃肠道、生殖系统、骨髓和淋巴组织中检测到。除胶质瘤和淋巴瘤外,大多数肿瘤组织表现出不同强度的LETM2细胞质阳性(https://www.proteinatlas.org/)。本研究LETM2在胃癌细胞质中表达的IHC分析结果与之一致。LETM2在正常胃上皮中表现出较低的表达,但在原发性肿瘤中表现出较高的表达,特别是分化差或腹膜转移病灶。IHC分析结果揭示了LETM2在胃癌进展和腹膜转移的潜在作用,但由于不可切除的原因,来自腹膜转移灶的检测样本数量有限,需要多中心研究进一步验证。本研究未能观察到胃癌原发肿瘤与肝脏转移灶之间的差异表达,且淋巴结转移灶平均阳性率低于肿瘤原发灶。原因可能如下:首先,肝脏和淋巴结的转移灶太小,通过染色区域和强度的测量存在一定偏倚[5]。此外,为减少肝脏染色的非特异性背景,IHC分析过程降低了原发性肿瘤中使用的抗体浓度,增加了切片封闭时间,可能会在一定程度上降低染色强度[6]。再者,众所周知,腹膜转移和实体器官转移具有不同的转移途径[7],笔者假设LETM2可能在腹膜和远处转移中发挥直接或间接的作用,因为LETM2染色在淋巴结血管中强表达,不排除其通过血管促进胃癌淋巴结转移。
本研究发现,胃癌原发灶LETM2 IHC分析对胃癌腹膜转移灶预测具有一定的特异性和敏感性,其在腹水细胞沉渣石蜡包埋切片组织中阳性胃癌细胞的假阳性率和假阴性率相对较低。腹水细胞沉渣蜡块IHC检测与单纯细胞病理检测相比,具有以下优势:一是细胞相对集中,细胞结构完整,提高了细胞学检查的阳性率;二是蜡块可以长期保存,反复切片,进行IHC分析,结合临床病史,确定肿瘤细胞的组织来源。通过比对H-E切片,腹膜转移灶中胃癌细胞IHC强度高于阴性对照组的间皮细胞和炎症细胞,包括组织细胞、中性粒细胞和淋巴细胞等,有助于胃癌腹水转移灶中癌细胞的识别。虽然LETM2 IHC分析腹膜转移灶癌细胞检测具有较高的敏感性,但特异性尚需进行多中心采集胃癌和其他癌症腹膜转移样本进一步验证,且多指标联合检测更有助于提高阳性检测值。
在一项255个胃腺癌样本的研究中,LETM2被认为与TCGA分子亚型之一染色体不稳定型(CIN)相关[8]。本研究发现,LETM2过表达与弥漫性胃腺癌呈正相关,弥漫性胃腺癌与TCGA-STAD分子亚型基因稳定型(GS)重叠,具有高转移潜能。这种研究差异可能源于发病部位和检测方法,病变大都从胃体和胃窦获得,CIN亚型更常见于胃食管连接处,不排除LETM2影响胃癌发病和进展可能因部位不同,分子机制不同,需要体内和体外实验进一步验证。
综上所述,通过WGCNA方法筛选3个数据集中与胃癌预后相关的基因集,将LETM2确定为晚期胃癌腹膜转移和预后的潜在预测标志物。临床样品的IHC分析进一步证实了LETM2预测胃癌细胞腹膜转移的潜能,但多中心多指标联合检测有助于提高晚期胃癌患者腹膜微小转移灶的敏感性和特异性。
