裂褶菌-长枝木霉耦合发酵制备裂褶寡糖
2022-09-08杨若雨吴剑荣张洪涛高敏杰詹晓北
杨若雨,吴剑荣,张洪涛,高敏杰,詹晓北
(糖化学与糖生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
带分支的β-1,3-葡寡糖是一类由真菌所产β-1,3-葡聚糖经生物、化学等方法降解制备得到的功能性寡糖,它具有降低高血压、高血糖、高血脂以及抗肿瘤、益生元等生理活性,性能稳定且安全无毒。大量研究表明,与大分子多糖相比,带分支的β-1,3-葡寡糖具有的生理活性更高更多元,在食品、医药、农业等领域具有更大的发展潜力。目前,常用的制备β-1,3-葡寡糖的方法主要是人工化学合成和多糖降解。人工化学合成虽然能获得非天然糖链,但操作起来费时费力且产量较低,几乎无法用于实际生产。多糖降解又分为酶解和酸解2种方法,其中酶解反应条件温和、水解效率高、操作简便,是现阶段制备β-1,3-葡寡糖最常用的方法。但单菌发酵产多糖后再利用酶解制备寡糖的方法往往效率低,葡聚糖的水不溶性造成水解酶无法充分的发挥作用。混合发酵法是在多糖产生的同时进行酶解,可有效克服直接酶解多糖时水解效率低的问题,同时还可以节约成本。
目前,β-葡聚糖酶是国内外的研究热点,酶活性也显著提高。汤兴俊等[1]从土壤中筛选出1株能产生β-1,3-1,4-葡聚糖酶的枯草芽孢杆菌(Bacillussubtilis),利用紫外线和硫酸二乙酯对此菌株进行复合诱变,使β-1,3/1,4-葡聚糖酶的产量得到有效提高,最终突变株的酶活力可达到154.7 U/mL,是原始菌株的2.42倍。但是相关研究的内切β-1,3-葡聚糖酶的来源微生物并没有列入食品安全目录。长枝木霉是一株产酶体系相对丰富的菌株,已进入国家食品安全目录,它含有内切β-1,3-葡聚糖酶的基因,但是内切β-1,3-葡聚糖酶活力较低。
裂褶菌多糖是一类主链为β-1,3-糖苷键,支链为β-1,6-糖苷键的多糖,在水中可形成稳定的三螺旋结构[2-3]。与人工栽培、固体发酵相比,裂褶菌多糖的深层发酵周期短,多糖产量高且提取简便。例如吴丽华[4]筛选出1株胞外多糖产量较高的裂褶菌,在7 L发酵罐水平多糖产量达到了5.2 g/L。另外,裂褶菌多糖在多个行业中都具有广阔的应用前景,如作为增稠剂用于化妆品领域,作为生物反应调剂提高疫苗治疗效果。SCHULZ等[5]制备裂褶菌多糖-多元醇衍生物具有成薄膜性,这种薄膜不是热塑性,氧气的渗透性低,但对水蒸气的渗透性高,且具有低断裂伸长率,可用于食品保鲜膜。
本文以长枝木霉(Trichodermalongibrachiatum)为原始菌株,通过常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变以提高内切β-1,3-葡聚糖酶产量,获得目的突变株T-6,对突变株T-6所产内切酶的动力学参数和酶学性质进行探索。在此基础上,将突变株T-6与裂褶菌(Schizophyllumcommune)进行混合培养,用于制备裂褶寡糖,并对裂褶寡糖进行了结构表征和抗氧化活性的研究。
1 材料与方法
1.1 实验材料
长枝木霉(GDMCC3.534)和裂褶菌(GDMCC5.43),均购于广东省微生物菌种保藏中心,由本实验室活化并保藏。
ARTP-3常压室温等离子体诱变育种系统,北京思清源生物科技有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;食品级热凝胶,Takeda-Kirin Food Co.Ltd;Sep-Pak C18固相萃取柱,Waters公司;DIONEX ICS-5000+SP-5高压离子色谱系统,美国赛默飞世尔科技公司;Avance Ⅲ 400 MHZ全数字化核磁共振波谱仪,德国布鲁克公司;MALDI-TOF/TOF基质辅助激光解析电离串联飞行时间质谱仪,美国布鲁克·道尔顿公司;截留分子质量10 kDa透析袋,北京索莱宝科技有限公司;NO检测试剂盒,上海碧云天生物技术有限公司。
1.2 培养基
1.2.1 长枝木霉培养基
PDA培养基(g/L):马铃薯(新鲜去皮)200,葡萄糖20,琼脂20,KH2PO43.0,MgSO4·7H2O 1.5,维生素B1(硫胺素)8 mg,pH自然。
种子培养基(g/L):葡萄糖20.0,酵母浸粉15.0,KH2PO46.0,(NH4)2SO42.5,MgSO4·7H2O 0.5,pH 6.0。
发酵培养基(g/L):茯苓多糖60,胰蛋白胨15.0,NaNO35.0,KH2PO410.0,MgSO4·7H2O 1.0,pH 7.0。
1.2.2 裂褶菌培养基
平板培养基(g/L):葡萄糖30.0,酵母浸粉3.0,KH2PO41.0,MgSO4·7H2O 0.5,琼脂20.0,pH自然。
种子培养基(g/L):葡萄糖30.0,酵母浸粉3.0,KH2PO41.0,MgSO4·7H2O 0.5,pH自然。
发酵培养基(g/L):葡萄糖30.0,酵母浸粉3.0,KH2PO41.0,MgSO4·7H2O 0.5,pH自然。
共培养发酵培养基(g/L):葡萄糖30.0,酵母浸粉3.0,KH2PO41.0,MgSO4·7H2O 0.5,pH自然。
1.3 培养方法
PDA培养基培养5 d的长枝木霉用已灭菌的生理盐水15 mL冲洗并置于放置有数粒无菌玻璃球的已灭菌三角瓶中,充分振摇打散,将冲洗液用灭菌纱布(4层)过滤除去菌丝,稀释至106~107个/mL,获得孢子悬浮液。
裂褶菌培养方法:将菌株划线接种在平板培养基中28 ℃培养7 d;取1~2环活化好的菌丝接种于装液量为100 mL/250 mL种子培养基中,28 ℃,170 r/min摇床培养3 d;再以10%的接种量将种子培养液接入50 mL/250 mL发酵培养基中,28 ℃,190 r/min摇床培养24 h。
长枝木霉培养方法:将菌株划线接种在平板培养基中30 ℃培养5 d,制成孢子悬液;以5%的接种量将孢子悬液接种于装液量为50 mL/250 mL种子培养基中,30 ℃,200 r/min摇床培养36 h;再以8%接种量将种子培养液接入50 mL/250 mL发酵培养基中,33 ℃,200 r/min摇床培养144 h。
混菌发酵培养方法:将按照上述方法培养发酵24 h的长枝木霉发酵液离心留沉淀,再按照发酵液体积比1∶1加入到裂褶菌发酵液中,于28 ℃、190 r/min 继续摇床培养6 d。
1.4 长枝木霉的诱变筛选
将长枝木霉的原始菌株利用常压室温等离子体诱变育种系统选择不同的诱变处理时间(30、60、90、120、150、180、210 s),在功率120 W、气流量10 mL/min 的条件下,对萌发敏感体进行诱变,以未经诱变的菌悬液为对照,涂布平板计算致死率选出最佳诱变时间,再通过透明圈初筛和摇瓶复筛得到内切β-1,3-葡聚糖酶的高产菌株。
1.5 粗酶液的制备
取发酵6 d的发酵液,8 000 r/min离心10 min,再将上清液进行抽滤得滤液,置于4 ℃冰箱保存备用。
1.6 裂褶寡糖的提取纯化
裂褶寡糖的提取纯化:取一定体积的混菌发酵上清液,先加入3倍体积的无水乙醇4 ℃醇沉除去小分子多糖沉淀,再加入原混菌发酵上清液体积的7倍体积无水乙醇4 ℃醇沉过夜,离心留沉淀,氮气吹干并复溶,溶液过膜备用。使用Sep-Pak C18固相萃取柱去除蛋白,获得洗脱液。上述洗脱液利用旋转蒸发进行浓缩,再用100~500 Da透析袋透析2 d,去除单糖和离子。最后冻干,得到带分支的β-1,3-葡寡糖样品。
1.7 分析方法
生物量测定方法:取定量的长枝木霉单菌发酵液8 000 r/min离心10 min留沉淀,水洗2~3次后105 ℃烘干至恒重。
蛋白质含量采用BCA蛋白增强盒测定发酵液中蛋白含量。
发酵液残糖采用苯酚-硫酸法测定[6]。发酵液残留还原糖测定采用生物传感分析仪进行分析。
1.8 内切β-1,3-葡聚糖酶的活力测定
总酶活力(Etotal):1 min水解热凝胶得到1 μg寡糖的酶量记为1酶活力单位(U)。
内切β-1,3-葡聚糖酶活力(Eendo):1 min水解热凝胶得到1 μg寡糖(2≤聚合度<6)的量为1 U。
反应体系(5 mL):1.5 mL 20 g/L热凝胶悬浮液(20 g溶于1 L的1 mol/L NaOH)、2.5 mL醋酸钠缓冲液(0.025 mol/L,pH 6.0)与1 mL粗酶液混匀置于50 ℃水浴反应2.5 h后,沸水浴加热10 min终止反应,进行薄层色谱(thin layer chromatography,TLC)板测定。测定方法参考文献[7]。
1.9 内切β-1,3-葡聚糖酶的酶促反应动力学
将粗酶液分别作用于不同浓度的茯苓多糖,测定从底物释放的还原糖生成量确定内切β-1,3-葡聚糖酶的动力学参数。具体方法参考文献[8]并略有改动。以茯苓多糖(1.0~8.0 g/L)为底物在醋酸钠缓冲溶液(50 ℃、pH 6.0、0.025 mol/L)中作用10 min,加入粗酶液开始反应,在不同时间段取样用DNS法测定释放出的还原糖量。
1.10 裂褶寡糖的定量分析
TLC分析:点样2 μL于薄层层析板;以V(正丁醇)∶V(乙醇)∶V(水)=5∶5∶4为展开剂,层析60 min。经显色剂处理后于105 ℃ 显色5 min。显色结束后,采用Image J处理软件对结果进行分析。
基质辅助激光解吸飞行时间质谱(matrix-assisted laser desorption / ionization time of flight mass spectrometry,MALDI-TOF MS)分析:使用FlexControl和 FlexAnalysis 140 3.4.软件进行数据采集和处理。
1.11 裂褶寡糖的单糖组成分析
样品处理方法及分析方法参考文献[9],并略有改动。将纯化后的寡糖样品配制为10 mg/L的单糖混标溶液,包括阿拉伯糖、半乳糖、葡萄糖、木糖、果糖。采用高压离子色谱仪进行分析。
1.12 裂褶寡糖的核磁共振(nuclear magnetic resonance,NMR)测定
取1.6中的20 mg寡糖溶于0.5 mL的D2O装入核磁管,在400 Hz条件下采集1H谱;取1.6中的45 mg 寡糖溶于0.5 mL的D2O装入核磁管,在600 Hz 条件下采集13C谱。
1.13 裂褶寡糖体外抗氧化活性研究
2 结果与分析
2.1 长枝木霉产内切β-1,3-葡聚糖酶的酶学性质
对长枝木霉原始菌株进行预实验发现能检测到内切β-1,3-葡聚糖酶酶活力,但酶活力很低。我们将原始菌株进行ARTP诱变处理,通过透明圈初筛和摇瓶复筛选育出了内切β-1,3-葡聚糖酶酶活力较高且遗传形状稳定的突变株T-6。将原始菌株和突变株T-6在相同条件下进行培养,结果见图1-a。与原始菌株相比,突变株T-6的总酶活力和内切β-1,3-葡聚糖酶酶活力都得到了明显的提高。其中,内切β-1,3-葡聚糖酶酶活力是原始菌株的1.71倍,总酶活力是原始菌株的1.21倍,Eendo/Etotal达到0.50。经发酵条件优化后,菌株T-6的内切β-1,3-葡聚糖酶酶活力可达到212 U/mL。目前,国内关于长枝木霉发酵生产内切β-1,3-葡聚糖酶的报道很少,多是进行发酵生产纤维素酶的研究,比如赵菁[12]利用紫外和微波对出发菌株长枝木霉A002进行诱变筛选,得到1株纤维素酶高产菌株M06,并且通过蛋白质组学分析了产酶增强的机理。本研究通过诱变选育获得的内切β-1,3-葡聚糖酶高产菌株,具有产酶活力高且遗传性状稳定的特点,为下一步的裂褶菌-长枝木霉耦合发酵奠定了基础。
酶促反应动力学主要用来研究酶催化底物的反应速度以及影响其反应速度的包括酶浓度、底物浓度在内的各种因素。我们将长枝木霉单菌发酵粗酶液分别作用于不同浓度的茯苓多糖,用DNS法测定从底物释放的寡糖生成量。根据米氏常数方程,利用Lineweaver-Burk(L-B)双倒数作图法可得到内切β-1,3-葡聚糖酶的动力学参数(图1-b),即Vm=0.110 5 mg/(mL·min),Km=4.005 g/L。相比之下,唐治玉[13]报道木霉菌株LE02来源的内切β-葡聚糖酶的Km值为0.012 8 g/L,郑必胜等[14]报道裂褶菌所产的内切β-1,3-葡聚糖酶的Km为0.881 g/L。因此,不同来源的内切β-1,3-葡聚糖酶的米氏常数差别较大。
进一步研究酶的稳定性,如图1-c和图1-d所示。在30~50 ℃,内切β-1,3-葡聚糖酶的酶活力随温度的升高而提高,最适反应温度为50 ℃,反应温度超过50 ℃时,内切β-1,3-葡聚糖酶酶活力开始随着温度的升高而降低。内切β-1,3-葡聚糖酶在45~60 ℃ 时酶活力较高,相对酶活力均在50 ℃时酶活力的80%以上,当反应温度达到80 ℃时,酶活力的损失很大,仅为50 ℃酶活力的8%。大部分酶在反应时都受其环境pH值的影响,可在某一pH值时达到最大酶反应速度。内切β-1,3-葡聚糖酶在pH 5.0~6.5时酶活力较高,当pH为6.0时酶的反应速度最大。当pH值<6.0时,随着pH值的增大,内切β-1,3-葡聚糖酶酶活力也逐渐增加。但是,当pH继续加大,其内切酶活力并没有继续增加,反而开始下降,到pH值为7时内切β-1,3-葡聚糖酶酶活力只有最大值的35%。因此可以确定该酶的最适pH值为6.0。
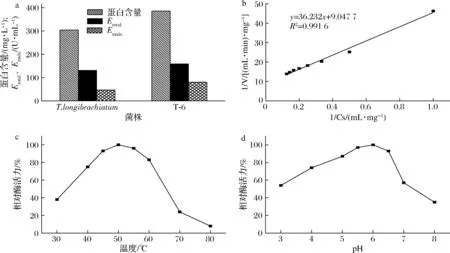
a-T.longibrachiatum及其突变体T-6的酶活力;b-内切β-1,3-葡聚糖酶动力学参数的L-B图;c-温度对内切β-1,3-葡聚糖酶的影响;d-pH值对内切β-1,3-葡聚糖酶的影响图1 内切β-1,3-葡聚糖酶的酶活力和酶学性质Fig.1 Activities and properties of endo β-1,3-glucanase
对长枝木霉所产的内切β-1,3-葡聚糖酶的底物专一性进行研究。分别以热凝胶、茯苓多糖、小核菌多糖、水溶性淀粉和羧甲基纤维素为底物,测定内切β-1,3-葡聚糖酶的底物专一性,底物质量浓度为2 g/L(溶于水),结果如表1所示。水溶性淀粉和羧甲基纤维素的相对酶活力为0,而水溶性淀粉含有α(1→4)糖苷键,羧甲基纤维素含有β(1→4)糖苷键,说明该酶对α(1→4)和β(1→4)糖苷键几乎没有水解作用。但对热凝胶、茯苓多糖、小核菌多糖的水解作用相对较好,均在热凝胶酶活力的70%以上,而这3种物质均含有β(1→3)糖苷键,说明此该酶具有严格的底物专一性。酶的底物专一性与内切β-1,3-葡聚糖酶一致,根据酶的底物专一性可知,此酶为内切β-1,3-葡聚糖酶。

表1 内切β-1,3-葡聚糖酶对不同底物的作用Table 1 The effect of endo β-1,3-glucanase on different substrates
2.2 长枝木霉与裂褶菌耦合发酵制备β-1,3-葡寡糖的结构表征
酶水解生产β-葡寡糖是目前最常用的一种方法,但生产成本增加,而利用微生物耦合发酵方法制备寡糖可以有效解决这个问题,并提高目的寡糖的产量。本研究将裂褶菌-长枝木霉进行耦合发酵,成功制备得到带分支的β-1,3-葡寡糖,并将其命名为-裂褶寡糖(oligo β-1,3-glucans of schizophyllum commune,Sc.bOβG)。寡糖的分子质量分析多采用黏度计、电泳、HPLC以及MS等方法[15]。本研究中制得的寡糖样品可能因发酵过程中水解不完全而存在小分子多糖而更适合采用MALDI-TOF MS法分析裂褶寡糖的分子质量。而薄层层析法具有操作方便、设备简单、显色容易等优点,且展开速度快,常用来快速分析糖的聚合度,但结果不够精确。因此,本研究主要选取了薄层层析串联MALDI-TOF MS的方法对裂褶寡糖进行聚合度分析。
首先将裂褶菌-长枝木霉混菌发酵液进行TLC板测定,结果如图2-a所示。裂褶菌与哈茨木霉共培养得到的发酵上清液中含有小分子质量的裂褶寡糖,且所得的裂褶寡糖聚合度多在7以上,聚合度在7以下的寡糖很少。但TLC跑板的结果只能得到一个粗略的寡糖聚合度范围,并不能准确得出所产带分支的β-1,3-葡寡糖的具体聚合度。因此,将上述样品进行纯化,对纯化的裂褶寡糖再进行 MALDI-TOF MS分析,结果如图2-b所示。由图2可计算得出裂褶寡糖的聚合度为4~15。结果表明,混合发酵所产带分支的β-1,3-葡寡糖的分子质量分布范围较小。
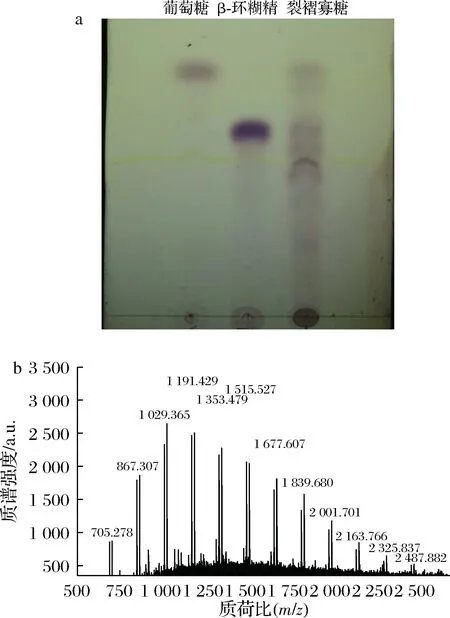
a-Sc.bOβG的TLC板结果;b-Sc.bOβG的MALDI-TOF MS图谱图2 Sc.bOβG的TLC分析和MALDI-TOF MS图谱Fig.2 TLC and MALDI-TOF MS analysis of Sc.bOβG
将纯化的裂褶寡糖利用金属浴水解成单糖,利用离子色谱对寡糖进行单糖组成分析,结果见图3-a。可以看出裂褶寡糖均只由葡萄糖组成。进一步采用NMR对裂褶寡糖进行结构表征,1H-NMR图谱结果如图3-b所示。已纯化的裂褶寡糖的1H-NMR图谱出现了多糖的普通区分信号,在3~4.71 ppm之间的狭窄区域中过度拥挤,表示存在糖残基[16]。与文献进行对比,裂褶寡糖具有4.54 ppm处的β-1,3的β-异头质子信号和4.22 ppm处的β-1,6连接的β-异头质子信号;另外3.07~4.11 ppm之间的一组广泛而密集信号认为是糖的CH2-O和CH-O基团。裂褶寡糖的13C-NMR图谱结果如图3-c所示。与文献进行对比[17],图谱中说明裂褶寡糖中存在发生取代的C-1、C-3、C-6和未发生取代的C-2、C-4。因为峰高和碳原子数呈一定程度上的正相关,发生取代的C-3和未发生取代的C-6的碳原子数相同,发生取代的C-1和未发生取代的C-5的碳原子数相同。结合1H-NMR和13C-NMR图谱,可以推知裂褶寡糖由主链β-1,3-糖苷键和支链β-1,6-糖苷键连接而成,与设想结构一致。
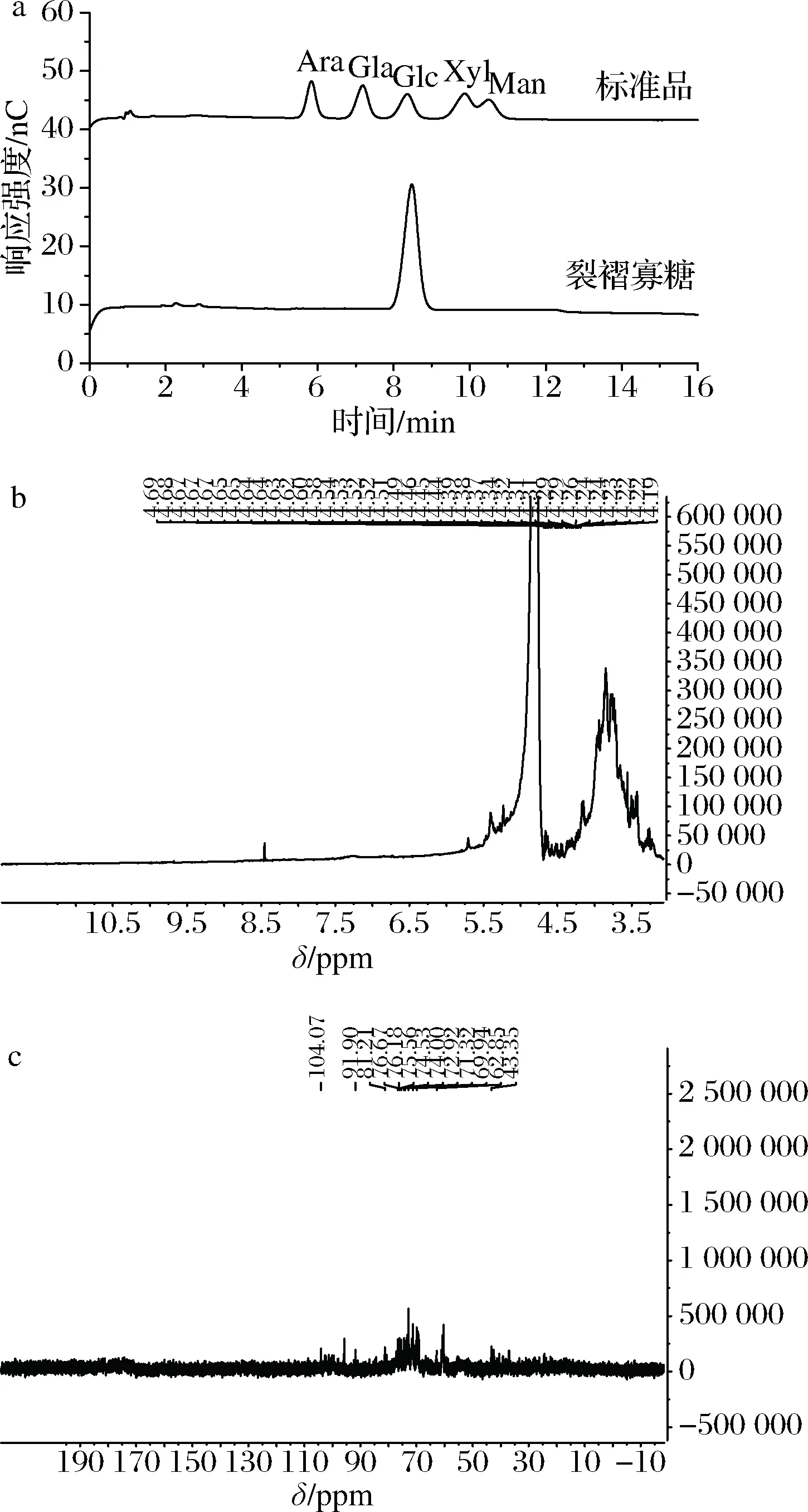
a-单糖组成分析(Ara-阿拉伯糖;Gla-葡萄糖醛酸;Glc-葡萄糖;Xyl-木糖;Man-甘露糖);b-1H-NMR谱图;c-13C-NMR谱图图3 Sc.bOβG的结构表征Fig.3 Structural characterization of Sc.bOβG
2.3 裂褶寡糖的体外抗氧化活性
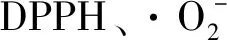
裂褶寡糖的羟自由基清除率结果如图4-c所示。寡糖质量浓度由0增加到2 g/L时,裂褶寡糖对羟自由基的清除率迅速增加,继续增加寡糖浓度,其增速开始减缓,当寡糖质量浓度升至10 g/L时,裂褶寡糖对羟自由基的清除率达到99.4%,说明裂褶寡糖对羟自由基具有较好的清除能力。
最后,对裂褶寡糖的还原力进行测定,裂褶寡糖的还原力(用OD值表示)结果如图4-d所示。当裂褶寡糖质量浓度为10 g/L时,裂褶寡糖还原力(700 nm)为1.129,热凝胶寡糖还原力(700 nm)为0.321,维生素C还原力(700 nm)为3.028。由此得知,裂褶寡糖的还原力高于热凝胶寡糖,但明显低于维生素C。综合上述4种抗氧化作用的评价方法,验证了裂褶寡糖具有较好的抗氧化活性,相比之下,线性寡糖热凝胶的抗氧化效果很差,说明支链寡糖的抗氧化活性明显优于线性寡糖,具有更好的研究价值。
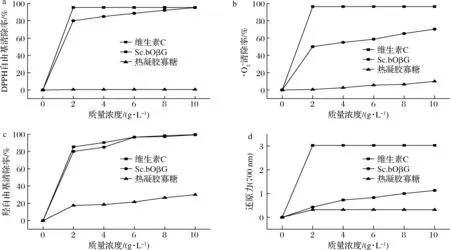
a-DPPH自由基清除活性;清除活性;c-羟自由基清除活性;d-还原力图4 寡糖的抗氧化活性Fig.4 Antioxidant activity of oligosaccharide
近年来,寻找一种价格低廉且能够用于稳定大规模生产功能性寡糖的方法已逐渐成为国内外的研究热点。贺海涛等[19]以蔗糖为底物,通过蔗糖磷酸化酶和细小裸藻中的昆布二糖磷酸化酶耦合催化,最终成功合成β-1,3-葡寡糖。这种酶合成虽然方便快捷,纯度高,但产品成本高,浓度偏低,不适合用于大规模生产,难以用于食品、医药等领域。李菲菲等[20]构建土壤杆菌-毕赤酵母耦合培养体系直接生产热凝胶低聚糖。LIANG等[21]首次构建了由土壤杆菌ATCC-31749和哈茨木霉GIM 3.442组成的共培养发酵体系减弱了热凝胶胶层对土壤杆菌菌体的包裹,成功地建立了微生物发酵直接生产热凝胶低聚糖的方法。这种耦合发酵制备寡糖的方法不仅成功解决了酶制剂成本高的问题,而且有效提高了水解效率。在后期,我们进一步构建了哈茨木霉与小核菌或裂褶菌的耦合发酵体系,分别获得聚合度为5~12和5~15的带有分支的葡寡糖[22]。但是,哈茨木霉、毕赤酵母等在食品中并不被允许使用。本研究前期基础上,选择药食兼用的裂褶菌和达到食品安全要求的长枝木霉,成功建立真菌混合发酵直接生产功能性寡糖的方法,所制备寡糖可应用于食品领域。
3 结论