水稻根围白叶枯病与细菌性条斑病生防细菌的筛选与鉴定
2022-09-08余山红谢关林严成其
余山红,谢关林,严成其
(1.台州市农业科学研究院,浙江 台州 317000;2.浙江大学 生物技术研究所,浙江 杭州 310029;3.宁波市农业科学研究院,浙江 宁波 315040)
水稻白叶枯病(bacterial leaf blight)和水稻细菌性条斑病(bacterial leaf streak,简称细条病)是目前严重威胁我国水稻生产的两种重要细菌病害。白叶枯病菌(Xanthomonasoryzaepv.oryzae,xoo)和细条病菌(Xanthomonasoryzaepv.oryzicola,xooc)是水稻黄单胞菌属下的2个致病变种,亲缘关系极为接近。白叶枯病最早于1884年在日本冈县发现,现在亚洲、非洲、美洲和澳大利亚等地均有发生,是许多国家的检疫对象。该病在亚洲尤其在周年种植水稻的南亚和东南亚地区的危害最为严重,我国大部分地区均有发生,造成水稻减产10%~30%,严重可达50%以上。细条病于1918年在菲律宾首先发现,目前在东南亚各国和非洲中部都有发生。在我国部分地区此病发生严重,常年发生面积在460万hm2以上[1],尤其在我国南方部分稻区危害已超过白叶枯病[2-4]。
因长期大量使用农药造成的自然生态环境污染及稻米农药残留问题越来越突出[5],寻求作物病害防治的新途径一直是人们努力的目标。拮抗细菌是一类重要的生物防治资源,在水稻病害的综合防治中应该发挥更大的作用[6]。然而,由于地域条件、栽培方式及病原菌特性等的不同,生防菌在不同地方对病害的防治效果往往很不一样,因此,根据各地的自然条件因地制宜地筛选适合某一区域使用的菌株是生物防治的关键[7]。本研究从水稻根围分离细菌,通过室内拮抗菌筛选、温室防病效果测定、水稻种子毒性及促生作用测定,以期筛选出有较好防病效果的生防细菌,为白叶枯病和细条病的生物防治提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株
白叶枯病和细条病样品均采自浙江临海,以组织分离法分离,经柯赫氏法则验证后进行鉴定,确认为稻黄单胞菌水稻致病变种(Xanthomonasoryzaepv.oryzae)和稻黄单胞菌稻生致病变种(Xanthomonasoryzaepv.oryzicola)后保存备用。
1.1.2 样品采集
从浙江临海已经混合发生白叶枯病和细条病的水稻田块中,将发病植株连根拔起装入样品袋中带回实验室。
1.1.3 培养基
水稻根围细菌的分离以及对峙培养采用的培养基为牛肉膏蛋白胨琼脂培养基(NA)。配制病原菌和拮抗菌悬浮液使用的为牛肉膏蛋白胨培养基(NB)。
细菌脂肪酸鉴定过程中培养待测菌使用的为胰蛋白胨大豆肉汤琼脂培养基(TSBA)。
1.2 方法
1.2.1 水稻根围细菌的分离
先抖掉水稻根围松散的土粒,将根部切成0.2~0.7 cm的小段,混匀,然后称取5 g混合样品于无菌研钵中碾碎,用50 mL无菌水悬浮制成样本母液。取母液l mL于装有9 mL无菌水的试管中,依次稀释成浓度梯度10-1~10-6的悬浮液,每个梯度分别取10 μL到NA平板上,用灭菌的涂布棒涂布均匀。放置20 min后将平板倒置于28 ℃培养箱中培养72 h,挑取典型菌落进行纯化,4 ℃保存备用。
在校园内,也可能存在车辆超速的问题,对于存在问题的车辆,就可以利用智能警告系统对其行文进行警告,从而对车辆进行及时的处理。如果出现没能及时处理的情况,就可以给指定人员发送声音、邮件和短信,通告交通管理人员及时进行防范,避免引发事故[5]。该技术还可以和地图结合起来,通过记录车辆所经过的摄像头,从而对车辆进行定位,并且能够在地图上还原车辆行驶的轨迹,并对车辆的位置进行查询,保证交通管理的精度。
1.2.2 生防细菌的筛选
当三角瓶中的NA培养基融化后冷却到45 ℃左右时,按体积比10∶1加入已在摇床NB培养基中振动培养72 h的病原菌悬浮液,摇匀,倒平板静置4 h,在带菌平板中央用接种环点接待测的细菌菌株。48 h后观察并测量抑菌圈的直径,挑选出同时对Xoo和Xooc抑菌能力最强的5个菌株。
1.2.3 温室生防菌浸种防病试验
将培养48 h的5株生防菌分别用无菌水配成浓度约为1.0×108mL-1的菌悬液。将水稻种子放入菌悬液中浸种48 h,催芽24 h后温室盆栽播种。以清水浸种作对照。待水稻幼苗生长至1心2叶期时饱和喷雾接种浓度约为1.0×108mL-1的病原菌菌悬液,薄膜覆盖保湿24 h。接种14 d后统计白叶枯病和细条病的发生情况,记载发病率和病级,病情分级标准参照国家标准[8-10]进行调查统计。
1.2.4 生防菌对水稻种子毒力和促生效果测定
将培养48 h的5株生防菌分别用无菌水配成浓度约为1.0×108mL-1的菌悬液。将水稻种子分别放入菌悬液中浸种48 h,催芽24 h后,播种于铺有湿润滤纸的培养皿中,以清水浸种作为对照。7 d后统计各处理种子的发芽率,测量幼苗根长、苗长。
脂肪酸甲基酯鉴定(FAMEs)试验方法按美国MIDI公司的操作手册进行[11],菌株在TSBA培养基上28 ℃培养16~24 h,收集菌体40 mg,经皂化、脂化、抽提和洗涤,获得脂肪酸甲脂。脂肪酸鉴定采用美国Agilent 6890型气相色谱及MIDI公司开发的全自动微生物鉴定系统MIS 4.5(microbial identification system)和LGS 4.5(1ibrary generation software)。
16S rDNA序列测定参照已发表的细菌16S rDNA基因的通用引物序列[12]。正向引物27F为5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R为5′-GGTTACCTTGTTACGACTT-3′,引物由上海生工生物工程技术服务有限公司合成。扩增反应总体积为50 μL,反应条件为95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸2 min,共进行35个循环;最后72 ℃延伸10 min。PCR反应在PTC-200型热循环仪上进行,取5 μL扩增产物在1.0%琼脂糖凝胶上进行电泳检测扩增效果。PCR产物纯化与测序工作委托北京六合华大基因科技股份有限公司完成,将测得的细菌16S rDNA序列登陆NCBI数据库进行比对。
1.2.6 数据统计与分析
试验数据采用DPS软件进行分析[13]。
2 结果与分析
2.1 生防细菌筛选结果
从水稻根围土壤共分离到细菌51株,经过初筛后,获得21株同时对Xoo和Xooc有拮抗能力的细菌,其中抑菌圈直径小于20 mm的有16株,大于20 mm的有5株,根据菌落形态将其编号为A1、A2、B1、B2、C。
2.2 生防菌浸种对白叶枯病和细条病的防治效果
5个生防菌浸种处理对白叶枯病与细条病都有不同程度的预防效果(表1),其中以菌株C和B2防效最为显著,对白叶枯病的防效分别达到54.6%、49.9%,对细条病的防效分别达到57.4%、42.6%。
2.3 生防菌促生能力及毒力测定结果
对综合拮抗能力最强的5个菌株进行水稻种子毒力测定,并检验是否具有促进种子萌发的效果。结果发现,5个菌株对稻种的生活力影响各不相同。菌株A1抑制水稻幼苗生长,A2抑制种子发芽,B1同时促进根和幼苗的生长,B2在促进种子发芽的同时抑制根的生长,C能促进根的生长(表2)。
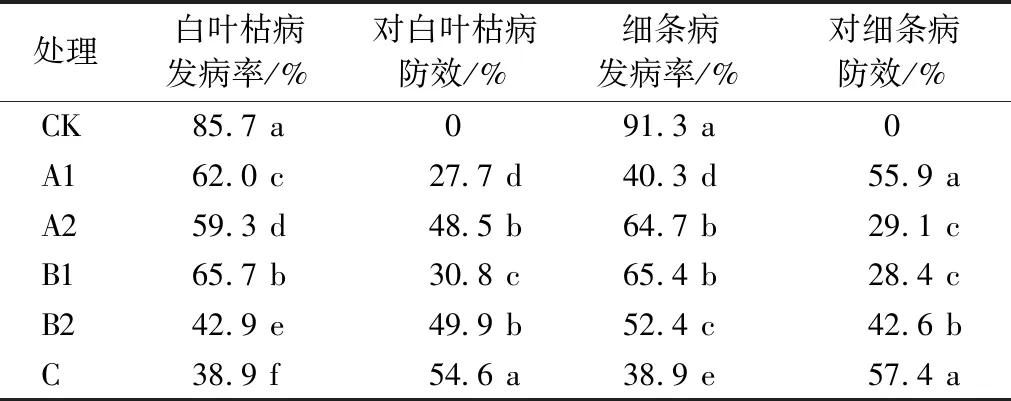
表1 温室生防菌对水稻白叶枯病与细条病的防治效果
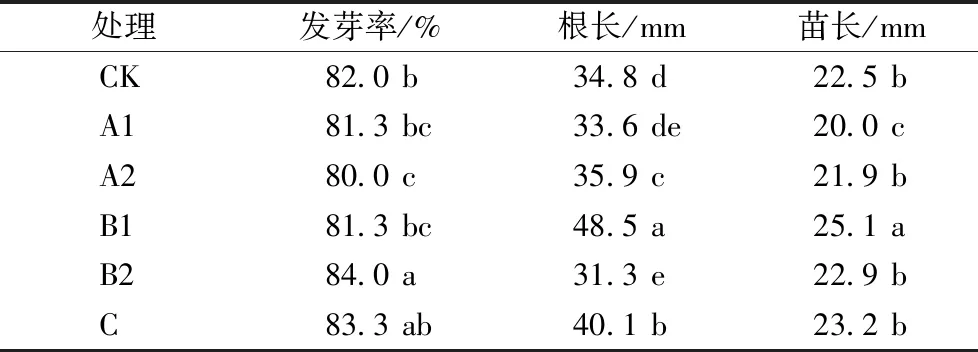
表2 拮抗菌对稻苗生活力的影响
2.4 生防菌的鉴定
经过对A1、A2、B1、B2、C 5种生防菌进行FAMEs测定及16S rDNA序列比对,将其鉴定为2株洋葱伯克氏菌(Burkholderiacenocepacia)、2株解淀粉芽孢杆菌(Bacillusamyloliquefaciens)和1株恶臭假单胞菌(Pseudomonasputida)(表3)。
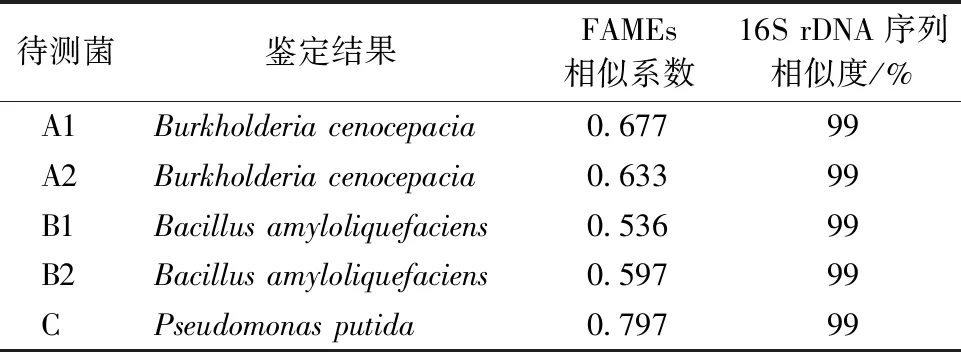
表3 待测菌的脂肪酸分析及16S rDNA鉴定结果
3 小结与讨论
利用拮抗细菌生物防治植物病害是当今植物病害十分活跃的研究课题,并已显示出良好的应用前景[14-15],使用对病原菌有拮抗作用的细菌是一种既经济有效又无副作用的防治途径[16]。而拮抗菌的筛选是一切生物防治的基础,国内筛选、利用拮抗菌进行白叶枯病或细条病的生物防治已有大量研究,但筛选同时对两种病原菌有抑制能力的生防菌还不多,已开发成能真正用于大田防治的生防菌剂更是少之又少。
目前,国内正式登记用于防治水稻白叶枯病和细条病的生物活性制剂仅有3种,分别是德强生物股份有限公司生产的100亿芽孢·g-1枯草芽孢杆菌可湿性粉剂(PD20140340)(用于防治白叶枯病)、陕西恒田生物农业有限公司生产的80亿芽孢·g-1甲基营养型芽孢杆菌LW-6可湿性粉剂(PD20181621)(用于防治细条病)和江苏省苏科农化股份有限公司研制出的60亿芽孢·mL-1解淀粉芽孢杆菌LX-11悬浮剂(PD20190018)(在两种病害上同时获得登记)。
此外,杨俊誉等[17]发现,农杆菌属(Agrobacterium)、短状杆菌属(Brachybacterium)、克雷伯菌属(Klebsiella)、鞘氨醇杆菌属(Sphingobacterium)和葡萄球菌属(Staphylococcus)为感染白叶枯病水稻植株特有的内生拮抗细菌属,而节杆菌属(Arthrobacter)和考克斯菌属(Kocuria)仅存在于健康植株中。高玲玲等[18]从云南水稻根部分离到NR-18和NR-79两株多黏类芽孢杆菌(Paenibacilluspolymyxa)和枯草芽孢杆菌(Bacillussubtilis)NR-64。张芬等[19]从水稻根际土壤样品中得到枯草芽孢杆菌(Bacillussubtilis)T429、伯克氏菌属(Burkholderia)。刘邮洲等[20]从稻田分离获得枯草芽孢杆菌(Bacillussubtilis)。胡凌鸣等[21-23]从校园植物根际土壤中分离到淡紫灰链霉菌(Streptomyceslavendulae)S1-10和玫瑰轮丝链霉菌(Streptomycesroseoverticillatus)Sr-63。李生樟等[24-26]从蔬菜根际土壤中分离到蜡样芽孢杆菌(Bacilluscereus)512、虫媒假单胞菌(Pseudomonasentomophila)1257、贝莱斯芽孢杆菌(Bacillusvelezensis)504。邹路路等[27]从校园内健康孝顺竹叶分离纯化得到枯草芽孢杆菌(Bacillussubtilis)BME 17。朱润杰[28]从作物根际土壤中分离得到变棕溶杆菌(Lysobacterbrunescens)OH23。张琪等[29-30]从腐烂的水果、发霉的食物、土壤、空气等不同生境中筛选到灰黄青霉(Penicilliumgriseofulvum)Pg-35、皮落青霉(Penicilliumcrustosum)Pc-28和菌核曲霉(Aspergillussclerotiorum)As-75。陈思宇[31]从江苏植物根围土壤中分离出枯草芽孢杆菌(Bacillussubtilis)、荧光假单胞菌(Pseudomonasfluorescens)、海洋解淀粉芽孢杆菌(Bacillusamyloliquefacien)。潘洁莉[32]分别从土壤、空气中采集到越南伯克氏菌(Burkholderiavietnamiensis)Ja2和假单胞菌(Pseudomonas)Dc3。黄梦桑等[33]从辣椒根际土壤中分离筛选到高地芽孢杆菌(Bacillusaltitudinis)181-7。以上分离出的菌株均同时对白叶枯病菌和细条病菌有抑菌能力。
本研究中,我们也发现发病水稻植株根围存在着大量能够抑制白叶枯病菌和细条病菌生长的拮抗细菌,如洋葱伯克氏菌(Burkholderiacenocepacia)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、恶臭假单胞菌(Pseudomonasputida)等,而且部分细菌还具有促进水稻种子萌发和根系及地上部生长的作用,具有很好的应用前景。利用拮抗细菌进行生物防治受植物、病原物、拮抗细菌和环境条件等多种因素的影响,特别是其他微生物的竞争作用,使拮抗细菌的种群数量发生较大变化[34-35],因此,生防细菌的定殖能力对于病害的防治效果非常重要。而根围细菌能够在寄主植物周围环境中很好定殖,不易受环境条件的影响,一般比外来拮抗菌具有更强的定殖能力,在病害的生物防治上更具有优势。由此可见,植物根围是获取生防菌的良好来源。本研究拓宽了水稻白叶枯病和细条病生防菌的分布范围,为该病害的生物防治提供了重要资源。
