皮质酮诱导的PC12细胞梯度应激损伤模型的构建及评价*
2022-09-08李明哲徐龙飞陈照立王新兴蒲玲玲刘伟丽王天辉
李明哲,徐龙飞,2,陈照立,王新兴,蒲玲玲,刘伟丽,王天辉△
(1.军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050;2.天津体育学院天津市运动生理与运动医学重点实验室,天津 301617)
应激及创伤性事件对多种疾病的发生发展影响巨大,常常作为疾病发病或恶性转归的重要诱因[1-3]。其中,以精神类疾病最为典型,常见的疾病包括抑郁症、躁狂和创伤后应激障碍等,即便是遗传背景主导的某些疾病如精神分裂症、双相情感障碍等也常常是遗传基因和应激性事件共同作用的结果[4,5]。因此,应激反应的相关研究一直是医学领域的研究重点。本研究目的是为细胞应激水平的评估和细胞应激损伤调控研究提供一种可行的实验对象,构建一种应激激素诱导的细胞梯度应激损伤模型。相比于经典的应激激素诱导的细胞应激损伤模型,该模型通过调节应激激素的干预水平,模拟生物体系不同的应激损伤程度,构建一种梯度变化的应激损伤状态,为应激损伤的检测评估技术开发和应激基础研究提供一种良好的、可行的实验对象。
在机体发生应激反应时,可激活下丘脑-垂体-肾上腺轴(hypothalamic-pituitaryadrenal axis,HPA),并促进重要的应激激素——糖皮质激素(glucocorticoids,GC)大量分泌[6-8]。中枢神经系统作为应激损伤的重要靶点,比其他器官集中更高浓度的糖皮质激素受体,因此是对应激特别敏感、易受应激损伤的组织[8-10]。所以,神经细胞是构建应激损伤模型的良好选择。PC12细胞是一种常用的神经细胞株。其来源于一种可移植的大鼠嗜铬细胞瘤,该细胞对神经生长因子(nerve growth factor,NGF)有可逆的神经元显形反应,该细胞不合成肾上腺素。其具有可传代的特点,广泛应用于神经生理和神经药理学研究[11]。因此可作为应激损伤细胞模型的实验主体。
1 材料与方法
1.1 细胞来源
大鼠肾上腺嗜铬细胞瘤细胞PC12,购于上海中乔新舟生物科技有限公司。
1.2 主要试剂与仪器
高糖杜氏培养基(Dulbecco’s modified eagle medium,DMEM,货号:L110KJ,BasalMedia)、磷酸盐缓冲液(Phosphate buffered solution,PBS,货号:P1020,Solarbio)、胎牛血清(Fetal bovine serum,FBS,货号:04-001-1ACS,BI,Israel)、青链霉素双抗(货号:SV30010,Cytiva,America)、胰蛋白酶-EDTA消化液(0.25%),不含酚红(货号:T1300,Solarbio)、皮质酮(货号:M5533,Abmole,America)、二甲基亚砜(Dimethyl sulfoxide,DMSO,货号:D8372-500ml,Solarbio)、96孔平底细胞培养板(货号:701001,NEST)、6孔细胞培养板(货号:703001,NEST)、T25细胞培养瓶(货号:707003,NEST)CCK-8试剂盒(Cell counting Kit-8,CCK-8,货号:M4839,Abmole,America)、丙二醛(MDA)检测试剂盒(货号:A003-1,南京建成)、总超氧化物歧化酶(T-SOD)检测试剂盒(货号:A001-1,南京建成)、BCA蛋白浓度测定试剂盒(货号:PC0020,Solarbio)、NAD(H)测定试剂盒(货号:A114-1-1,南京建成)、乳酸脱氢酶检测试剂盒(货号:BC0685,Solarbio)、电子天平(型号:ARA1140,OHAUS,America)、台式高速冷冻离心机(型号:TLL-C,北京四环科学)、超声波细胞粉碎机(型号:SCIENTZ-ⅡD,宁波新芝生物科技有限公司)、酶标仪(型号:Multiskan MK3,Thermo,Germany),超净台(型号:GH802-2,天津生物净化设备厂)、荧光倒置显微镜(型号:DMIRB,OLMPUS,Switzerland)。
1.3 细胞培养
PC12细胞培养于完全培养基内(DMEM培养基+10%FBS+1%青链霉素双抗),于37℃,5%CO2的恒温培养箱内培养。当细胞密度达到70%~80%的对数生长期时,传代培养或用于实验研究。
1.4 皮质酮诱导的PC12细胞梯度应激损伤模型的构建
1.4.1 皮质酮溶液的配制 皮质酮的分子式:C21H30O4;分子量:346.46;溶解性:10 mmol/L in DMSO;储存方式:固体粉末可在-20℃下长期保存,溶液密封后可于-20℃下保存一个月。解冻后,称取10 mg皮质酮粉末并溶解于2.8863 ml DMSO中,配成10 mmol/L皮质酮溶液备用。
1.4.2 皮质酮诱导PC12细胞应激损伤后的细胞活力检测 检测不同浓度应激激素(皮质酮,0~1 000μmol/L)在经过不同干预时间(8~48 h)后PC12细胞活力,描述应激激素对细胞活力的影响,筛选模型构建的最佳药物剂量和干预时间。向已铺满PC12细胞的96孔板中加入不同浓度的皮质酮溶液(DMSO,pH:7.4),共设置了7个浓度梯度(25 μmol/L、50μmol/L、100μmol/L、200μmol/L、400 μmol/L、600μmol/L、1 000μmol/L),每组5个复孔,同时设置了细胞未做任何处理的实验对照组(0 μmol/L),将其置于5%CO2、37℃的恒温培养箱中培养。分别培养8 h、12 h、24 h、48 h后,用无菌的PBS缓冲溶液洗去各孔中的培养基,重新换上新的培养基和血清(100μl),同时向孔板中加入CCK-8溶液(10μl),37℃下共同孵育1 h,酶标仪测定450 nm处吸光度,计算细胞活力。
细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%;A(加药):具有细胞、CCK溶液和不同浓度化合物溶液的孔的吸光度;A(空白):具有培养基和CCK溶液而没有细胞的孔的吸光度;A(0加药):具有细胞、CCK溶液而没有化合物溶液的孔的吸光度。
1.4.3 皮质酮诱导的PC12细胞梯度应激损伤模型的干预条件筛选 依据皮质酮诱导PC12细胞应激损伤后的细胞活力检测结果,选择模型的最佳干预条件。在满足细胞活力保持在半数失活率以下的前提下,选择皮质酮的干预时间为12 h;皮质酮的干预浓度梯度为25μmol/L,50μmol/L,100μmol/L,150μmol/L,200μmol/L,同时设置DMSO溶剂对照组(solvent control,SC)和细胞未做任何处理的空白对照组(0μmol/L)。将各干预组细胞置于含5%CO2、37℃恒温培养箱中共同培养12 h后,进行模型构建效果的检测评价。
1.5 皮质酮诱导的PC12细胞梯度应激损伤模型的评价
1.5.1 微量法检测细胞中MDA及SOD水平 将对数生长期的细胞接种于T25细胞培养瓶内,每瓶5×105cells,每组设置5个重复组。各干预组内细胞MDA和SOD水平检测按相关试剂盒说明书操作执行。
1.5.2 分光光度法检测细胞中NADH和LDH水平 将对数生长期的细胞接种于6孔细胞培养板内,每孔2×105cells,每组设置5个复孔。各干预组内细胞NADH和LDH水平检测按试剂盒说明书操作执行。
1.6 统计学处理
2 结果
2.1 皮质酮对PC12细胞活力的干预效应检测
实验结果显示,随着PC12细胞暴露在皮质酮溶液中时间的延长和皮质酮浓度的增加,细胞活力逐渐下降(表1)。同时,皮质酮的干预时间为12 h,干预浓度在200μmol/L以下时,细胞活力可保持在50%以上,各组细胞活力呈现明显的梯度下降趋势,且各组间细胞活力存在统计学差异(P<0.01)。因此,可选择此条件作为皮质酮诱导PC12细胞应激损伤的处理条件。
Tab.1 Changes in cell viability after corticosterone intervention in PC12 cells(%,±s,n=5)

Tab.1 Changes in cell viability after corticosterone intervention in PC12 cells(%,±s,n=5)
*P<0.05,**P<0.01 vs0μmol/L group;#P<0.05,##P<0.01 vs25μmol/L group;△P<0.05,△△P<0.01 vs50μmol/L group;▲P<0.05,▲▲P<0.01 vs 100μmol/L group;▽P<0.05,▽▽P<0.01 vs 200μmol/L group;▼P<0.05,▼▼P<0.01 vs 400μmol/L group;○P<0.05,○○P<0.01 vs600μmol/L group
Group(μmol/L) 8 h 12 h 24 h 48 h 0 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 25 0.966±0.022 0.940±0.007** 0.908±0.030 0.802±0.040**50 0.874±0.016**## 0.870±0.014**## 0.859±0.083** 0.727±0.045**##100 0.831±0.024**## 0.844±0.022**## 0.766±0.064**## 0.614±0.047**##△△200 0.684±0.014**##△△▲▲ 0.724±0.048**##△△▲▲ 0.542±0.043**##△△▲▲ 0.336±0.034**##△△▲▲400 0.466±0.036**##△△▲▲▽▽ 0.374±0.040**##△△▲▲▽▽ 0.260±0.031**##△△▲▲▽▽ 0.119±0.011**##△△▲▲▽▽600 0.379±0.059**##△△▲▲▽▽▼▼ 0.277±0.037**##△△▲▲▽▽▼▼ 0.206±0.034**##△△▲▲▽▽ 0.061±0.004**##△△▲▲▽▽1000 0.309±0.018**##△△▲▲▽▽▼▼○0.232±0.015**##△△▲▲▽▽▼▼○○0.098±0.022**##△△▲▲▽▽▼▼○ 0.028±0.004**##△△▲▲▽▽▼▼
2.2 皮质酮诱导的PC12细胞梯度应激损伤模型的验证与评价
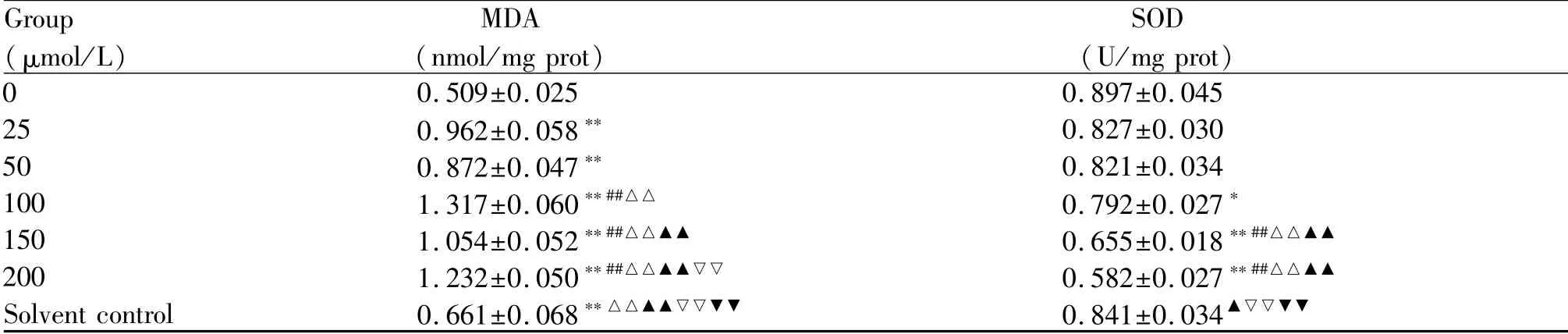
2.2.1 皮质酮诱导的PC12细胞梯度应激损伤模型MDA及SOD水平变化 检测结果显示,不同浓度皮质酮干预PC12细胞后,胞内MDA水平呈上升趋势。相比于空白对照组,皮质酮浓度在25μmol/L以上的各组间的MDA水平差异有统计学意义(表2)。胞内SOD水平呈下降趋势。相比于空白对照组,与皮质酮浓度为25μmol/L和50μmol/L的两组间的SOD水平差异虽无统计学意义,但仍然存在下降趋势(表2)。通过这两个指标基本可确认随着皮质酮浓度的升高,细胞应激损伤逐渐加重。
Tab.2 Changes of MDA and SOD after corticosterone intervention in PC12 cells(±s,n=5)
Tab.2 Changes of MDA and SOD after corticosterone intervention in PC12 cells(±s,n=5)
*P<0.05,**P<0.01 vs0μmol/L group;#P<0.05,##P<0.01 vs25μmol/L group;△P<0.05,△△P<0.01 vs50μmol/L group;▲P<0.05,▲▲P<0.01 vs 100μmol/L group;▽P<0.05,▽▽P<0.01 vs 150μmol/L group;▼P<0.05,▼▼P<0.01 vs 200μmol/L group
Group(μmol/L)MDA(nmol/mg prot)SOD (U/mg prot) 0 0.509±0.025 0.897±0.045 25 0.962±0.058** 0.827±0.030 50 0.872±0.047** 0.821±0.034 100 1.317±0.060**##△△ 0.792±0.027*150 1.054±0.052**##△△▲▲ 0.655±0.018**##△△▲▲200 1.232±0.050**##△△▲▲▽▽ 0.582±0.027**##△△▲▲Solvent control 0.661±0.068**△△▲▲▽▽▼▼ 0.841±0.034▲▽▽▼▼
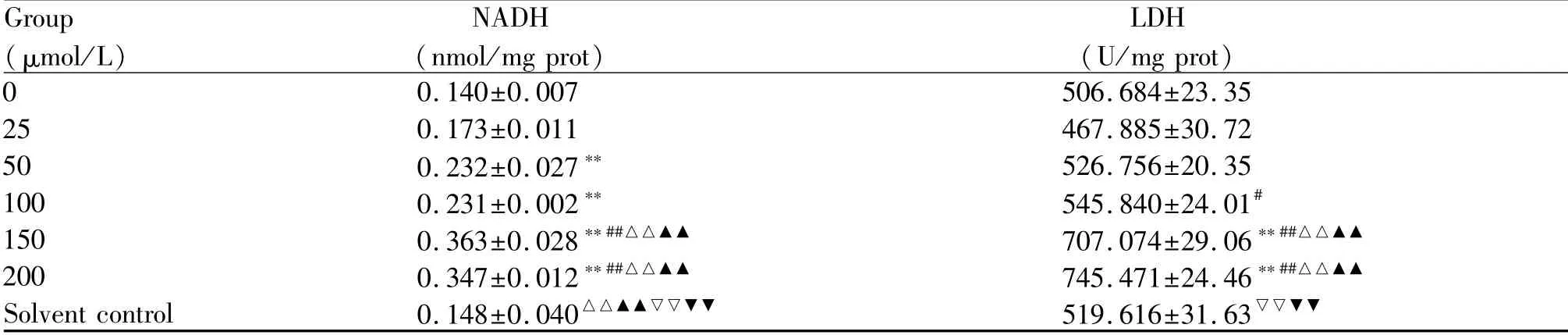
2.2.2 皮质酮诱导的PC12细胞梯度应激损伤模型NADH及LDH水平变化 检测结果显示,不同浓度皮质酮干预PC12细胞后,胞内NADH水平呈上升趋势。相比于空白对照组,与皮质酮浓度在50 μmol/L以上的各组间的NADH水平差异有统计学意义,与皮质酮25μmol/L组间的NADH水平差异无统计学意义,但仍呈现上升趋势(表3)。不同浓度皮质酮干预PC12细胞后,细胞LDH水平呈上升趋势。相比于空白对照组,与皮质酮浓度在150 μmol/L以上的各组间的LDH水平差异有统计学意义,而与皮质酮100μmol/L及以下的各组间的差异无统计学意义,提示皮质酮浓度在100μmol/L以下时对细胞的损害较低(表3)。
Tab.3 Changes of NADH and LDH after corticosterone intervention in PC12 cells(±s,n=5)
Tab.3 Changes of NADH and LDH after corticosterone intervention in PC12 cells(±s,n=5)
*P<0.05,**P<0.01 vs 0μmol/L group;#P<0.05,##P<0.01 vs 25μmol/L group;△P<0.05,△△P<0.01 vs 50μmol/L group;▲P<0.05,▲▲P<0.01 vs 100μmol/L group;▽P<0.05,▽▽P<0.01 vs 150μmol/L group;▼P<0.05,▼▼P<0.01 vs 200 μmol/L group
Group(μmol/L)NADH(nmol/mg prot)LDH (U/mg prot) 0 0.140±0.007 506.684±23.35 25 0.173±0.011 467.885±30.72 50 0.232±0.027** 526.756±20.35 100 0.231±0.002** 545.840±24.01#150 0.363±0.028**##△△▲▲ 707.074±29.06**##△△▲▲200 0.347±0.012**##△△▲▲ 745.471±24.46**##△△▲▲Solvent control 0.148±0.040△△▲▲▽▽▼▼ 519.616±31.63▽▽▼▼
3 讨论
细胞梯度应激损伤模型是研究及评估细胞应激损伤程度的可行实验模型,可用于模拟不同应激水平的实验对象,满足阶梯型应激增强的实验需求。依据皮质酮诱导PC12细胞应激损伤后的细胞活力检测结果,筛选出模型的最佳药物浓度(0μmol/L~200μmol/L)和干预时间(12 h),满足各浓度梯度组的细胞活力均在半数衰减量以下,从而排除细胞活力差异过大而产生的混杂因素影响。
为了评估细胞梯度应激模型的构建是否成功,选择MDA、SOD、NADH及LDH四个生化指标与空白组进行比较。MDA和SOD是评价细胞应激损伤情况的常用指标。生物体内,自由基作用于脂质发生过氧化反应,氧化终产物为丙二醛,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性[12,13]。MDA水平是反映机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度[12,13]。SOD是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用,与很多疾病的发生、发展密不可分[14,15]。检测模型MDA和SOD水平变化有助于评估细胞的应激损伤情况。研究结果显示,不同浓度皮质酮干预PC12细胞后,胞内MDA水平呈上升趋势,胞内SOD水平呈下降趋势,基本可确认随着皮质酮浓度的升高,细胞应激损伤程度逐渐加重。
NADH是评价细胞氧化应激的重要指标。研究显示NADH水平的增加,可刺激离体脑线粒体H2O2的产生增加约10倍。线粒体ROS积累的增加与NADH/NAD+比值的增加有关[16,17]。这主要由于NADH过量积累导致还原应激增加[18],并可能直接导致O2
·-和H2O2的产生。特别是过量的NADH可被NADH氧化酶(NADH oxidase,NOxs)利用来产ROS[19,20]。有证据表明,在大多数哺乳动物细胞中,缺氧增加细胞NADH水平和ROS的产生。在低氧条件下,线粒体NADH和FADH2不能被线粒体电子传递链(electron transfer chain,ETC)氧化,导致这些还原当量的积聚和随后的还原应激[21]。还原应激能使氧的单电子还原形成O2·-,因此是缺氧条件下活性氧产生增加的基础[21]。本研究发现,随着皮质酮浓度的增加,干预后的细胞内NADH水平呈上升趋势,可以反映出细胞处于梯度应激增强的状态。
LDH广泛存在于动物、植物、微生物和离体细胞内,是糖酵解的终末限速酶,可催化丙酮酸和乳酸可逆反应,伴随着NAD+/NADH之间互变。当细胞损伤破裂时,LDH会溢散胞外,因此常作为临床上指示病情进展的重要指标。LDH升高产检与心肌梗死、肝疾病及血液疾病[22,23]。本研究发现当皮质酮浓度增加到150μmol/L以上时,细胞LDH水平呈显著上升,而皮质酮浓度在100μmol/L以下时,LDH的变化相比于空白对照组无统计学差异。这一方面证明细胞应激程度在逐渐上升,也证明皮质酮对细胞活力的影响较小,可满足细胞应激程度的稳定维持。
本研究结合应激损伤的研究现状,构建一种方便可行的细胞梯度应激损伤模型。该方法通过改变激素干预浓度的变化,实现细胞模型应激损伤程度的梯度变化,可以满足后期应激损伤评价及基础研究干预的实验需求。
