黑果枸杞汁对大鼠酒精性肝损伤的保护作用*
2022-09-08曹建民周海涛田一鸣宋滢洋蒋若雨
胡 戈,曹建民,周海涛,张 静,田一鸣,宋滢洋,蒋若雨
(1.常州大学 体育学院,常州 213164;2.北京体育大学 运动人体科学学院,北京 100084;3.北京联合大学,北京 100101;4.北京联合大学生物活性物质与功能食品北京市重点实验室,北京 100191)
我国饮酒人群比例和酒精性肝病患病率均呈现上升趋势,严重危害人民健康[1]。慢性炎症是酒精性肝病发生、发展的关键诱因,荟萃研究表明,慢性酒精摄入可导致Toll样受体4(toll-like receptors4,TLR4)/p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号激活,从基因水平增加多种促炎细胞因子表达,继而诱发肝脏损伤[2]。黑果枸杞(Lycium ruthenicum Murr.)具有多种活性成分,以往研究多聚焦于其抗氧化作用[3,4]。相关研究表明,黑果枸杞具有降低血清炎症因子水平,保护肝脏结构和功能的潜在作用[5]。本研究通过建立酒精性肝损伤大鼠模型,探讨黑果枸杞汁通过介导TLR4/p38 MAPK信号通路,进而调节炎性因子水平,预防和缓解酒精性肝损伤发生与发展,保护肝脏结构和功能正常的机制。
1 材料与方法
1.1 实验动物与分组
60只SPF级雄性SD大鼠,6周龄,体重170~200 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证编号:SCXK(京)2019-0010。北京体育大学SPF级动物实验室饲养,温度20~24℃,相对湿度55%~75%,正常昼夜节律。经7 d适应性饲养后,随机分为5组:对照组(C)、模型组(M)、低剂量黑果枸杞汁组(LLM)、中剂量黑果枸杞汁组(MLM)、高剂量黑果枸杞汁组(HLM),每组12只。
1.2 仪器
主要仪器包括RM 2016病理切片机(德国Leica公司);Pannoramic MIDI病理切片扫描仪(匈牙利3D HISTECH公司);BX51F32H01光学显微镜(日本Olympus Corporation);DR-200BS酶标分析仪(无锡华卫德朗仪器有限公司);Allegra 25R台式高速离心机、AU480生化分析仪(美国Beckman Coulter公司)。
1.3 模型建立与营养干预方案
1.3.1 酒精性肝损伤模型建立[6]62°牛栏山二锅头,稀释成400 g/L乙醇溶液,M组、LLM组、MLM组和HLM组灌胃剂量8 g/(kg·d),体积20 ml/kg,于13:00和19:00分2次完成,C组灌胃等体积蒸馏水,每日进行。
1.3.2 营养干预方案 黑果枸杞汁(原花青素2.08%,多糖4.9%,总花色苷3.2%,深圳金瑞丰生物科技公司提供)。LLM组、MLM组和HLM组分别以2.4、4.8和9.6 ml/(kg·d)(相当于人体推荐剂量的0.5、1.0、2.0倍)进行黑果枸杞汁灌胃,C组和M组灌胃等体积蒸馏水,灌胃时间为每日上午9:00。
1.4 实验动物取材
实验共4周,末次灌胃后24 h,乌拉坦麻醉大鼠后称取体重,腹主动脉取血,室温自然凝固,4℃离心10 min,3 000 r/min,提取血清,-20℃保存。取出肝脏,置于预冷生理盐水冲洗,吸干后称重。切取合适大小肝左叶,4%多聚甲醛固定。其余肝叶分装后液氮冻存,取材结束后移至-80℃冰箱保存。
1.5 肝脏指数计算
分别称取大鼠肝脏质量和体质量,计算肝脏指数。肝脏指数(%)=肝脏质量(g)/大鼠体质量(g)×100%
1.6 肝脏病理评价
固定后的肝脏组织经脱水、透明、包埋、切片,苏木精-伊红(hematoxylin-eosin,HE)染色后,光镜下(200×)观察肝脏病理变化。
1.7 蛋白质免疫组化分析
石蜡切片脱蜡后,经抗原修复、过氧化物酶阻断、一抗及二抗孵育、二氨基联苯胺显色、细胞核复染,最后完成脱水封片。TLR4抗体由美国Santa Cruz公司提供,稀释比为1∶50;p38 MAPK和磷酸化p38 MAPK(phosphorylated p38 mitogen-activated protein kinase,p-p38MAPK)抗体由美国Sigma公司提供,稀释比分别为1∶100和1∶50;山羊抗小鼠和山羊抗兔二抗由武汉Servicebio公司提供,稀释比为1∶200。经全视野数字扫描整张组织切片,细胞核颜色为深棕色、棕黄色和浅黄色分判定为强阳性、中度阳性和弱阳性,细胞核蓝色为阴性,依据阳性强弱关系计算组织化学评分(histochemistry score,Hscore)[7]用于组间分析。H-score=(弱阳性细胞密度×1)+(中度阳性细胞密度×2)+(强阳性细胞密度×3)。
1.8 其他指标测试方法
采用全自动生化分析仪检测血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活性。采用酶联免疫吸附试验测定肝脏肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-18(interleukin-18,IL-18)水平。相关试剂盒由北京华英生物技术研究所提供。
1.9 统计学处理
2 结果
2.1 各组大鼠体重和肝脏指数
与C组相比,M组体重显著降低(P<0.05);与M组相比,LLM、MLM、HLM组均无统计学差异(P>0.05);不同剂量组组间无统计学差异(P>0.05)。与C组相比,M组肝脏重量显著升高(P<0.01);与M组相比,LLM组无统计学差异(P>0.05),MLM和HLM组均显著降低(P<0.05或P<0.01);不同剂量组组间,HLM组显著低于LLM组(P<0.05),其余组间无统计学差异(P>0.05)。与C组相比,M组肝脏指数显著升高(P<0.01);与M组相比,LLM和MLM组无统计学差异(P>0.05),HLM组显著降低(P<0.05);不同剂量组组间,HLM组显著低于LLM组(P<0.05),其余组间无统计学差异(P>0.05,表1)。
Tab.1 Body weight and liver index in each group(±s,n=12)

Tab.1 Body weight and liver index in each group(±s,n=12)
C:Control group;M:Model group;LLM:Low-dose Lycium ruthenicum Murr.juice group;MLM:Medium-dose Lycium ruthenicum Murr.juice group;HLM:High-dose Lycium ruthenicum Murr.juice group *P<0.05,**P<0.01 vs group C;#P<0.05,##P<0.01 vs group M;△P<0.05 vs group LLM
Group Body weight(g)Liver weight(g)Liver index(%)C 304.16±15.45 9.40±0.45 3.10±0.27 M 277.31±34.74*11.69±0.75**4.29±0.72**LLM 256.74±16.18 11.12±0.87 4.35±0.49 MLM 255.17±11.58 10.75±0.54#4.22±0.25 HLM 267.88±18.86 10.03±0.71##△3.75±0.33#△
2.2 各组大鼠肝脏损伤标志物活性
肝脏损伤标志物血清ALT活性,与C组相比,M组显著升高(P<0.01);与M组比较,HLM组显著降低(P<0.05),其余两组无统计学差异(P>0.05);不同剂量组组间无统计学差异(P>0.05)。血清AST活性,与C组相比,M组显著升高(P<0.01);与M组比较,LLM、MLM、HLM组均显著降低(P<0.01);不同剂量组组间,HLM组显著低于LLM组(P<0.05),其余组间无统计学差异(P>0.05,表2)。
Tab.2 Indicators of liver injury in each group(U/L,±s,n=12)
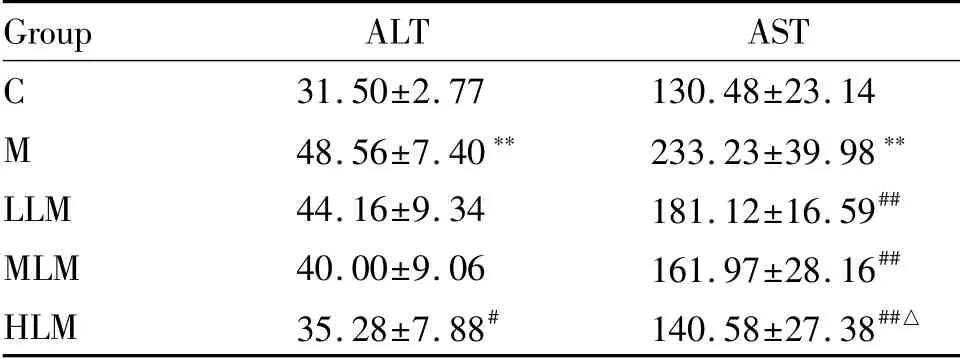
Tab.2 Indicators of liver injury in each group(U/L,±s,n=12)
**P<0.01 vs group C;#P<0.05,##P<0.01 vs group M;△P<0.05 vs group LLM
Group ALT AST C 31.50±2.77 130.48±23.14 M 48.56±7.40** 233.23±39.98**LLM 44.16±9.34 181.12±16.59##MLM 40.00±9.06 161.97±28.16##HLM 35.28±7.88# 140.58±27.38##△
2.3 各组大鼠肝脏组织形态
200倍光镜下观察显示(图1),C组肝细胞排列规则,无变性、坏死及空泡化,肝小叶结构清晰,肝血窦无淤血,无炎性细胞浸润。M组肝细胞间隙增大,出现空泡化,肝血窦扩张,血管周围出现炎性细胞聚集,形成大量炎性小灶。LLM组无明显改善,仍可见空泡化肝细胞和众多炎性小灶。MLM组偶见肝细胞空泡化,肝血窦扩张情况有所缓解,可见炎性细胞聚集。HLM组肝小叶结构较完整,肝血窦无明显扩张,仅少量炎性细胞浸润。

Fig.1 Hepatic histopathological changes in each group(HE×200)
2.4 各组大鼠肝脏TLR4/p38 MAPK通路相关蛋白质水平
肝脏TLR4蛋白质表达,与C组相比,M组显著升高(P<0.01);与M组相比,HLM组显著降低(P<0.01),其余两组无统计学差异(P>0.05);不同剂量组组间,HLM组显著低于LLM组(P<0.05),其余组间无统计学差异(P>0.05)。p38 MAPK蛋白质表达,各组间均无统计学差异(P>0.05)。p38 MAPK磷酸化水平,与C组相比,M组显著升高(P<0.01);与M组相比,HLM组显著降低(P<0.05),其余两组无统计学差异(P>0.05);不同剂量组组间无统计学差异(P>0.05)。p-p38 MAPK/p38 MAPK结果,与C组相比,M组显著升高(P<0.01);与M组比较,LLM组无统计学差异(P>0.05),MLM和HLM组均显著降低(P<0.01);不同剂量组组间,HLM组显著低于LLM组(P<0.01),其余组间无统计学差异(P>0.05,表3,图2-4)。
Tab.3 H-score of hepatic TLR4/p38 MAPK signaling pathway-related proteins in each group(±s,n=12)
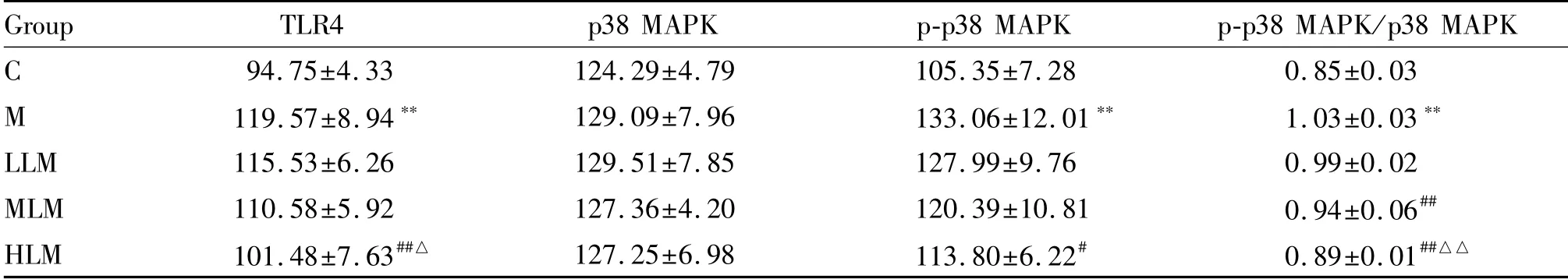
Tab.3 H-score of hepatic TLR4/p38 MAPK signaling pathway-related proteins in each group(±s,n=12)
**P<0.01 vs group C;#P<0.05,##P<0.01 vs group M;△P<0.05,△△P<0.01 vs group LLM
Group TLR4 p38 MAPK p-p38 MAPK p-p38 MAPK/p38 MAPK C 94.75±4.33 124.29±4.79 105.35±7.28 0.85±0.03 M 119.57±8.94** 129.09±7.96 133.06±12.01** 1.03±0.03**LLM 115.53±6.26 129.51±7.85 127.99±9.76 0.99±0.02 MLM 110.58±5.92 127.36±4.20 120.39±10.81 0.94±0.06##HLM 101.48±7.63##△ 127.25±6.98 113.80±6.22# 0.89±0.01##△△

Fig.2 Expression of hepatic TLR4 in each group(IHC-P×400)

Fig.3 Expression of hepatic p38 MAPK in each group(IHCP×400)
2.5 各组大鼠肝脏炎症因子水平
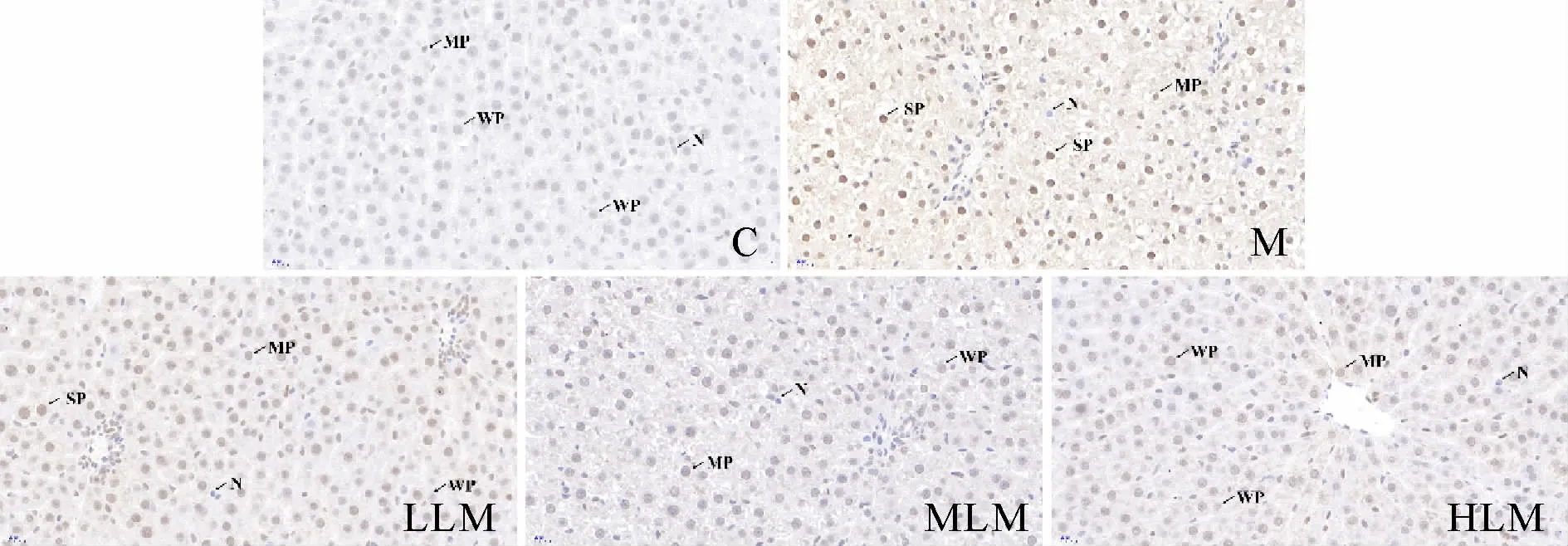
Fig.4 Expression of hepatic p-p38 MAPK in each group(IHC-P×400)
肝脏TNF-α水平,与C组相比,M组显著升高(P<0.01);与M组相比,HLM组显著降低(P<0.01),其余两组无统计学差异(P>0.05);不同剂量组组间,HLM组显著低于LLM组(P<0.05),其余组间无统计学差异(P>0.05)。IL-1β水平,与C组相比,M组显著升高(P<0.01);与M组相比,HLM组显著降低(P<0.05),其余两组无统计学差异(P>0.05);不同剂量组组间无统计学差异(P>0.05)。IL-10水平,与C组相比,M组显著降低(P<0.01);与M组相比,LLM、MLM和HLM组均显著升高(P<0.05或P<0.01);不同剂量组组间,MLM组显著高于LLM组(P<0.05),HLM组显著高于LLM和MLM组(P<0.05或P<0.01)。IL-18水平,与C组相比,M组显著升高(P<0.01);与M组相比,LML组无统计学差异(P>0.05),MLM和HLM组均显著降低(P<0.01);不同剂量组组间,HLM组显著低于LLM组(P<0.01),其余组间无统计学差异(P>0.05,表4)。
3 讨论
乙醇(酒精)是一种极性分子物质,可溶于水和脂质,摄入后通过胃肠道吸收进入血液循环,吸收后的酒精超过95%通过肝脏代谢,长期过量饮酒是造成肝脏疾病发生的主要原因,酒精性肝病已成为我国最主要的慢性肝脏疾病之一[1]。酒精及其代谢物可以直接或间接诱导炎症反应、氧化应激以及蛋白质营养失衡等多种病理生理过程,这些因素相互作用,最终导致酒精性肝病的发生[2,8]。血清ALT和AST是评价肝脏功能的常用早期指标[1]。本研究中,模型组血清ALT和AST水平、肝脏指数较对照组显著升高,且体重下降明显,结合病理诊断,提示模型组大鼠出现酒精性肝脏损伤,模型建立成功。而黑果枸杞汁各剂量组与模型组相比,血清ALT和AST、肝脏指数及组织形态均出现不同程度改善,提示黑果枸杞汁能够在一定程度上缓解酒精对大鼠肝脏结构和功能的损伤。这与同类型研究的结果基本一致[9,10]。
Tab.4 Hepatic inflammatory factors in each group(pg/mg,±s,n=12)
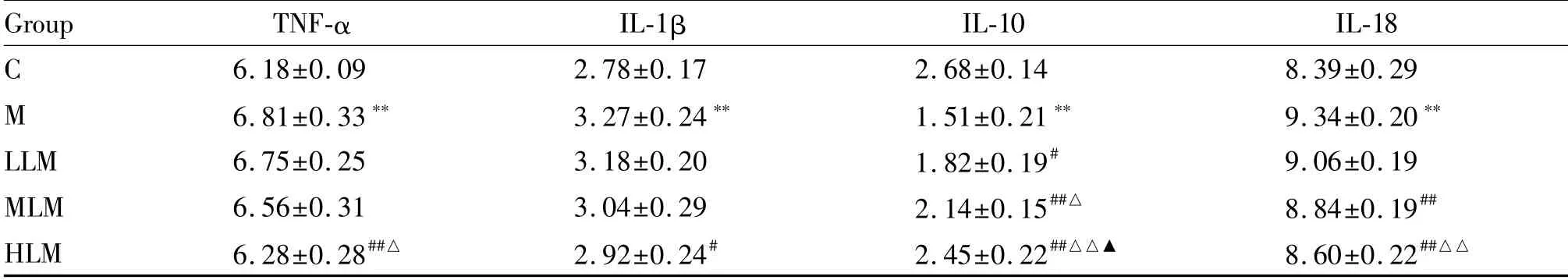
Tab.4 Hepatic inflammatory factors in each group(pg/mg,±s,n=12)
**P<0.01 vs group C;#P<0.05,##P<0.01 vs group M;△P<0.05,△△P<0.01 vs group LLM;▲P<0.05 vs group MLM
Group TNF-α IL-1β IL-10 IL-18 C 6.18±0.09 2.78±0.17 2.68±0.14 8.39±0.29 M 6.81±0.33** 3.27±0.24** 1.51±0.21** 9.34±0.20**LLM 6.75±0.25 3.18±0.20 1.82±0.19# 9.06±0.19 MLM 6.56±0.31 3.04±0.29 2.14±0.15##△ 8.84±0.19##HLM 6.28±0.28##△ 2.92±0.24# 2.45±0.22##△△▲ 8.60±0.22##△△
TLR4属于I型跨膜受体蛋白,酒精可以通过其代谢物乙醛直接上调TLR4通路信号转导水平,也可通过损害肠道屏障功能,提高脂多糖水平,过量的脂多糖引起TLR4二聚化,经过一系列信号转导途径,最终激活下游信号蛋白,导致TNF-α、IL-1β和IL-18等多种炎性细胞因子的激活和分泌[11,12]。p38 MAPK能够对多种应激刺激产生广泛应答,是与炎症反应有关的重要细胞内信号传导途径,与炎症调节和控制机制密切相关,对于调节炎症因子表达水平至关重要。蒋伟等[13]的研究表明,TLR4激活后,可以引起p-p38 MAPK表达增加。而慢性酒精摄入所致脂多糖增加,也可引起磷酸化p38 MAPK上调,稳定TNF-α的mRNA水平[14]。本研究中,模型组TLR4蛋白质表达和p38 MAPK磷酸化水平以及p-p38 MAPK/p38 MAPK比值均显著高于对照组,且TNF-α、IL-1β和IL-18水平显著升高,表明酒精通过活化TLR4/p38 MAPK信号通路,引起肝脏炎症水平升高。
研究表明,慢性酒精喂养不会导致TLR4基因缺陷小鼠肝脏中TNF-α和白细胞介素-6(interleukin-6,IL-6)表达增加[15]。而通过抑制p38 MAPK表达,可以降低长期乙醇喂养大鼠枯否细胞中TNFα的表达[16]。IL-10作为一种抗炎因子,可以阻断巨噬细胞中TNF-α、IL-1β和IL-6的产生[17]。上述炎症信号途径中的关键分子均可成为酒精性肝脏损伤的有效干预靶点。黑果枸杞含有花色苷、原花青素、多糖等多种活性成分。相关研究表明,黑果枸杞可降低血清中TNF-α和IL-6水平,对酒精性肝损伤发挥保护作用[9,10]。也可通过抑制脑组织中TLR4通路信号因子,下调TNF-α表达,上调IL-10表达[18]。本研究中,与模型组相比,黑果枸杞汁高剂量组肝脏TLR4蛋白质表达、p38 MAPK磷酸化水平、p-p38 MAPK/p38 MAPK比值以及TNF-α、IL-1β和IL-18水平显著降低,肝脏IL-10水平显著升高,同时肝脏损伤标志物ALT、AST水平显著下降,结合组织病理学变化,说明肝脏形态/功能明显改善。黑果枸杞汁各剂量组间比较,高剂量组较低剂量组肝脏系数、血清AST、肝脏TLR4蛋白质表达、p-p38 MAPK/p38 MAPK比值、TNF-α和IL-18水平均显著降低,肝脏IL-10水平显著升高;高剂量组较中剂量组肝脏IL-10水平显著升高;中剂量组较低剂量组肝脏IL-10水平显著升高。机制可能为:相对于干果,黑果枸杞汁在加工过程中营养成分损失较少,其富含的多种活性物质可通过抑制TLR4/p38 MAPK通路信号强度,改善促炎细胞因子和抗炎细胞因子间平衡关系,缓解酒精代谢引起的炎性损伤,发挥肝脏保护作用。
综上,本研究成功建立酒精性肝损伤大鼠模型,黑果枸杞汁可通过介导TLR4/p38 MAPK信号通路,调节肝脏炎性因子水平,改善大鼠酒精性肝脏损伤,保护肝脏结构和功能正常,且高剂量组效果最优。
