玉竹多糖对酒精诱导的Hep G2细胞损伤的保护作用及其机制*
2022-09-08吴雅雯王晓慧李庚喜
朱 琪,吴雅雯,王晓慧,李庚喜
(湘西南中药开发利用湖南省工程研究中心,邵阳学院,邵阳 422000)
过量饮酒导致的酒精性肝病(alcoholic liver disease,ALD)已成为全球性的医疗保健问题[1]。研究表明,酒精诱导的氧化应激、谷胱甘肽(glutathione,GSH)耗竭和促炎细胞因子在ALD的发病机制中起着关键作用[2,3]。此外,细胞内活性氧含量的增加促进脂质过氧化产物丙二醛(MDA)的形成。而MDA沉积又可刺激炎性细胞因子的分泌,加速受损肝组织的病变[4]。核因子E2相关因子(NF-E2-related factor 2,Nrf2)是一种与氧化还原失衡相关的敏感转录因子[5,6]。在应激条件下,过量的活性氧(reactive oxygen species,ROS)破坏胞浆蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1,Keap1)-Nrf2的相互作用,启动Nrf2的有效核转位,提高抗氧化酶活性,抵御有害刺激产生的不利影响[7]。这提示作为机体内重要的内源性抗氧化Nrf2/Keap1通路可为抗酒精性肝毒性的治疗提供策略[8]。
目前针对ALD患者一般干预措施包括肝病并发症住院管理、酒精戒断管理、感染监测和早期有效的抗生素治疗以及营养补充,其中实施戒酒管理或早期营养补充可能是早期抵御ALD病变发展的有效措施[1,9]。来源于天然产物的多糖是一类已被证实具有抗氧化、调节炎性介质和抑制细胞凋亡等活性,兼具高效、无毒或低副作用等优点的潜在抵御酒精性肝损伤保健功能食品或药物制剂资源[10,11]。玉竹多糖(Polygonatum odoratum polysaccharides,POP)是来源于药膳同源植物玉竹[Polygonatum odoratum(Mill.)Druce]干燥根茎中的活性成分。最新的玉竹研究发现,玉竹多糖在体外可以清除自由基,在体内可以提高机体抗氧化酶活性、抑制炎性因子和MDA的含量[12,13]。这些活性都有助于肝细胞抵御酒精胁迫所产生的逆应激,但目前缺乏相关的实验研究。因此,本研究通过Nrf2/Keap1抗氧化信号通路检测玉竹多糖对酒精诱导人肝癌细胞(HepG2)氧化应激、GSH耗竭、炎症因子以及细胞凋亡水平的影响,探讨玉竹多糖对酒精诱导HepG2细胞的保护作用。
1 材料与方法
1.1 材料和仪器
玉竹多糖购自兰州沃特莱斯科技有限公司(批号:WTLS-010),采用苯酚-硫酸法测定玉竹多糖的质量分数58%;95%医用酒精(批号:20210207)购于润玲科技集团有限公司;人源性肝细胞系(HepG2;批号:CX0004),HepG2细胞专用培养基(批号:ZYPYG0004),3-(4,5-二甲基-噻唑-2-基)-2,5-二苯基四唑溴化铵(MTT)试剂(批号:AR1156)购于武汉博士德生物公司;ROS(批号:E004-1-1)、丙氨酸氨基转移酶(alanine aminotransferase,ALT,批号:C009-3-1)、MDA(批号:A003-2-1)、天冬氨酸氨基转移酶(aspartate transaminase,AST,批号:C010-3-1)和GSH(批号:A006-1-1)等生化试剂盒购于南京建成生物工程研究所;白介素-1β(IL-1β,批号:CSB-E08053h)和肿瘤坏死因子-α(TNF-α,批号:CSB-E09315h)购于武汉华美生物工程有限公司;RIPA裂解液(批号:P0013E)和硝酸纤维素膜(批号:FFN02)购于碧云天生物技术公司;10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(批号:MA0159)购于大连美仑生物技术公司;ECL显色液(批号:K-12045-D50,美国advansta),Keap1(批号:ab119403,英 国abcam)、p-Nrf2(批 号:ab237464,英国abcam)、磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NQO1,批号:ab97385,英国abcam)、Bcl-2相关X蛋白(Bax,批号:ab182733,英国abcam)、B淋巴细胞瘤-2(Bcl-2,批号:ab196495,英国abcam)和半胱氨酸天冬氨酸蛋白酶3(cleavedcaspase-3,批号:ab2302,英国abcam)等抗体由邵阳杏汇科技有限公司代购。其余试剂为国产分析纯。
EPOCH-2多功能酶标仪(美国伯腾仪器有限公司);5810型台式冷冻离心机(德国Eppndorf公司);LRH-500细胞生化培养箱(上海笃特科学仪器有限公司);FluorChem FC2化学发光凝胶成像系统(南京非同科学仪器有限公司);电泳槽(北京龙方科技有限公司);电子天平(梅特勒托利多科技(中国)有限公司)。
1.2 细胞的培养和处理以及细胞存活率检测
参阅文献[14],HepG2肝细胞在RPMI 1640培养液中培养。实验分为空白组、不同浓度(3%、4%、5%和6%)酒精组和不同浓度(100μg/L、200 μg/L、400μg/L和600μg/L)玉竹多糖处理组,每组设3复孔,24 h后加入MTT试剂,37℃孵育4 h,抽提培养液。用DMSO溶解紫甲瓒晶体后,于550nm处测量吸收强度。采用MTT法计算HepG2细胞存活率。细胞存活率=A(处理组)/A(对照组)×100%。
1.3 玉竹多糖的干预对酒精诱导Hep G2细胞存活率的影响
96孔板上培养的HepG2细胞分别用不同浓度(100μg/L、200μg/L、400μg/L和600μg/L)的玉竹多糖预处理1 h,并设未处理的空白组,再用1.2步骤选用的酒精浓度处理24 h,计算细胞存活率。
1.4 细胞内ALT和AST活性
参阅试剂盒厂家说明书,测定HepG2细胞内ALT和AST活性。
1.5 细胞内ROS、MDA和GSH水平
参阅试剂盒厂家说明书,测定HepG2细胞内ROS、MDA和GSH水平。
1.6 细胞内IL-1β和TNF-α水平
用酶联免疫吸附分析试剂盒评估HepG2细胞内IL-1β和TNF-α水平。
1.7 Western Blot分析
用RIPA裂解液提取细胞裂解产物,测定蛋白浓度。参阅文献[15],将蛋白质用SDS-PAGE凝胶上样,转移至硝酸纤维素膜。用5%脱脂牛奶在磷酸盐吐温缓冲液中封闭膜,将膜与磷酸盐吐温缓冲液中的一抗孵育过夜,洗膜后,经辣根过氧化物酶偶联抗体孵育,ECL孵育显色后,暗盒内固定显影,于凝胶成像系统内观察目标蛋白表达。
1.8 统计学处理
2 结果
2.1 不同处理方式下Hep G2细胞的存活率
不同浓度的酒精处理HepG2细胞后,细胞存活率呈剂量依赖性下降,与空白组比较,3%浓度的酒精即可显著影响HepG2细胞存活率为90.33%±2.52%(P<0.05)。其中4%浓度的酒精诱导HepG2细胞生存率在77.33%±6.43%左右,且与空白组比较具有极显著性(P<0.01),因此在所有后续实验中都使用4%的酒精浓度。同时加入不同浓度(100μg/L、200μg/L、400μg/L和600μg/L)的玉竹多糖,并设未处理的空白组。24 h后,测试结果显示,600μg/L以内浓度的玉竹多糖均不影响HepG2细胞的存活率(P>0.05)。与4%酒精诱导的HepG2细胞对照组相比,预先给予玉竹多糖(200 μg/L、400μg/L和600μg/L)预处理的细胞存活率分别为(86.67±2.52)%、(89.67±2.52)%和(97.67±2.08)%,可显著降低4%酒精诱导的细胞毒性(P<0.05),提示玉竹多糖对酒精性肝损伤有保护作用。且随着玉竹浓度增加,细胞存活率明显提高。虽然100μg/L玉竹多糖可提高4%乙醇诱导的HepG2细胞的存活率,细胞存活率为(82.00±2.65)%,无明显影响(P>0.05)。因此,后续实验中都使用200μg/L、400μg/L和600μg/L玉竹多糖预处理,进一步研究不同浓度的玉竹多糖对酒精诱导HepG2细胞生化指数的影响。
2.2 玉竹多糖对酒精处理Hep G2细胞ALT和AST活性的影响
如表1所示,4%酒精处理后的HepG2细胞与空白组相比,可显著地诱导ALT和AST渗漏(P<0.01),而不同浓度玉竹多糖的预处理能显著降低4%酒精诱导HepG2细胞的ALT和AST释放(P<0.05,P<0.01)。
Tab.1 Effects of POP on alcohol-induced ALT and AST production in HepG2 cells(mU/ml,±s,n=3)
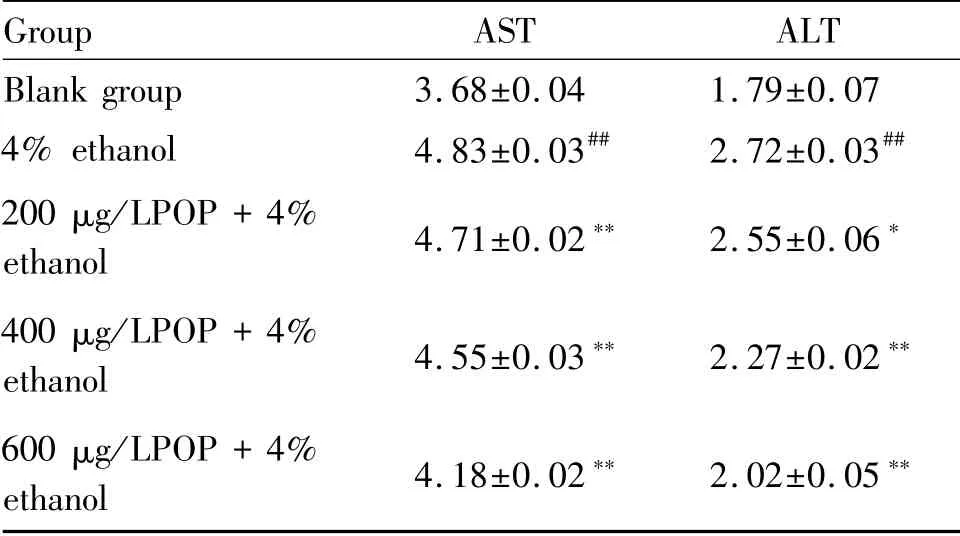
Tab.1 Effects of POP on alcohol-induced ALT and AST production in HepG2 cells(mU/ml,±s,n=3)
#P<0.05,##P<0.01 vs the untreated blank group;*P<0.05,**P<0.01 vs the control group treated with 4%ethanol
Group AST ALT Blank group 3.68±0.04 1.79±0.07 4%ethanol 4.83±0.03## 2.72±0.03##200μg/LPOP+4%ethanol 4.71±0.02** 2.55±0.06*400μg/LPOP+4%ethanol 4.55±0.03** 2.27±0.02**600μg/LPOP+4%ethanol 4.18±0.02** 2.02±0.05**
2.3 玉竹多糖对酒精处理Hep G2细胞内氧化应激水平的影响
如表2所示,4%酒精处理的HepG2细胞与空白组相比,显著诱导ROS上升(P<0.01),而玉竹多糖的预处理能显著降低4%酒精诱导HepG2细胞内ROS水平(P<0.01)。此外,玉竹多糖可有效抑制4%酒精诱导的肝HepG2细胞MDA水平(P<0.05),显著提高4%酒精诱导HepG2细胞内GSH水平(P<0.01)。
Tab.2 Effects of POP on alcohol-induced oxidative stress in HepG2 cells(±s,n=3)
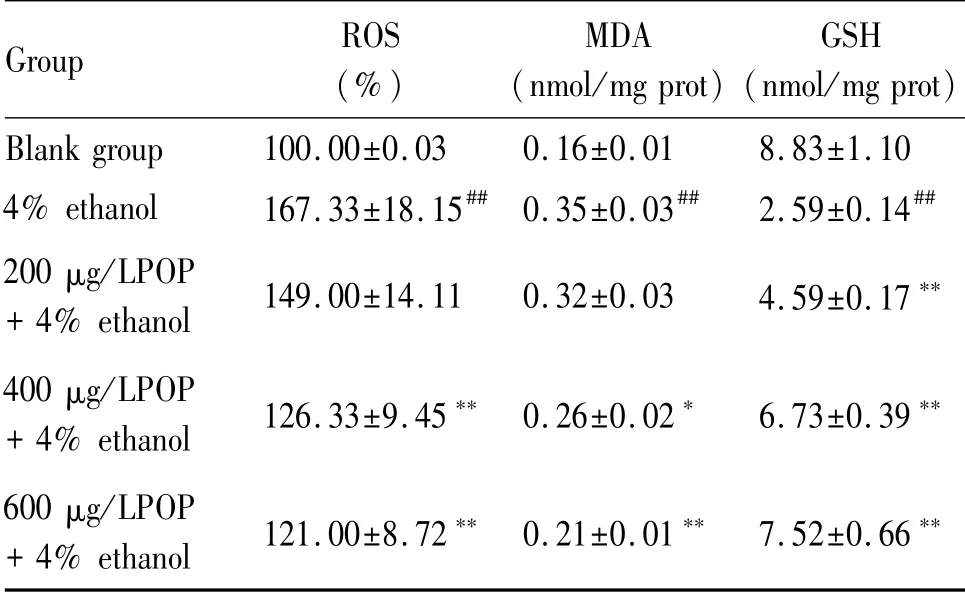
Tab.2 Effects of POP on alcohol-induced oxidative stress in HepG2 cells(±s,n=3)
#P<0.05,##P<0.01 vs the untreated blank group;*P<0.05,**P<0.01 vs the control group treated with 4%ethanol
Group ROS(%)MDA(nmol/mg prot)GSH(nmol/mg prot)Blank group 100.00±0.03 0.16±0.01 8.83±1.10 4%ethanol 167.33±18.15##0.35±0.03##2.59±0.14##200μg/LPOP+4%ethanol 149.00±14.11 0.32±0.03 4.59±0.17**400μg/LPOP+4%ethanol 126.33±9.45**0.26±0.02* 6.73±0.39**600μg/LPOP+4%ethanol 121.00±8.72**0.21±0.01**7.52±0.66**
2.4 玉竹多糖对酒精处理Hep G2细胞炎性反应的影响
结果表明(表3),与空白组相比,4%酒精处理显著增加HepG2细胞内IL-1β和TNF-α的生成量(P<0.01),而200μg/L玉竹多糖的预处理即可显著减少4%酒精诱导的HepG2细胞中促炎因子IL-1β和TNF-α的产生(P<0.05)。
Tab.3 Effects of POP on the contents of IL-1βand TNF-α in HepG2 cells induced by alcohol(pg/ml,±s,n=3)

Tab.3 Effects of POP on the contents of IL-1βand TNF-α in HepG2 cells induced by alcohol(pg/ml,±s,n=3)
#P<0.05,##P<0.01 vs the untreated blank group;*P<0.05,**P<0.01 vs the control group treated with 4%ethanol
Group IL-1β TNF-α Blank group 31.75±1.36 316.23±13.93 4%ethanol 82.07±2.67## 827.63±25.71##200μg/L POP+4%ethanol 73.45±5.90* 765.73±36.69*400μg/L POP+4%ethanol 61.61±2.70** 669.30±14.98**600μg/L POP+4%ethanol 50.11±3.89** 544.77±27.42**
2.5 玉竹多糖对酒精处理Hep G2细胞相关信号通路的调控
如图1、表4和表5所示,4%酒精处理的HepG2细胞与空白组相比,显著地上调Keap1和cleaved-caspase-3的蛋白表达水平以及Bax/Bcl-2蛋白表达比率水平(P<0.01),而玉竹多糖的预处理能显著降低4%酒精诱导HepG2细胞内Keap1和cleaved-caspase-3的蛋白表达水平以及Bax/Bcl-2蛋白指数(P<0.05)。此外,玉竹多糖有效抵御4%酒精诱导的肝HepG2细胞p-Nrf2和NQO-1水平下降(P<0.05)。

Fig.1 Effects of POP on the expressions of Keap1,p-Nrf2,NQO-1,Bax,Bcl-2 and cleaved-caspase-3 in HepG2 cells induced by alcohol(±s,n=3)
Tab.4 Relative expression levels of Keap1,p-NrF2 and NQO-1,Bax,Bcl-2 and cleaved caspase-3 in HepG2 cells(±s,n=3)
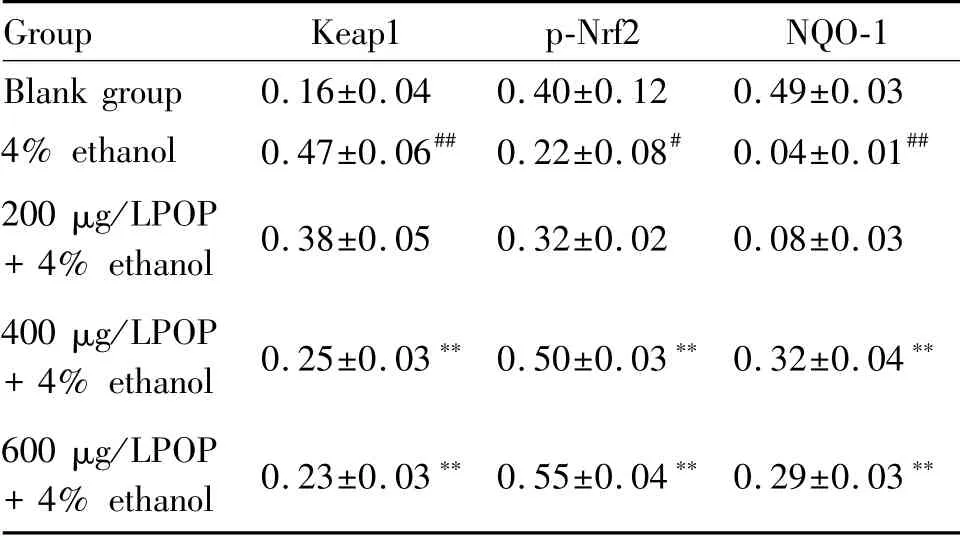
Tab.4 Relative expression levels of Keap1,p-NrF2 and NQO-1,Bax,Bcl-2 and cleaved caspase-3 in HepG2 cells(±s,n=3)
#P<0.05,##P<0.01 vs the untreated blank group;*P<0.05,**P<0.01 vs the control group treated with 4%ethanol
Group Keap1 p-Nrf2 NQO-1 Blank group 0.16±0.04 0.40±0.12 0.49±0.03 4%ethanol 0.47±0.06##0.22±0.08#0.04±0.01##200μg/LPOP+4%ethanol 0.38±0.05 0.32±0.02 0.08±0.03 400μg/LPOP+4%ethanol 0.25±0.03**0.50±0.03**0.32±0.04**600μg/LPOP+4%ethanol 0.23±0.03**0.55±0.04**0.29±0.03**
Tab.5 Relative expression levels of Bax,Bcl-2 and cleaved caspase-3 in HepG2 cells(±s,n=3)

Tab.5 Relative expression levels of Bax,Bcl-2 and cleaved caspase-3 in HepG2 cells(±s,n=3)
#P<0.05,##P<0.01 vs the untreated blank group;*P<0.05,**P<0.01 vs the control group treated with 4%ethanol
Group Bax Bcl-2 Bax/Bcl-2 cleaved-caspase-3 Blank group 0.08±0.03 0.33±0.02 0.23±0.08 0.06±0.02 4%ethanol 0.36±0.01## 0.10±0.04## 3.50±0.78## 0.22±0.04##200μg/LPOP+4%ethanol 0.30±0.03* 0.15±0.04 2.25±0.46* 0.18±0.03 400μg/LPOP+4%ethanol 0.24±0.02** 0.20±0.04 1.70±0.24** 0.14±0.02*600μg/LPOP+4%ethanol 0.17±0.02** 0.24±0.06* 1.53±0.18** 0.12±0.02**
3 讨论
在ALD的发病机制中,酒精诱导的氧化胁迫会促进肝细胞内的ROS升高[1,9]。细胞内自由基的过度累积可以引发细胞膜中脂质的氧化,导致MDA的升高[2,4]。肝细胞中MDA水平反映酒精诱导的肝损伤中的脂质过氧化程度。抗氧化剂包括酶促和非酶促抗氧化剂,其中细胞内清除ROS的非酶抗氧化剂防御主要通过非酶抗氧化剂实现[16]。而非酶促抗氧化剂GSH是哺乳动物中含量最丰富的非蛋白硫醇,人类早已认识其在解毒和抵御氧化剂方面的核心作用[14]。酒精诱导的肝细胞会耗尽有助于细胞内抗氧化的GSH水平[17,18]。因此,通过检测培养基中HepG2细胞的ROS、MDA和GSH的含量可考察玉竹多糖对酒精处理HepG2细胞氧化应激的影响。而氧化应激诱导的细胞反应与炎症反应密切相关[5]。在酒精介导的肝脏损伤过程中,较高的ROS和MDA水平可诱导促炎细胞因子如IL-1β和TNF-α的产生,并参与急性酒精性肝损伤[19]。因此,抑制炎症也是治疗慢性酒精肝损伤的方案之一[20]。以IL-1β和TNF-α水平为指标,我们考察了玉竹多糖对酒精诱导HepG2细胞的炎症反应的影响。而AST和ALT活性被公认为是酒精性肝细胞损伤的可靠和敏感的生理标志物[21]。我们的实验结果表明,玉竹多糖不仅抑制酒精诱导的HepG2细胞氧化损伤,还可以抑制炎性因子水平的上升,保护肝细胞。
Nrf2是细胞内调控氧化还原平衡的关键转录因子。当细胞暴露在与氧化应激相关的因素(如ROS)中时,Nrf2会从Nrf2/Keap1复合体中释放出来,磷酸化后从细胞质转移到细胞核中启动抗氧化酶磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NADPH quinineoxidoreductase-1,NQO-1)等的抗氧化毒性[7]。有报道称,Nrf2/Keap1通路在阻止ALD发生的防御系统中起着关键作用[22]。在本研究中,通过检测Nrf2核转位和Keap1水平,研究玉竹多糖对Nrf2/Keap1信号通路激活的影响。结果表明,与酒精处理的细胞相比,玉竹多糖的预处理显著提高细胞质中Keap1和细胞核中p-Nrf2和NQO-1的蛋白表达水平。这提示,Nrf2/Keap1途径的激活可能是玉竹多糖抗酒精肝损伤的细胞保护作用的潜在途径之一。大量研究表明,酒精诱导的肝细胞凋亡与氧化应激有关,添加抗氧化剂对酒精诱导的肝细胞凋亡具有保护作用[19]。已有研究证实,Bax、Bcl-2和cleaved-caspase-3是细胞凋亡过程中的重要蛋白,抑制cleaved-caspase-3蛋白表达和下调Bax/Bcl-2比率可抑制细胞的非正常凋亡[23]。实验结果显示,与酒精处理的细胞相比,玉竹多糖的预处理也显著下调cleaved-caspase-3蛋白表达和Bax/Bcl-2指数,这表明玉竹多糖能减轻酒精诱导的氧化损伤所致细胞凋亡和肝毒性。
综上,玉竹多糖能够减少酒精诱导HepG2细胞应激损伤的同时抑制促炎因子的释放,保护肝细胞,其机制可能与玉竹多糖能激活Nrf2/Keap1信号通路,Nrf2磷酸化核转位后上调NQO-1蛋白表达,使HepG2细胞免受酒精诱导的氧化损伤的同时还减轻炎性反应,进而下调Bax/Bcl-2指数和cleavedcaspase-3蛋白表达,抵御细胞凋亡。然而Nrf2/Keap1通路是否是玉竹多糖调节减轻酒精诱导HepG2细胞损伤的唯一机制还待进一步实验验证。我们将在今后结合动物实验、基因组学和代谢组学等实验技术进一步探讨基于Nrf2/Keap1信号通路保护酒精诱导肝细胞损伤,防治ALD的作用机制。
