烟酰胺单核苷酸分子印迹微球的制备及其吸附性能研究
2022-09-07张萌李娜谢丽郝亮熊海涛吴迎春
张萌,李娜,谢丽,郝亮,熊海涛,吴迎春
(陕西理工大学 化学与环境科学学院,陕西 汉中,723001)
烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是人体内一种内源性物质,它参与细胞内烟酰胺腺嘌呤二核苷酸[(nicotinamide adenine dinucleotide,NAD+),细胞能量转化的重要辅酶]的合成[1],研究[2]发现人体的衰老过程伴随着体内NAD+含量的减少,作为人体NAD+合成的有效补救途径,服用NMN可以延缓细胞衰老的过程、从而实现抗衰老的效果。NMN作为新一代的抗衰老因子[3],市场上相继出现了相关的保健品、化妆品和加工食品等,其工业合成和产品开发过程中对于原料中NMN含量和杂质控制要求严格,在未来的实际生产中,一种高效的NMN含量检测方法对其质量控制具有重要意义。目前NMN的检测方法主要有定量核磁共振法[3]和液质联用法[4],但食品样品的基质与组成相当的复杂,在液质实际分析中存在很严重的基质效应[5-6],改善前处理方法纯化样品是最有效、最彻底消除基质效应的方法[7]。
固相萃取(solid-phase extraction,SPE)是目前最常用的样品前处理方法之一[8],但常规的固相萃取吸附剂主要依靠非特异性作用力吸附目标物,对复杂样品很难进行净化和富集。近年来,分子印迹聚合物(molecularly imprinted polymers,MIPs)因其预定性、实用性以及识别性等优点[9-13]而被广泛地应用到固相萃取领域[14-18]。以MIPs作为固相萃取的填料,制备分子印迹固相萃取(molecularly imprinted solid-phase extraction,MISPE)柱,该柱对模板分子有特异性识别能力,非常适合分离富集复杂样品中痕量分析物,提高仪器的灵敏度和准确度[19-22]。
目前,尚未发现有关NMN MIPs的相关研究。本实验以NMN为模板分子,α-甲基丙烯酸(methylacrylic acid,MAA)为功能单体,采用沉淀聚合法制备NMN MIPs微球,测定其吸附性和选择性,并利用MIPs对西兰花中的NMN进行固相萃取研究,实现了NMN的分离富集,为复杂样品中NMN的分析测定提供了新的样品前处理技术。
1 材料与方法
1.1 试剂与仪器
NMN标准品,上海源叶生物科技有限公司;乙二醇二甲基丙烯酸酯(ethylene dimethacrylate,EDGMA),深圳市丽晶生化科技有限公司;MAA,天津市福晨化学试剂厂;偶氮二异丁腈(2,2-azobisisobutyronitrile,AIBN),成都市科龙化工试剂厂;N,N′-亚甲基双丙烯酰胺,天津市科密欧化学试剂有限公司;实验试剂均为分析纯。
SPD-16高效液相色谱仪,日本岛津公司;DZF-6050型真空干燥箱,上海博讯实业有限公司;高速冷冻离心机,赛默飞世尔科技有限公司。
1.2 NMN MIPs的制备
取0.4 mmol NMN,溶于一定的溶剂中,然后加入0.8 mmol MAA,5 ℃下预聚合10 h,然后加入4 mmolN,N′-亚甲基双丙烯酰胺和50 mg AIBN,除氧、密封,60 ℃下反应7 h。聚合完成后,离心,弃上清液,得白色印迹聚合物。水洗去除未反应的NMN、MAA和N,N′-亚甲基双丙烯酰胺等,然后用甲醇乙酸(体积比9∶1)作为脱模液,去除印迹聚合物中的NMN,再用甲醇洗去残留的乙酸,真空干燥,得NMN MIPs。
非印迹聚合物(non-imprinted polymers,NIPs)的合成方法与MIPs合成方法一致,只是在合成时不加入NMN。
1.3 MIPs的吸附性能
1.3.1 标准曲线的绘制
以乙腈水为溶剂,配制质量浓度为3.125~100 μg/mL的NMN标准溶液,用HPLC仪测定不同浓度下NMN溶液的峰面积,平行测定3次,取平均值。从峰面积(F)-浓度(c)曲线图得到F-c关系式:F=7 810 934 129.353 2c-26 205.442 8,R2=0.997 4。
HPLC测定条件[4]:岛津Essentia LC-16色谱柱;紫外检测波长为261 nm;流动相A为2 mmol/L醋酸铵甲醇溶液、B为0.1%乙酸水溶液;泵的总流速=1 mL/min、泵A∶泵B=1∶4;柱温箱温度为室温。
1.3.2 静态等温吸附
准确称取2 mg MIPs和NIPs,加入2 mL不同浓度的NMN标准溶液,恒温振荡4 h,离心,上清液过0.45 μm滤膜,用HPLC测定其浓度,并绘制吸附等温线。吸附量(Q)的计算如公式(1)所示:
(1)
式中:Q为MIPs(或NIPs)对NMN的吸附量,mg/g;c0为溶液中NMN的初始质量浓度,mg/mL;ce为吸附平衡时NMN的质量浓度,mg/mL;V为NMN溶液的体积,mL;m为MIPs(或NIPs)的质量,g。
1.3.3 吸附动力学
分别称取2 mg MIPs和NIPs,加入2 mL 100 μg/mL的NMN标准溶液,恒温振荡不同时间,离心,上清液过0.45 μm滤膜,用HPLC测定其浓度。采用准一级动力学方程和准二级动力学方程研究MIPs对NMN的吸附速率和吸附机理,准一级动力学方程和准二级动力学方程如公式(2)、公式(3)所示:
ln(Qe-Qt)=lnQe-k1t
(2)
(3)
式中:Qe为MIPs(或NIPs)平衡时的吸附量,mg/g;Qt为测量时间为t时MIPs(或NIPs)的吸附量,mg/g;t为吸附时间,min;k1为一级动力学常数;k2为二级动力学常数。
1.3.4 选择性吸附
准确称取2 mg MIPs,加入2 mL一定浓度的NMN、烟酰胺、腺苷酸标准溶液,恒温振荡4 h,离心,上清液用0.45 μm滤头过滤,用HPLC测定其浓度。3种被测物结构如图1所示。
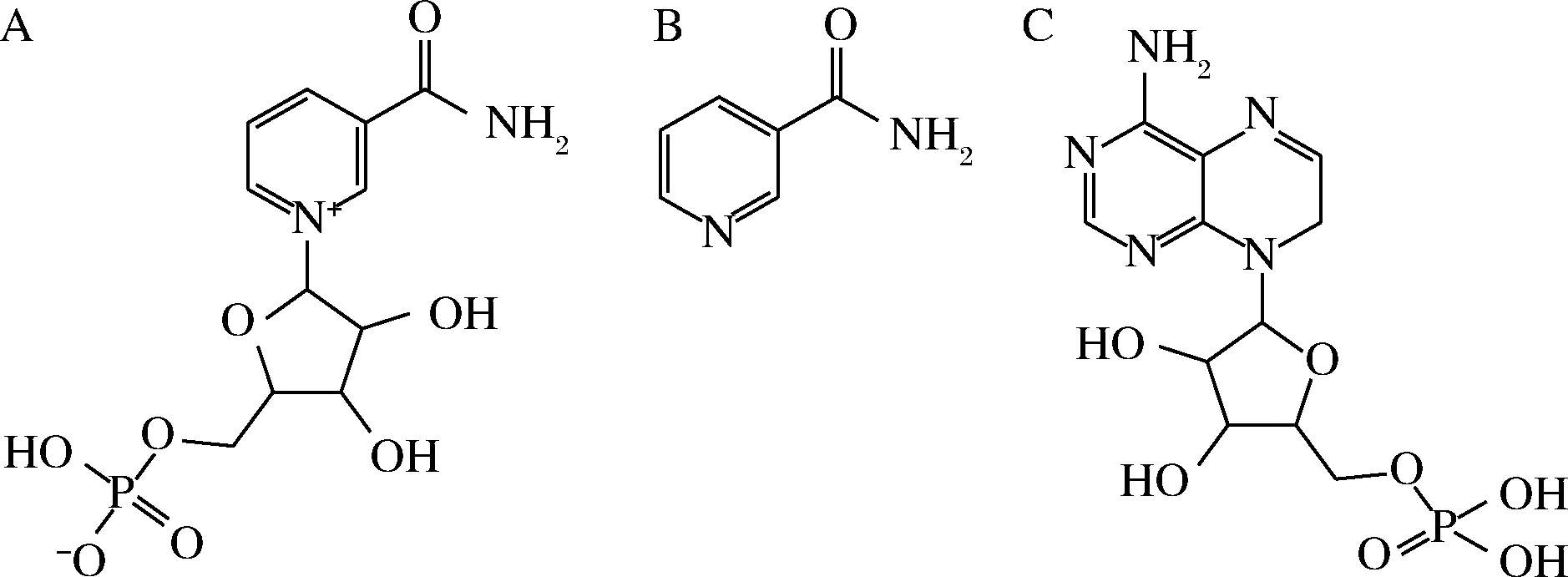
A-NMN;B-烟酰胺;C-腺苷酸图1 NMN、烟酰胺和腺苷酸结构Fig.1 The structure of NMN,nicotinamide and adenylate
印迹因子(imprinting factor,IF)、分离因子(α)和相对分离因子(β)的计算公式如公式(4)~公式(6)所示。IF值越大,说明制备的MIPs的印迹效果越好;α值越大说明印迹材料对NMN的选择和识别能力越强;β值越大说明与NIPs相比,MIPs对印迹分子NMN的特异性吸附能力越强。
(4)
(5)
(6)
式中:Qi为MIPs(或NIPs)对NMN的吸附量,mg/g;Qj为MIPs(或NIPs)对NMN结构类似物(腺苷酸、烟酰胺)的吸附量,mg/g;αM表明相比于NMN结构类似物,MIPs对NMN的吸附效果;αN表明相比于NMN结构类似物,NIPs对NMN的吸附效果。
1.4 MISPE
用MIPs作填充材料制备MISPE柱。准确称取一定质量的MIPs,装入1 mL的固相萃取柱(Agilent)中,用筛板压严实。用乙腈水对MISPE柱进行活化,然后加入一定体积的西兰花提取液吸附一定时间后,进行淋洗和洗脱,分别收集上样液和洗脱液,进行HPLC分析。
2 结果与分析
2.1 MIPs制备条件的优化
2.1.1 溶剂的用量
模板分子NMN与功能单体MAA的预聚合是利用氢键作用力,制备的MIPs属于非共价型,反应溶剂对氢键作用力以及MIPs的形态影响较大,且具有致孔作用。所用溶剂不仅要对NMN有较高的溶解度,还要能够促进NMN与MAA之间氢键的形成。NMN属于水溶性物质,在水中有较好的溶解度,且MAA和交联剂N,N′-亚甲基双丙烯酰胺在水中也有较好的溶解度,故选择水作为溶剂。但考虑到水会对氢键产生破坏,影响选择性空穴的形成,故采用混合溶剂,考虑到N,N′-亚甲基双丙烯酰胺在乙腈中也有较好的溶解度,且乙腈的极性与介电常数均低于水、对氢键的形成影响较小,乙腈与水可无限互溶,故溶剂选择乙腈水。此外,在MIPs的制备过程中,溶剂的用量也十分关键,当溶剂的量太少时,反应物黏度大、反应更趋向于本体聚合;当溶剂的量太大时,则无法形成微球沉淀。因此,溶剂的配比和用量至关重要,需对其进行优化。固定水的体积为3 mL,使得水与乙腈的体积比分别为1∶1、1∶2、1∶3、1∶4。结果如图2所示,当溶剂量为12 mL(即水3 mL,乙腈9 mL,水与乙腈的体积比为1∶3)时,MIPs吸附效果最好,可达到23.95 mg/g。
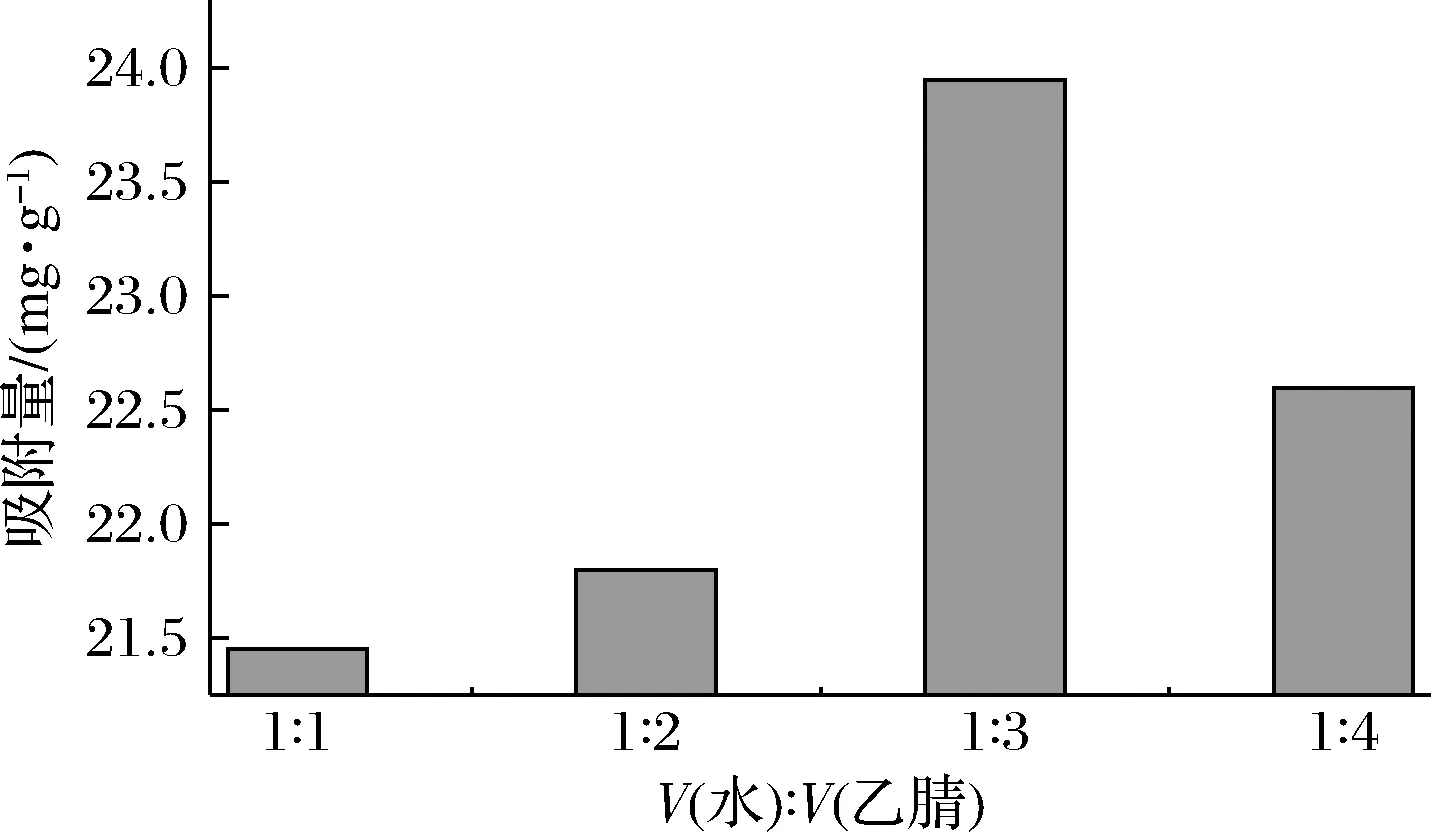
图2 溶剂用量的优化Fig.2 Optimization of solvent usage
2.1.2 模板分子、功能单体和交联剂的用量
沉淀聚合法制备NMN MIPs主要分为2个阶段:首先,在一定溶剂中,NMN与MAA通过氢键作用形成预聚体;然后AIBN分解产生自由基引发聚合,N,N′-亚甲基双丙烯酰胺使预聚体形成高度交联、刚性的聚合物。因此,NMN、MAA和N,N′-亚甲基双丙烯酰胺的用量在MIPs的制备过程中至关重要。故对每个变量设置3个水平,研究其对MIPs吸附性能的影响。正交分析见表1,方差分析见表2。MIPs制备过程中影响聚合物吸附性能的各因素主次为B(功能单体MAA)>A(模板分子NMN)>C(交联剂N,N′-亚甲基双丙烯酰胺),说明在MIPs的制备过程中MAA的用量对MIPs的吸附性能影响最大,N,N′-亚甲基双丙烯酰胺的用量对其影响最小。根据各主次因素的最高水平,得出的最优MIPs的制备方案为A2B2C2,即模板分子NMN的用量为0.04 mmol、功能单体MAA的用量为0.08 mmol、交联剂N,N′-亚甲基双丙烯酰胺的用量为0.4 mmol(其摩尔比为1∶2∶10)为最优制备MIPs的条件组合。
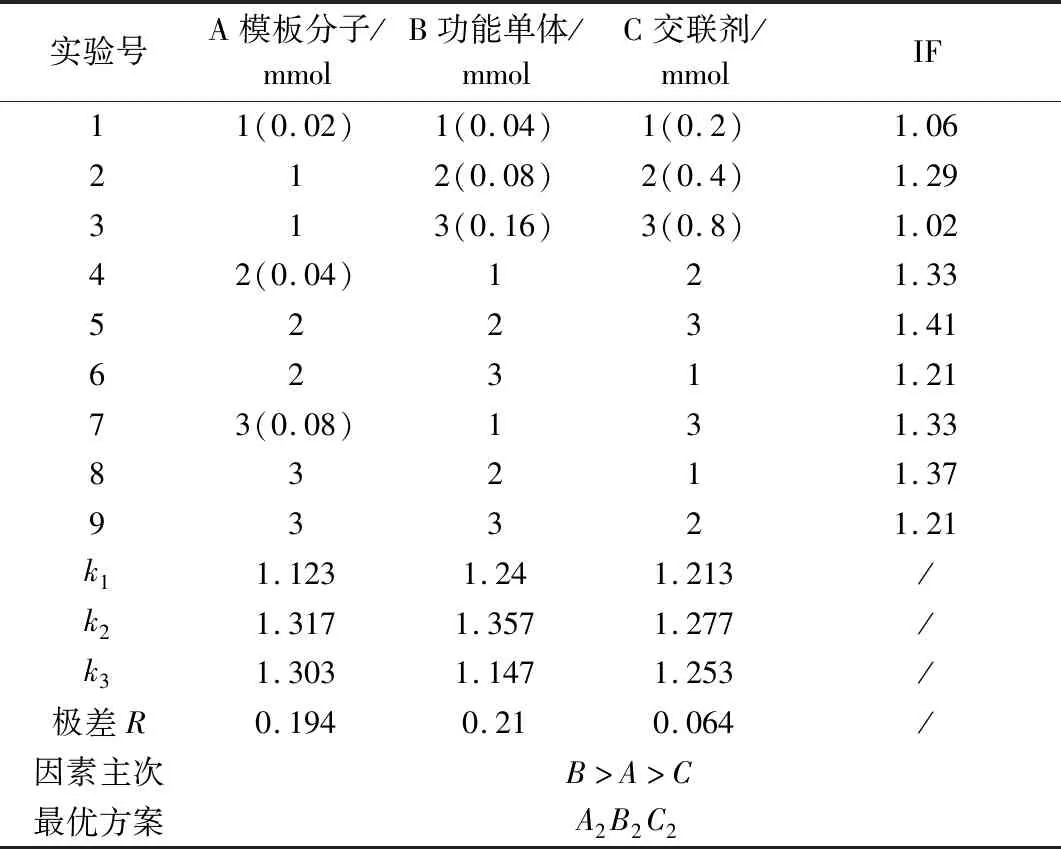
表1 正交实验优化结果Table 1 Orthogonal experiment optimization results
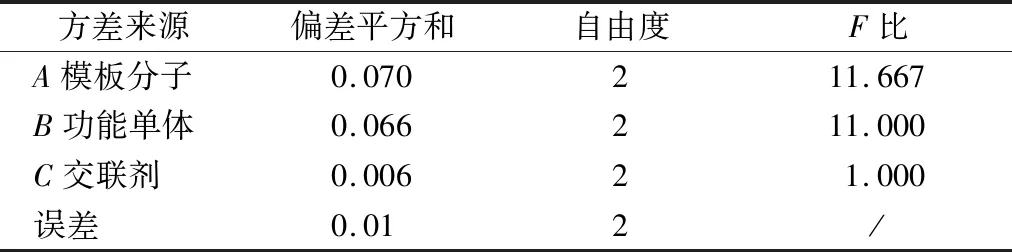
表2 正交实验方差分析Table 2 Orthogonal experiment analysis of variance
2.2 聚合物吸附性能
2.2.1 静态吸附等温线
为考察聚合物对NMN的平衡吸附能力,绘制吸附量(Q)随NMN浓度(c)的变化曲线,结果如图3所示,在10~70 μg/mL,MIPs和NIPs的吸附量均随着NMN浓度的增大而增大;而在70 μg/mL以后,曲线逐渐趋于平稳。MIPs的整体吸附量均要大于NIPs,表明MIPs的吸附性能显著强于NIPs。
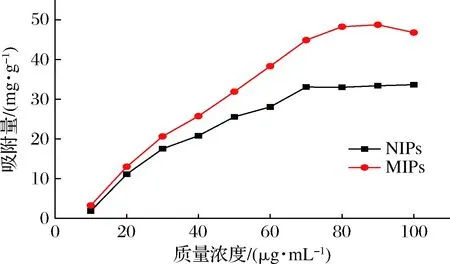
图3 MIPs和NIPs对NMN的静态吸附等温线Fig.3 Static adsorption isotherms of MIPs and NIPs to NMN
2.2.2 吸附动力学
对NMN MIPs和NIPs进行动力学测试,绘制吸附量(Q)随吸附时间(t)的变化曲线,结果如图4所示。在0~60 min,MIPs与NIPs曲线均呈上升趋势,在60 min左右达到平衡;并且 MIPs的吸附量明显高于NIPs。这是因为MIPs的“空穴”被NMN成功印迹,随着吸附时间的增加,MIPs中的空穴逐渐被NMN填充,空间位阻增大、吸附速率降低,最终达到动态平衡。而NIPs没有特定的印迹空穴,所以只能依靠聚合物表面的非特异性吸附作用进行少量的吸附。
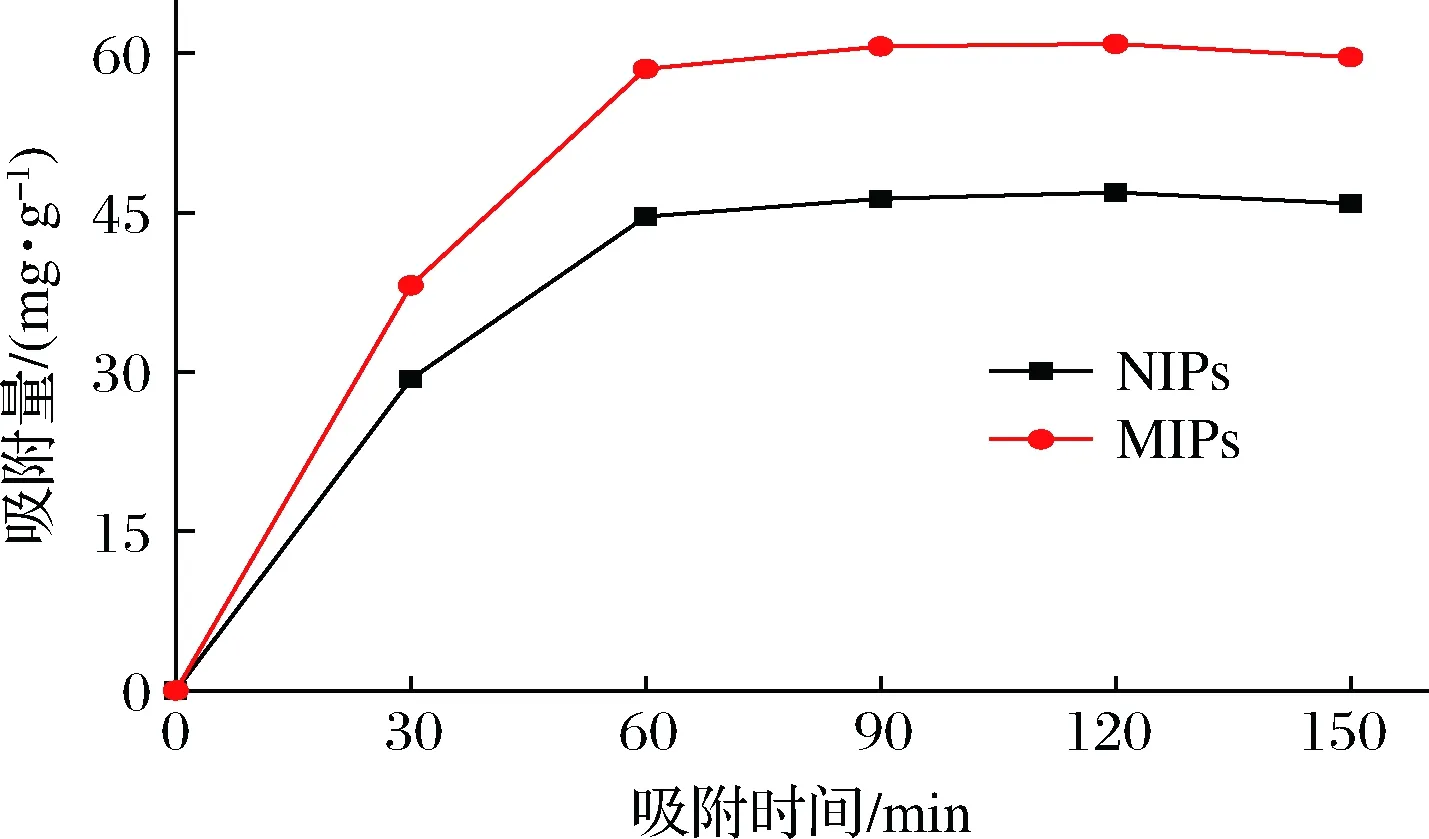
图4 MIPs、NIPs的动态吸附曲线Fig.4 Dynamic adsorption curves of MIPs and NIPs
为了进一步探究MIPs和NIPs吸附过程的动力学机理,采取准一级动力学模型和准二级动力学模型进行拟合。准一级动力学方程和准二级动力学方程的拟合结果见表3,MIPs、NIPs的准二级动力学方程的拟合结果相关系数R2(0.983 5、0.984 8)均比准一级动力学方程的R2(0.929 8、0.939 7)更接近1,说明MIPs、NIPs对NMN的吸附过程更符合准二级动力学方程。

表3 动力学方程拟合参数Table 3 Kinetic equation fitting parameters
2.2.3 选择性吸附
选取与NMN结构类似的腺苷酸和烟酰胺作为底物进行选择性吸附研究,结果见表4。IF为1.36,说明制备的MIPs具有较好的印迹效果;在有印迹分子结构类似物(腺苷酸、烟酰胺)的存在下,分离因子α均>1,说明印迹材料对NMN的选择和识别能力很好;此外,NMN与腺苷酸、烟酰胺的相对分离因子β(2.81、2.83)均>1,可见与NIPs相比,MIPs对NMN有着较强的特异性吸附能力。

表4 MIPs的选择性吸附Table 4 Selective adsorption of molecularly imprinted polymers
2.3 固相萃取柱的制备及其应用
研究了MISPE西兰花提取液中NMN的实际应用效能。取适量西兰花提取液加入到MISPE柱中,用乙腈作为淋洗液、甲醇乙酸(体积比9∶1)作为脱模液,收集洗脱液,采用HPLC分析其组成。西兰花提取液和过MISPE柱洗脱液的色谱图如图5所示,可以看出,NMN的色谱峰显著增高,杂质色谱峰显著降低或消失,说明该柱对NMN具有很好的选择性,可以从复杂基质中分离富集NMN。
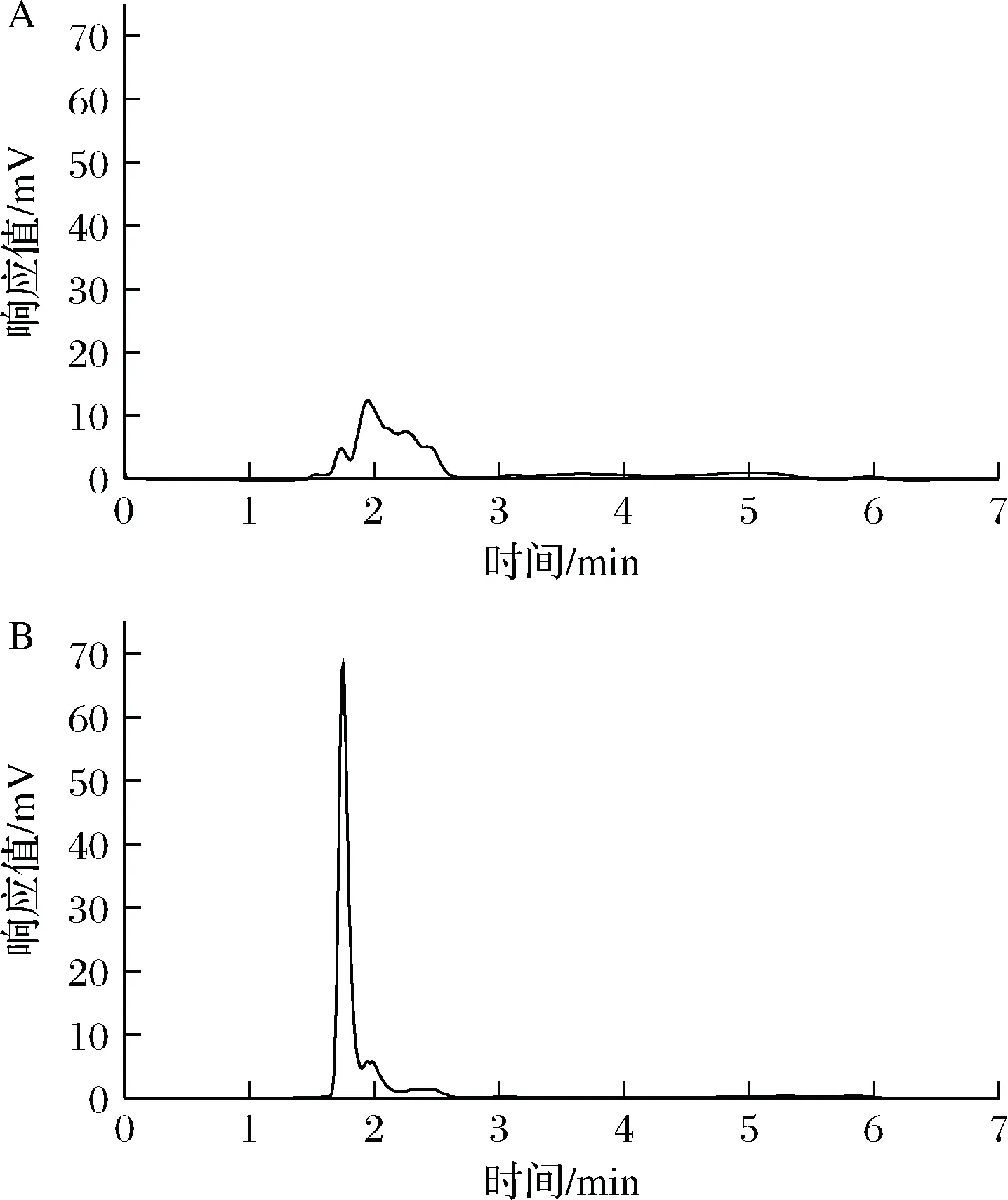
A-西兰花提取液;B-西兰花提取液经MISPE处理后的洗脱液图5 MISPE西兰花样品吸附净化效果谱图Fig.5 Spectrum of adsorption and purification effect of molecularly imprinted solid phase extraction broccoli sample
2.4 加标回收率和精密度
在1.4固相萃取条件下,采用加标回收法,在西兰花提取液中加入1 mL不同浓度的NMN标准液,旋匀,使其加标质量浓度分别为5、50、200 μg/mL,每个浓度水平测定5次,实验结果如表5所示,西兰花中NMN的回收率为89.52%~95.77%,相对标准偏差(relative standard deviation,RSD)(n=5)为1.08%~5.27%,实验结果表明该方法具有良好的准确度和精密度。
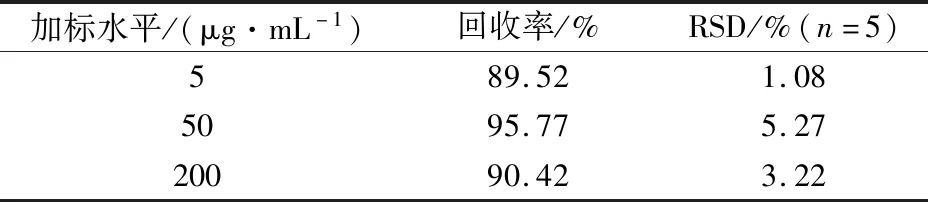
表5 西兰花中NMN的加标回收率和精密度Table 5 Recoveries and RSD of NMN in broccoli
2.5 分子印迹的重复使用性能
分子印迹的重复使用性能是评价其实用性的一个重要指标。在5 mL 80 μg/mL的NMN溶液中,加入一定量的MIPs,吸附平衡后离心,HPLC测定上清液中NMN浓度,计算该MIPs的吸附量。然后用一定量的脱模液洗脱吸附在MIPs中的NMN,干燥后,将该MIPs再加入到5 mL 80 μg/mL的NMN溶液中,吸附平衡后测定其吸附量。按照相同的步骤重复测定7次,MIPs的吸附量如图6所示。可以看出MIPs重复使用多次后,吸附性能变化不大,该实验制备的MIPs可以反复多次使用。
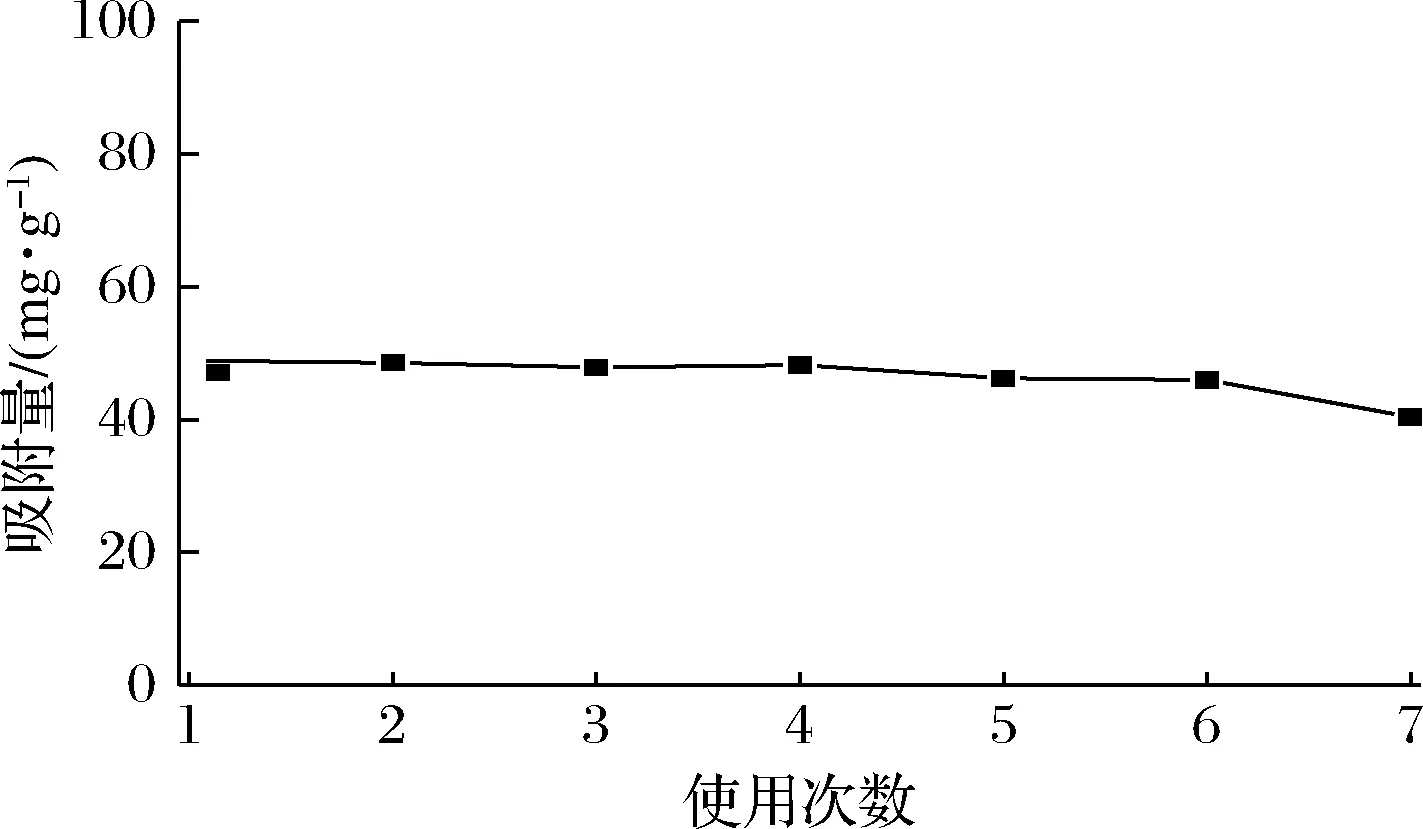
图6 多次使用后MIPs的吸附量Fig.6 Adsorption capacity of MIPs toward NMN after seven recycles
3 结论
本研究首次以NMN为模板分子、乙腈水为致孔剂、MAA为功能单体、N,N′-亚甲基双丙烯酰胺为交联剂、AIBN为引发剂,采用沉淀聚合法制备了NMN MIPs,并且采用正交试验优化了聚合工艺。当NMN、MAA、N,N′-亚甲基双丙烯酰胺的摩尔比为1∶2∶10、致孔剂乙腈水用量12 mL、聚合温度60 ℃时,制备的MIPs吸附效果最好。静态吸附结果表明,所制得的MIPs对NMN有较强的吸附能力。动态吸附结果表明,该MIPs在60 min左右达到吸附平衡;MIPs和NIPs对NMN的吸附过程均符合准二级动力学方程。选择性吸附实验结果表明MIPs对NMN有很好的特异性吸附能力。该MIPs用于固相萃取西兰花提取液中的NMN时,展现了较高的应用性能,为植物中NMN的分离和纯化提供了新的方法。
