基于低场核磁共振及成像技术的油莎豆远红外干燥过程中水分变化规律
2022-09-07余政毫朱文学白喜婷罗磊卫志娇
余政毫,朱文学,2*,白喜婷,2,罗磊,2,卫志娇
1(河南科技大学 食品与生物工程学院,河南 洛阳,471023)2(农产品干燥技术与装备河南省工程技术研究中心,河南 洛阳,471023)
油莎豆原产于尼罗河沿岸,是一种1年生的块茎类植物,又名油莎草、铁荸荠、油莎果等[1-2]。油莎豆有着极大的经济价值,如出油率(35%)、其淀粉(23.21%)、蛋白质(8.00%)、脂肪(26.50%)、糖(23.35%)[3],其淀粉较玉米或土豆有着更好的老化性与冻融稳定性,因此油莎豆有较高的工业价值,开发潜力巨大。油莎豆采摘后易发生霉变腐败,在运输、贮藏、榨油等方面都与其含水率息息相关,所以油莎豆干燥脱水这一工序就显得十分重要。农作物干燥过程一般由干燥特性曲线体现,由于油莎豆含有丰富的淀粉与油脂成分,而这些大分子与水反应后会降低水分移动性[4]。所以进一步研究油莎豆干燥过程中内部水分迁移规律十分重要。
低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)是一种无损、快速检测技术,具有灵敏度高,针对性强,检测时间短等优点。LF-NMR是通过质子(1H)的弛豫行为来区分样品的水分分布规律以及与食品组分的结合状态,已被广泛应用于食品和农业领域。目前,主要应用于肉类持水过程、农产品干燥贮藏和种子萌发过程[5]、果蔬干制脱水过程[6]等水分状态及分布规律的研究中。SUN等[7]基于LF-NMR技术对3种典型物料胡萝卜(蔬菜)、香蕉(水果)和杏鲍菇(食用菌)展开研究,结果表明,LF-NMR快速实时无损检测技术在水果和蔬菜干燥中具有良好的适用性。稻谷中不同状态的水分之间存在着一定的相互转换与渗透。目前还没有基于低场核磁研究油莎豆干燥过程的水分分布与迁移规律,对于油料(农)作物更集中于花生、大豆等物料的研究[8]。渠琛玲等[9]基于LF-NMR研究了热风干燥花生仁,建立了花生仁国标法实测含水率与NMR弛豫谱图得到的总水分峰占比的拟合方程。LF-NMR成像技术可以直观地观察样品内部水分分布状况,可实时检测物料内部水分流动情况,对于研究物料内部水分迁移变化以及分布情况有重大意义。例如段文娟等[10]通过磁共振成像(magnetic resonance imaging,MRI)图像给出了白芍炮制过程水分变化规律;周四晴等[11]通过低场核磁以及MRI成像技术研究了厚度控制对怀山药远红外干燥过程中水分迁移的影响;李潮锐等[12]为了准确获得油料作物种子水分油脂含量信息,利用LF-NMR以鲜花生为对象做了横向弛豫分析。因此,通过核磁成像可以更加清晰地看出水分在油莎豆内部的分布情况以及在进行红外干燥过程中油莎豆内部水分的变化规律。
目前,无论是远红外干燥方式还是LF-NMR和MRI成像技术在油莎豆研究中均未见报道。本试验以油莎豆为实验对象,基于LF-NMR和MRI成像技术,研究不同远红外辐射温度下油莎豆的干燥特性、横向弛豫时间T2及其信号幅值,分析干燥过程中油莎豆内部水分分布与迁移规律。本研究可为油莎豆工业干燥提供科学依据。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
油莎豆:试验所用油莎豆采购于河北省保定市,挑选出大小均匀的油莎豆保存于4 ℃冰箱中,测得新鲜油莎豆平均干基含水率50.59%。
1.1.2 实验设备
XMT-G5000真空红外辐射干燥箱,上海聚辰科学仪器有限公司;TM3030 Plus扫描电镜,日立高新技术公司;JA2003电子天平,宁波市华丰电子仪器厂;NM120-015V-I LF-NMR成像分析仪(磁体温度31.99~32.01 ℃,共振频率22.099 539 1 MHz,探头线圈直径15 mm),上海纽迈电子科技有限公司。
1.2 实验方法
1.2.1 油莎豆干燥
将新鲜油莎豆通过远红外辐射干燥箱进行干燥,干燥温度设定在40~80 ℃,辐射距离15 cm。称取100 g大小均匀的油莎豆进行红外干燥,前期每隔15 min取样称量后期30 min,直至油莎豆干基含水率达到10%,每个实验条件取样3次,保证测定结果的稳定性。
1.2.2T2的采集与反演
干燥过程中的样品放至室温后准确称取1.00 g,然后放入18 mm玻璃管中,将玻璃管放入永久磁场中心位置进行分析测定,每组试验重复3次。多脉冲回波CPMG序列参数为:主频SF1=21.142 MHz,偏移频率O1=302 134.02 Hz,90°脉冲时间P90=7.3 μs,180°脉冲时间P180=26 μs,采样点数TD=400 010,重复采样等待时间TW=800 ms,累加次数:32次,回波时间TE=0.2 ms,回波数Echo Count=10 000。
1.2.3 MRI检测
成像面为油莎豆的横截面,MRI成像参数:频率编码方向视野50 mm×50 mm,层间隙0.5 mm,层厚2.5 mm,重复时间400 ms,回波时间10 ms,采集次数20,编码步数192,频率方向256。对映射后的图片进行伪彩处理,导出BMP格式图像。
1.2.4 微观结构检测
将干燥后的油莎豆切成3 mm×3 mm×1 mm小块薄片并用石墨双面胶粘在样品台上,用扫描电子显微镜放大200倍观察油莎豆的微观结构,并保存图片。
1.3 计算方法
1.3.1 初始干基含水率
初始干基含水率根据GBT 14489.1—2008油料水分及挥发物含量测定。初始干基含水率计算如公式(1)所示:
(1)
式中:W为初始干基含水率,%;m0为干物质重量,g;m1为新鲜物质的重量,g。
1.3.2 油莎豆干燥速率
干燥速率计算如公式(2)所示:
(2)
式中:DR为干燥速率,%/min;t1、t2为干燥时间,min;Wt1为t1时干基含水率,%;Wt2为t2时干基含水率,%。
1.3.3 油莎豆水分比
水分比计算如公式(3)所示:
(3)
式中:MR为水分比;W0为初始干基含水率,%;Wt为t时刻的干基含水率,%。
1.4 数据处理
试验数据采用SPSS 19.0、Excel 2020软件进行整理分析;采用Origin 9.0进行数据处理绘图。
2 结果与分析
2.1 油莎豆远红外辐射干燥特性
图1是油莎豆红外干燥过程中的水分比随时间变化的曲线。
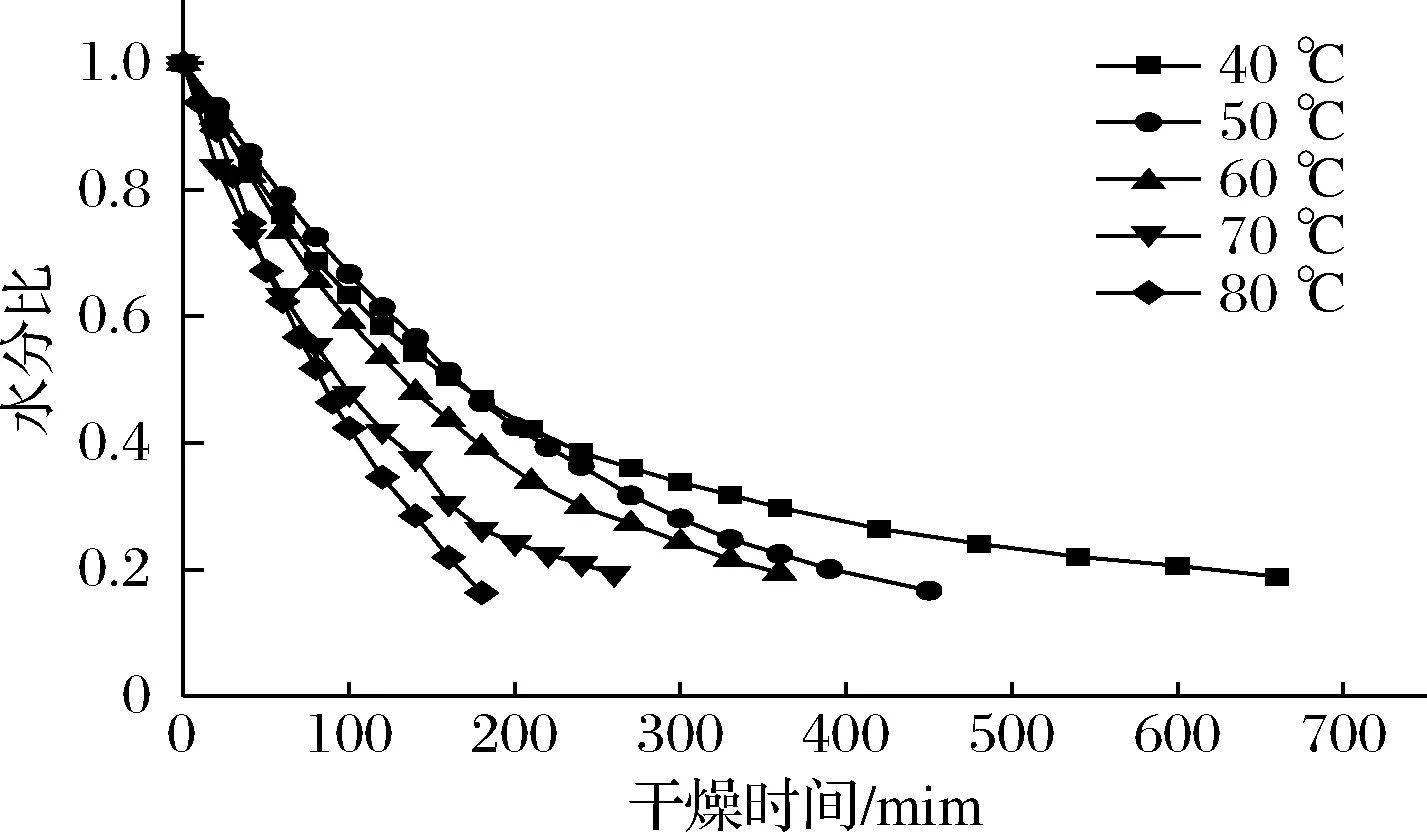
图1 不同温度下水分比曲线Fig.1 Water ratio curve at different infrared temperature
由图1可知,随着温度的升高,干燥时间缩短。温度为40、50、60、70、80 ℃时,油莎豆干燥至终点分别用时为660、450、360、260、180 min。温度越高干燥至安全水分用时越短,80 ℃干燥用时是40 ℃用时的3.6倍、是60 ℃用时的2倍,这是因为物料吸收的红外线随着远红外辐射温度升高而增多,物料内部的水分子运动加剧失水速度加快[13]。此外,红外辐射温度升高有利于增大油莎豆内的水分子动能,内部水分更快地向外迁移外部水分快速蒸发,进而加快了干燥速率。
图2是油莎豆红外干燥过程中干燥速率随时间变化的曲线。
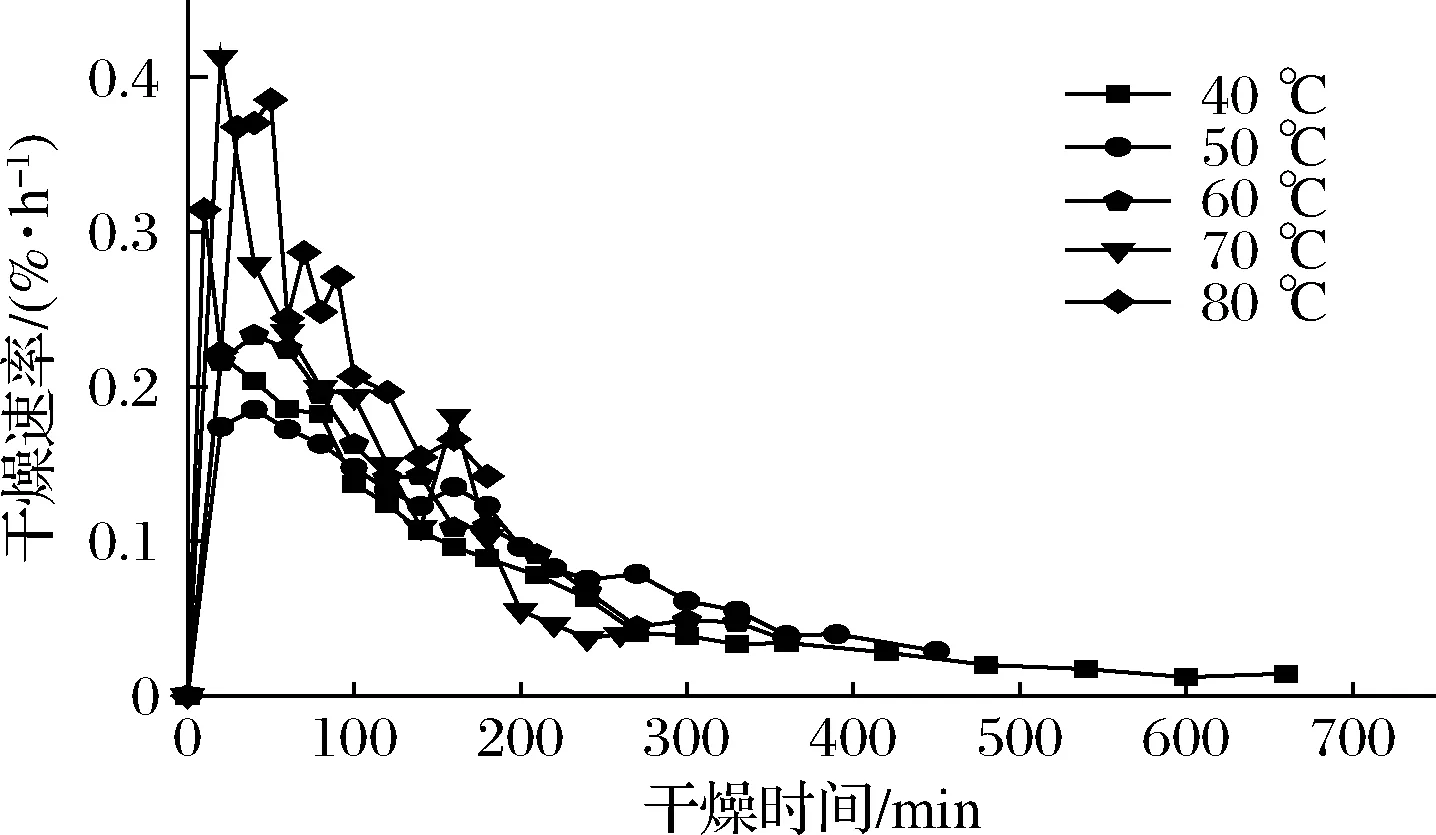
图2 不同温度下干燥速率曲线Fig.2 Drying rate curves at different infrared temperatures
由图2可知,干燥速率先迅速增大然后逐渐减小,一方面是由于干燥初期油莎豆表层水分会迅速汽化,内部水分向表层迁移的速率大于或等于表层水分汽化速率。温度越高,这种现象就越明显,速率也最先达到最大;另一方面,食品中的水、有机物和高分子物质在远红外干燥过程中具有很强的吸收红外线辐射的能力,因此内部温度往往比表面温度高。随后干燥速率开始减小,内部扩散速率小于表层汽化。干燥后期,温度对油莎豆干燥速率影响不大,这是由于干燥后期物料中的干物质向物料表面迁移,使表层变得越来越致密,水分散失困难。
通过对油莎豆红外干燥特性的研究,40 ℃用时过长耗能较多,80 ℃油莎豆表皮严重变形,并伴有微弱的豆香味,因此选择50、60、70 ℃研究油莎豆内部水分分布状态。
2.2 干燥过程中油莎豆内部水分分布状态与迁移规律
2.2.1 不同温度条件下T2反演谱随干燥时间的变化
油莎豆干燥过程中伴随很多复杂的物理化学变化。油莎豆中的水分主要分为3种形态:结合水、不易流动水和自由水[14-15]。由NMR原理可知,质子所处的化学环境不同,其弛豫时间T2的长短便不相同,水分的自由度也不同[16]。弛豫时间T2越短表明水与物质结合越紧密,越不容易排出,反之则质子自由度越高,越容易排出,因此通过弛豫时间T2可以了解油莎豆干燥过程中水分的迁移规律,反映水分的相态特征[17]。
图3~图5是不同温度下油莎豆的T2反演图谱。
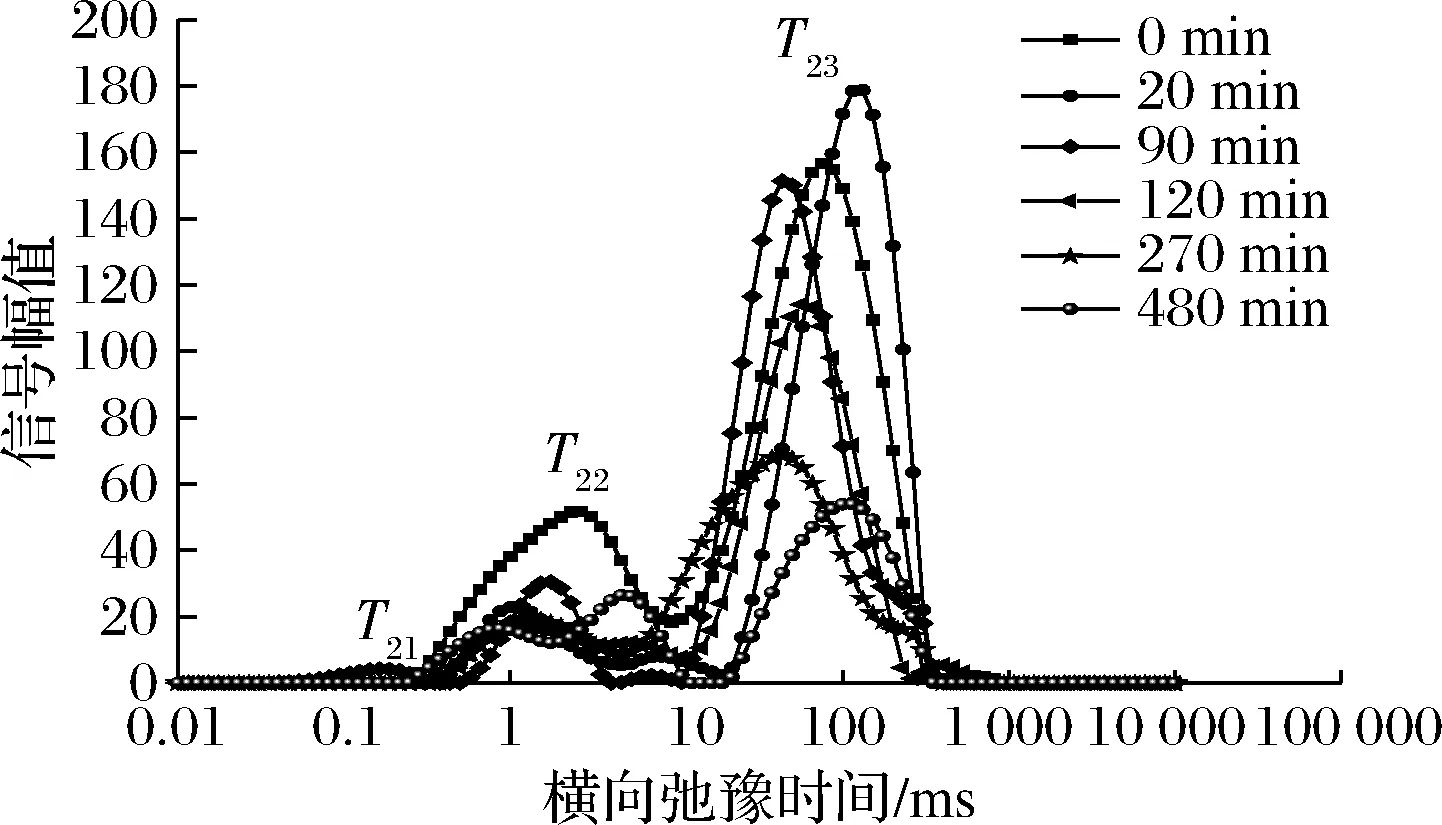
图3 50 ℃不同干燥时间油莎豆横向时间(T2)反演谱Fig.3 50 ℃ inversion spectrum of the horizontal time (T2) time
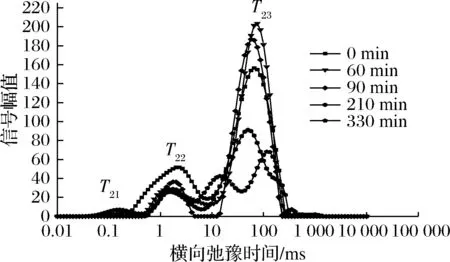
图4 60 ℃不同干燥时间油莎豆横向时间(T2)反演谱Fig.4 60 ℃ inversion spectrum of the horizontal time (T2) time
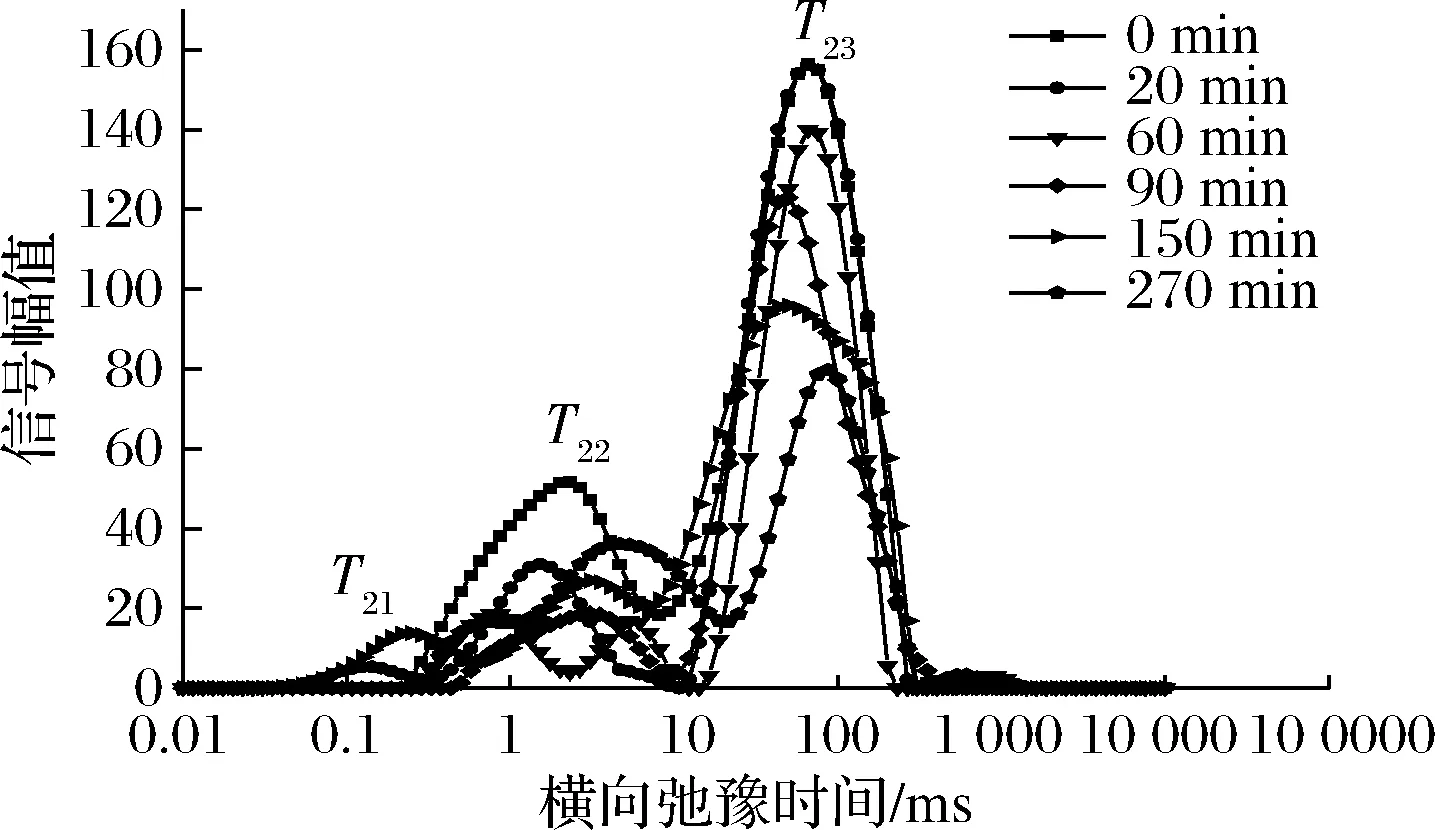
图5 70 ℃不同干燥时间油莎豆横向时间(T2)反演谱Fig.5 70 ℃ inversion spectrum of the horizontal time (T2)
由图3~图5可知,油莎豆有3~4种弛豫峰,从左到右依次为T21(0.072~0.248 ms),T22(0.285~8.511 ms),T23(18.738~265.609 ms)和T24(611.131~1 032.847 ms),其中弛豫时间最短的T21组分可以看作是油莎豆内的结合水,其结合程度最为紧密;弛豫时间T22组分的水自由度介于结合水与自由水之间,容易发生转化,定义为不易流动水;最长弛豫时间T23组分的水具有水溶液中水的流动性,因此定义为自由水,占新鲜油莎豆总信号幅值的70%左右。由于油莎豆中富含油脂,查阅文献可知富含油脂的花生仁的LF-NMR图中也会出现自由水峰与油脂峰有部分重叠的情况[18],因此推断T24为油脂峰,结合整个干燥过程T24未出现显著变化,同样能证明该结论。T24是油莎豆的油脂弛豫峰,在整个干燥过程中没有显著的差异。随着干燥的进行,T2反演图中自由水峰面积不断减少,自由水T23发生明显向左迁移,说明自由水的自由度随着干燥时间的延长而降低,也就说明了物料在干燥后期效率降低。油莎豆表皮较为致密,干燥过程物料发生了明显的收缩形变,自由水T23主要存在于油莎豆的液泡、原生质和细胞间隙中,被认为体积水和结构水,由于油莎豆表皮会随着收缩堆积变厚,内部细胞间隙变小,使得自由水流动性降低,所以在NMR检测中T23发生了小幅度左迁。干燥初期结合水T21与T22迁移幅度较小,说明水分与固质结合较为紧密,干燥对其自由度影响不明显。
通过对比3种不同温度条件下的反演谱随干燥时间的变化可知,50、60、70 ℃条件下,都出现了T22峰幅值比鲜样T22峰幅值大的现象。由李定金等[19]研究山药片微波干燥过程中水分变化可知这是由于在干燥过程中,物料中不同状态的水分之间的相互转化。干燥初期,自由水首先被脱除,在较低的温度条件下,自由水被除去的速度较慢,油莎豆内部形成了浓度差,一部分的自由水转化成了不易流动水;温度分别为50、60、70 ℃时,自由水被完全脱除分别用了480、330、270 min。因此,温度是影响水分迁移的重要因素,温度越高,越有利于水分的脱除,所需干燥时间越短。
2.2.2 结合水状态
图6是油莎豆结合水峰面积(A21)随时间的变化曲线。
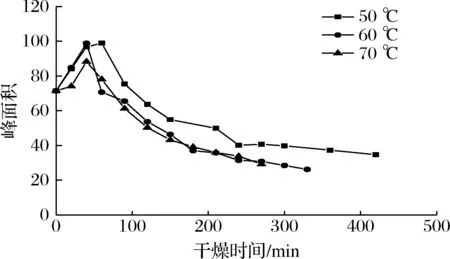
图6 结合水峰面积在不同温度下随时间的变化曲线Fig.6 Variation curve of peak area of oil-sand bean-bound water with time at different temperatures
A21在干燥过程中表示结合水的变化,这一组分处于紧密的化合状态,在油莎豆内部含量很少,一般在干燥中很难去除[20]。由图6可知,结合水峰面积A21随着干燥的进行呈现先增加后减小的趋势。这是由于干燥前期,一部分自由水与淀粉等营养物质结合使结合水含量升高[21]。随干燥的进行,油莎豆中的一些物质被分解,结合水转变为不易流动水被去除,导致结合水减少。
2.2.3 不易流动水状态
图7是不同温度下油莎豆不易流动水(A22)峰面积随时间的变化曲线。
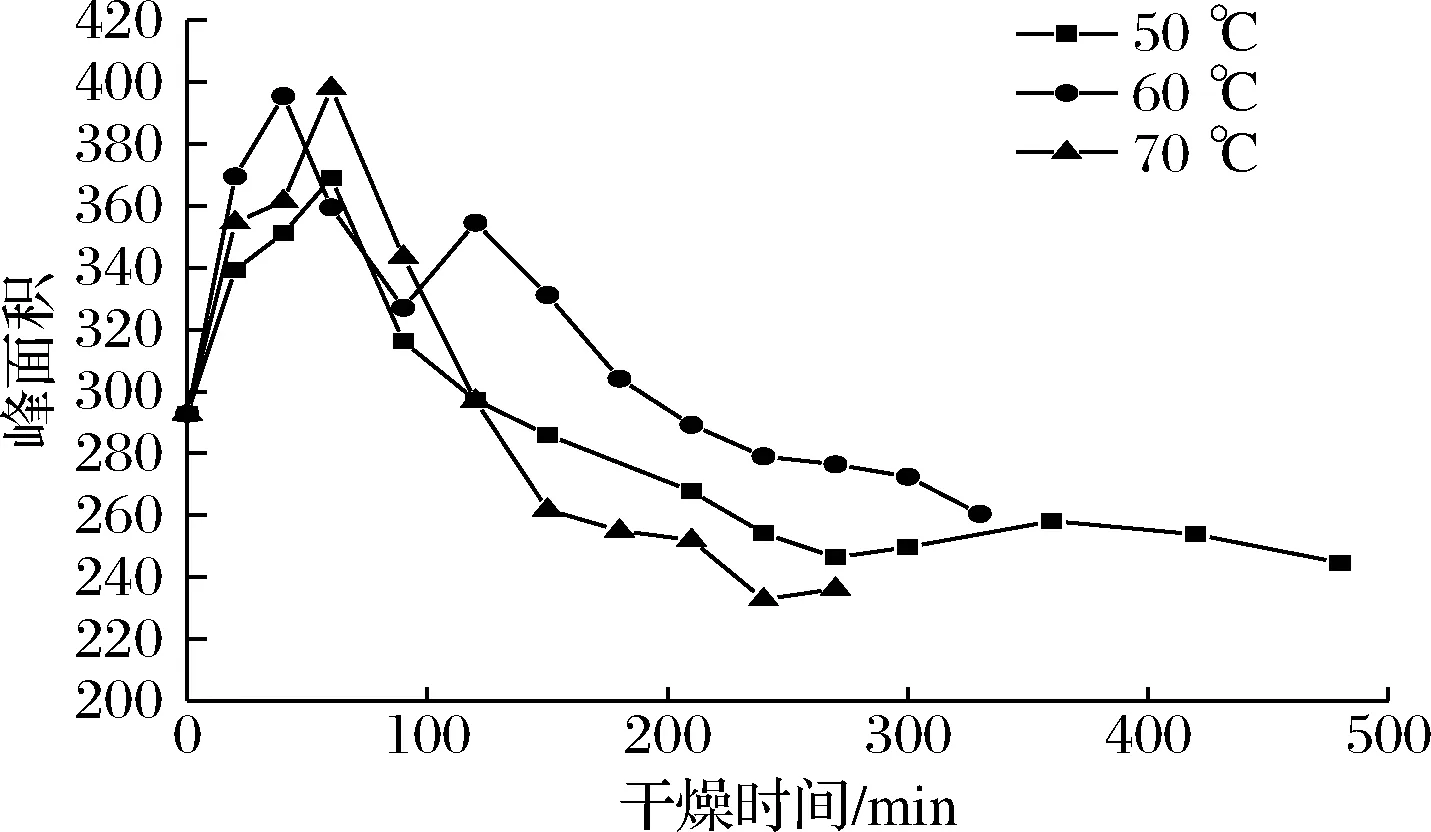
图7 不易流动水峰面积在不同温度下随时间的变化曲线Fig.7 Variation curve of peak area of water with different temperature
由图7可知,A22峰面积随着干燥时间的延长略微上升,这说明干燥过程中部分自由水从分散状态过度为成簇状态,自由水转变为包裹淀粉的薄层水。任广跃等[22]研究表明,当热风温度在60~105 ℃时,干燥过程中仅次于自由水的结合水转变为包裹在淀粉颗粒外面的薄层水可以防止淀粉糊化,由此可推断出油莎豆A22峰面积的上升可能同样可以起到防止淀粉糊化的作用。3种干燥温度下不易流动水的含量大概都是在50 min左右升高到最大值,然后逐渐减小,这是由于随着干燥的进行油莎豆内部分自由水转变为不易流动水。随后不易流动水含量开始减少,是由于随着干燥的进行物料内的自由水大量脱去,转变成不易流动水的速率大大减小,不易流动水随内部扩散逐渐脱除[13]。
2.2.4 自由水状态
图8是不同温度下油莎豆自由水(A23)峰面积随时间的变化曲线。
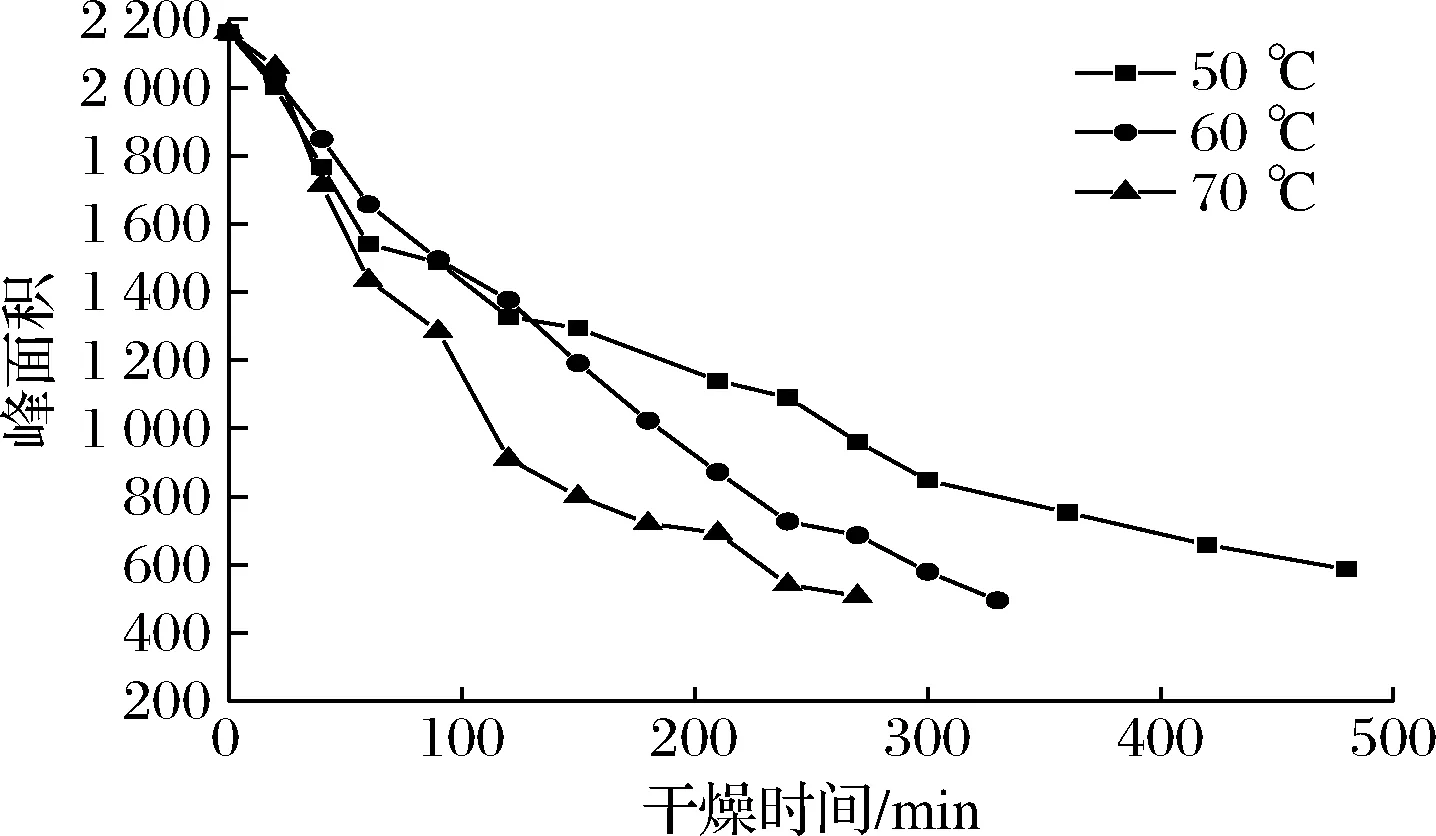
图8 自由水峰面积在不同温度下随时间的变化曲线Fig.8 Variation curve of free water peak area with time at different temperatures
由图8可知,干燥前期油莎豆中水分以自由水为主,由于自由水自由度较大,A23迅速降低,自由水被迅速干燥脱除。此外,信号幅值在干燥终点依然较大,是由于油莎豆含有丰富油脂,除水以外油脂也会提供一部分氢质子,通过LF-NMR不能将脂肪与水分完全分开[23];干燥后期随着水分的减少,油莎豆内部结构更为紧密,内部孔道受到淀粉、蛋白质等大分子挤压变窄,表皮堆积变厚,自由水流动性减弱也一定程度的阻碍了水分脱除效率。
通过峰面积分析结果可知,油莎豆干燥过程中水分迁移规律为:自由水蒸发的同时一部分会转变为不易流动水和结合水,同时部分A22也向A21发生转变,A21向A22、A22向A23的转变伴随着整个干燥过程。
2.3 反演总峰面积与干基含水率关系分析
反演图谱中每个阶段对应的峰面积可以看出相对应状态的水分含量,油莎豆中总含水量可以用总峰面积表示;通过研究总峰面积随时间变化规律以及干基含水率随时间变化规律,利用SPSS 22.0对总峰面积与干基含水率数据进行拟合分析,发现油莎豆干燥过程总峰面积与干基含水率呈现线性关系,所得曲线方程及其各个参数如表1所示。
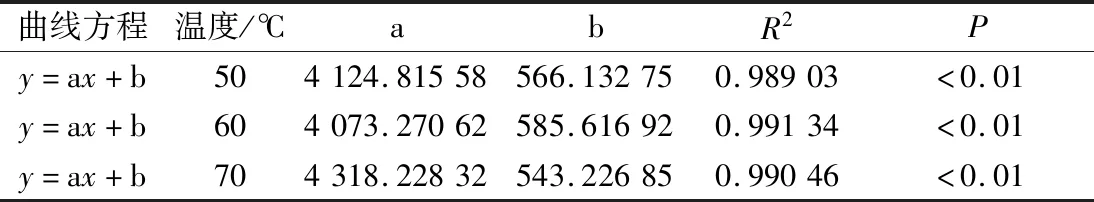
表1 不同温度下总峰面积与干基含水率关系Table 1 Relationship between the total peak area and the dry-based moisture content at different temperatures
由表1得知,50、60、70 ℃总峰面积随干基含水率拟合方程分别为y=4 124.815 58x+566.132 75、y=4 073.270 62x+585.616 92、y=4 318.228 32x+543.226 85,拟合得出调整后R2分别为0.989 03、0.991 34、0.990 46,回归线性方程具有较高的拟合度。通过低场核磁测定出油莎豆总峰面积进一步可以推断出此时油莎豆的干基含水率,也可预测油莎豆红外干燥过程中任意时刻的干基含水率对应的总峰面积,可为油莎豆红外干燥工艺设计、参数优化、过程控制提供依据。
2.4 红外干燥过程中油莎豆的MRI结果
利用MRI成像技术获得的油莎豆在干燥过程中H+质子密度图像变化,MRI成像能得到样品内部的质子密度加权像,反映样品中氢质子的分布,通常氢质子越密集的区域,质子密度加权像越明亮[17]。图9中红色面积代表的水分含量高,黄色面积代表水分含量较低,绿色代表水分含量最少。经过纽迈核磁图像处理软件得到油莎豆不同温度、不同干燥时间下的MRI图像,如图9所示。
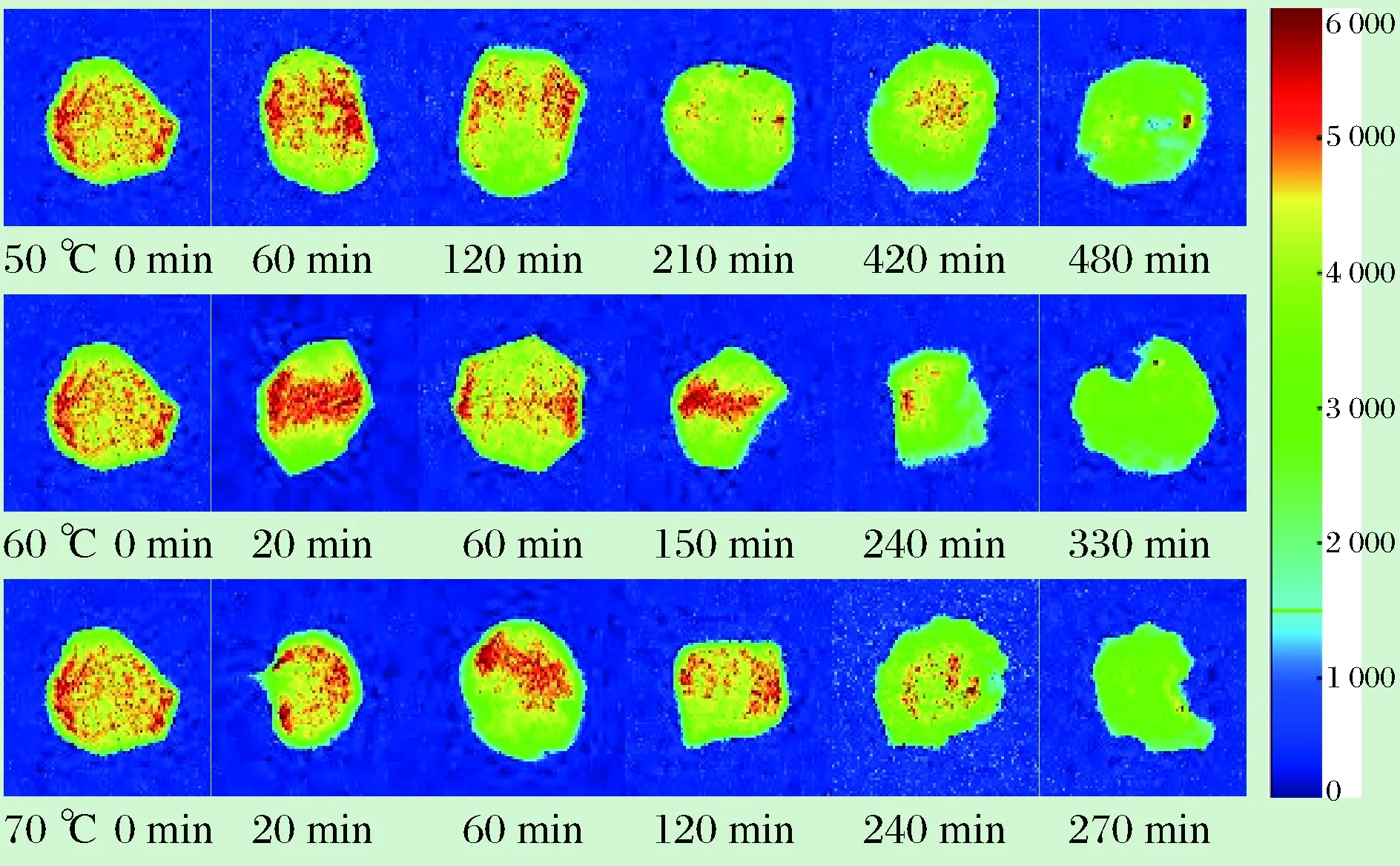
图9 不同温度条件下油莎豆不同干燥时间的核磁成像Fig.9 Nuclear magnetic imaging of different drying times at different temperatures
由图9可知,右侧图例表示H+质子密度从高到低,颜色由红色变成绿色。3种温度下H+质子变化大致相同,与上文T2反演谱随干燥时间的变化相呼应。刚开始干燥时,油莎豆内部的水分含量较多、分布较广,因此图9中的红色部分十分明显,且面积和密度都比较大。随着干燥时间的延长,图9中分布广泛的红色部分逐渐消失,同时周围黄绿色区域变多。此时失去的水分正好对应油莎豆内部的自由水,红外干燥使油莎豆内部温度升高,水分受到的束缚力降低,表层水分迅速脱去,且内部的水分缓慢向外迁移。由图9可以清楚看出,干燥中后期红色区域逐渐缩小,油莎豆内部的水分逐渐减少。干燥结束仍然有部分显示红色和黄色,查阅资料得知油莎豆含有大量的油脂,油脂中的氢质子也会使MRI图像变得明亮[23]。MRI图中的变化和横向弛豫时间T2的变化基本一致,温度越高,失水越快。
2.5 红外干燥对油莎豆微观结构的影响
干燥后的油莎豆内部细胞壁、细胞膜等微观结构会发生变化,对干燥前后的油莎豆进行电镜扫描。油莎豆鲜样和不同温度干燥后的电镜扫描如图10所示。新鲜油莎豆内部结构清晰完整,细胞孔径轮廓分明呈现出较规则的蜂窝状排列。此外,还可以看到大量的淀粉颗粒。经过红外干燥之后,油莎豆外观发生明显的收缩变形,内部结构也受到不同程度的影响。50 ℃干燥后的油莎豆细胞间隙减小,细胞轮廓不明显,淀粉颗粒紧密。随温度的升高,60 ℃时蜂窝状结构破坏更严重,到70 ℃基本看不出蜂窝状结构,这是因为干燥过程中油莎豆失水收缩导致细胞壁呈现出明显的萎缩,细胞之间的界限开始变得模糊。综上,通过观察油莎豆微观结构可以证实淀粉颗粒从有序排列到紧密堆积导致干燥后期不易流动水和结合水难以排除,自由水弛豫时间向左迁移。
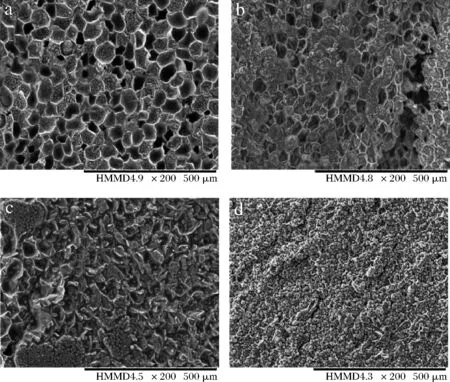
a-新鲜;b-50 ℃;c-60 ℃;d-70 ℃图10 不同温度条件下油莎豆微观结构图Fig.10 Microstructure of oil beans at different temperatures
3 结论
本研究利用NMR及其成像技术研究油莎豆干燥过程中的水分状态及其分布情况,分析了不同温度条件下不同状态水所占比例和横向弛豫时间。研究表明:(1)在远红外辐射干燥过程中,样品的横向弛豫时间T2x不断向左移动,样品中的自由水逐渐被脱去,最终到达干燥终点时,只剩下少量的不易流动水和结合水;(2)通过3种峰面积的变化规律可以看出3种水分之间的变化规律,干燥过程中会有部分自由水会转变为不易流动水,部分不易流动水转变成结合水,3种水都会逐渐减少,最终自由水基本全部去除;(3)NMR成像能得到油莎豆内部的水分动态变化伪彩图,观察可知,新鲜油莎豆中水分分布较广,随着干燥进行红色范围越来越小,直至干燥结束仍有红色部分,这部分物质可能是未去除的结合水和油脂;(4)总峰面积与干基含水率进行拟合得到线性方程具有较高的拟合度,所得模型能较准确地预测油莎豆远红外干燥过程中的水分含量规律;(5)干燥后油莎豆微观结构变化较大,排列规则的蜂窝状细胞结构逐渐破坏,细胞壁呈现出皱缩,淀粉颗粒紧密堆积。
因此,在油莎豆实际干燥过程中,可以通过内部水分的迁移规律、各组分水被去除的时间以及微观结构的变化,控制干燥因素调节干燥参数,达到更好的干燥效果。还可以根据干基含水率与总峰面积之间的线性方程,计算油莎豆完成干燥所需的时间。
