氯雷他定糖浆剂的抑菌效力考查
2022-09-02吕杨兰
吕杨兰
三明市检验检测中心,福建 三明 365000
氯雷他定为抗组胺药,主要用于缓解过敏性鼻炎有关的症状。药物制剂常因本身没有抑菌特性或者抑菌效力比较弱,使用过程中易造成微生物的污染,因此,大部分药物一般为独立包装,使用过程中不容易引起污染,而本次试验所用检品为多剂量糖浆剂,患者使用过程中需要多次开启,增加了污染的概率。为了避免微生物污染所带来的危害,厂家一般会在药物制剂中添加适宜的抑菌剂[1]。
2020 年版《中国药典》四部通则0116 糖浆剂中有规定[2],如果制剂处方中需要加入抑菌剂,除了另有规定外,其抑菌效力需符合通则1121 项下的规定。可见,对氯雷他定糖浆剂抑菌效力的测定是其质量控制中的一项重要指标[3-4]。厂家根据其特性添加了不同浓度的苯甲酸钠作为抑菌剂。受该药厂的委托,建立测定氯雷他定糖浆剂抑菌效力的方法,并检验厂家提供的三批药品是否符合要求,进而对厂家确定出适宜的抑菌剂及合理添加量提供帮助。
1 仪器和试药
1.1 仪器
YXQ-50G 压力蒸汽灭菌锅(上海申安医疗器械厂),BS1360-Ⅱ-A2 生物安全柜(北京东联哈尔仪器制造有限公司),SPX-150B-Z 细菌培养箱(上海博讯实业有限公司医疗设备厂),LRH-325A霉菌培养箱(广东泰宏君科学仪器股份有限公司)。
1.2 菌种
大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],上述标准菌株全部来自中国食品药品检定研究院,工作用菌株为冻干粉,第0 代。
1.3 供试品
氯雷他定糖浆剂样品1(批号2004F-01-082,规格60 mL,抑菌剂0.8 mg/mL);氯雷他定糖浆剂样品2(批号2004F-01-083,规格60 mL,抑菌剂1.2 mg/mL);氯雷他定糖浆剂样品3(批号20210301,规格60 mL,抑菌剂1 mg/mL)。以上样品使用的抑菌剂均为苯甲酸钠。
1.4 培养基
胰酪大豆胨琼脂培养基(TSA)(北京三药科技开发公司,批号210123);胰酪大豆胨琼脂对照培养基(中国食品药品检定研究院,批号135025-202103);沙氏葡萄糖琼脂培养基(SDA)(广东环凯微生物科技有限公司,批号 1095501);沙氏葡萄糖琼脂对照培养基(中国食品药品检定研究院,批号135013-201703);pH7.0 氯化钠-蛋白胨缓冲液(广东环凯微生物科技有限公司,批号1093561);胰酪大豆胨液体培养基(TSB)(北京三药科技开发公司,批号210129);沙氏葡萄糖液体培养基(SDB)(北京三药科技开发公司,批号2010132)。经验证培养基的适用性符合规定。
2 方法与结果
2.1 菌落计数方法适用性试验
2.1.1 菌悬液的制备取大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的冻干粉适量加入到TSB 培养基,33 ℃培养24 h 备用。取白色念珠菌冻干粉适量加入SDB,23 ℃培养48 h 备用。取黑曲霉的沙氏葡萄糖固体斜面培养物,加5 mL 含0.05%(mL/mL)吐温-80 的pH7.0 无菌氯化钠-蛋白胨缓冲液洗下霉菌孢子[5-6],作为原液备用。
2.1.2 菌落计数方法的验证在进行抑菌效力检查前,首先应确保菌落计数方法的可行性。此次计数方法的验证按照《中国药典》2020 年版四部通则“1105”微生物计数法进行[2]。(1)试验组。取样品10 mL 加至90 mL 的pH7.0 无菌氯化钠-蛋白胨缓冲液中,制成1∶10 供试液。取“2.1.1”项下制备好的金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌菌液各0.1 mL分别加入至1∶10供试液9.9 mL,混匀,使得每毫升稀释液中细菌菌数均应不大于100 cfu,立即取1 mL 此稀释液注入平皿,倾注胰酪大豆胨琼脂培养基;另取上述白色念珠菌及黑曲霉试验菌液各0.1 mL 分别加入至1∶10 供试液9.9 mL,混匀,使得每毫升稀释液中霉菌菌数均应不大于100 cfu,立即分别取1 mL 此稀释液注入平皿,倾注沙氏葡萄糖琼脂培养基。每种菌平行制备2 个平皿。分别按规定温度及时间培养,测定其菌落数。(2)菌液对照组。取试验组相同的金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、白色念珠菌及黑曲霉5 种菌悬液各0.1 mL 分别加入至pH7.0 无菌氯化钠-蛋白胨缓冲液9.9 mL,混匀。分别取1 mL 注入平皿,倾注胰酪蛋白胨琼脂培养基或沙氏葡萄糖琼脂培养基。每种菌平行制备2 个平皿。按规定温度及时间培养,测定其菌落数。(3)供试液对照组。取试验组项下的1∶10 供试液1 mL 注入平皿,倾注胰酪蛋白胨琼脂培养基或沙氏葡萄糖琼脂培养基。每种培养基平行制备2 皿.按规定温度及时间培养,测定供试液本底菌数。(4)阴性对照试验。取pH7.0 无菌氯化钠-蛋白胨缓冲液1 mL,按试验组操作。
2.1.3 结果回收率计算试验组平均菌落数减去供试液对照组平均菌落数的差与菌落对照组平均菌落数的比值。经过验证,每株菌落回收率均大于50%,符合2020 年版《中国药典》要求[2],平皿法即可作为菌落计数方法。
2.2 抑菌效力试验
2.2.1 接种菌液菌数测定在进行抑菌效力试验前,接种的菌悬液需要进行菌数测定。用0.9%无菌氯化钠溶液将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、白色念珠菌和黑曲霉的孢子菌悬液分别进行10 倍稀释,取10-5、10-6、10-7三个稀释级的稀释液各1 mL 至平皿中,每个稀释级平行制备2 个平皿,分别加入胰酪大豆胨琼脂培养基或者沙氏葡萄糖琼脂培养基,用平皿法测定菌数。结果见表1。
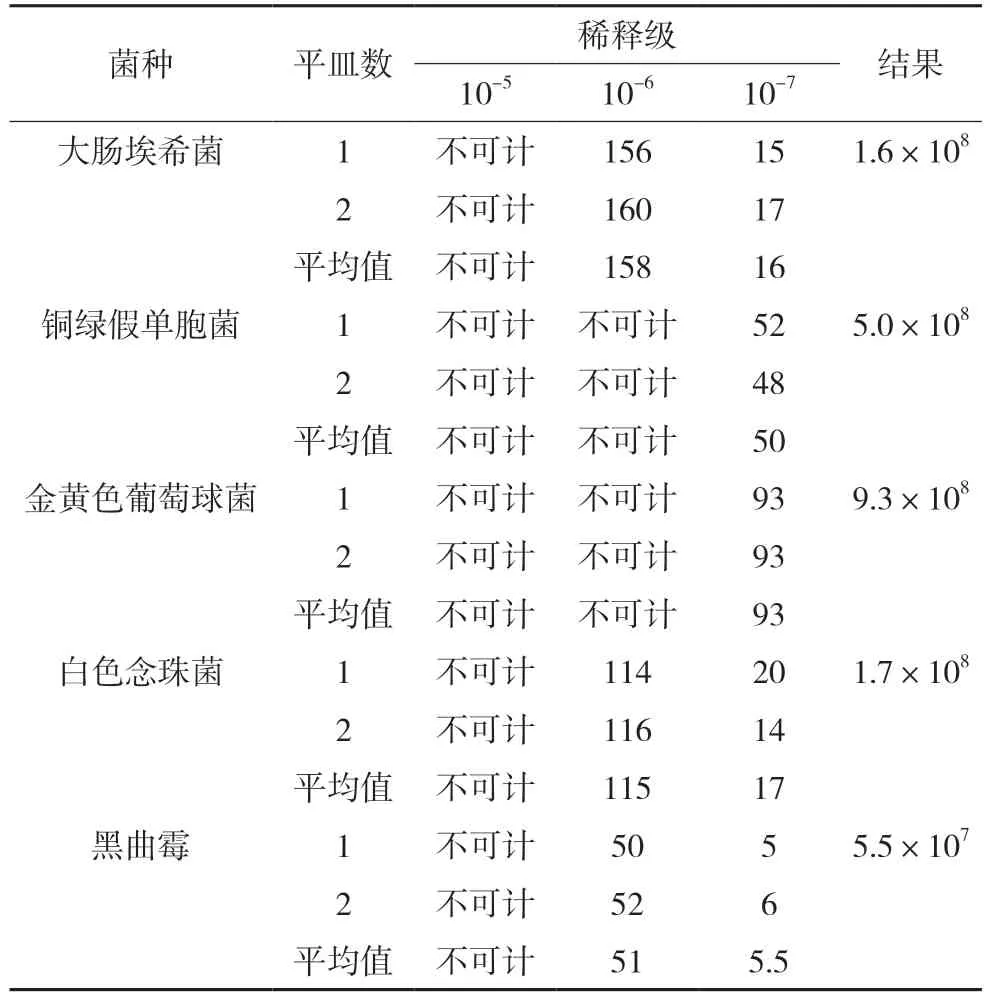
表1 试验菌菌液计数结果(cfu/mL)
2.2.2 供试品接种本次厂家提供的氯雷他定糖浆剂的包装,容量足够用,无需另换其他容器,同时包装容器也能够保证按无菌操作要求接入试验菌及后续试验,为了使接种的菌悬液与样品充分混合均匀,分别取3 个批次的样品(包装规格60 mL)各两瓶,移去10 mL 样品后,每批样品分别接种3 种细菌(大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌)和2 种真菌(白色念珠菌、黑曲霉),分别依次接种菌悬液各500 μL,使其最终菌悬液的浓度为105~106cfu/mL。置20 ℃避光储存。
2.2.3 存活菌数测定厂家提供的三批药品均为口服制剂,按照《中国药典》2020 年版口服制剂抑菌效力标准进行判断[2],5 种供试菌分别于接种后的14 d、28 d 测定其供试样品中存活菌数,按照菌落计数法适用性试验所确定的方法,测定供试品中所含的菌数是否满足要求。计算l mL 供试品各试验菌在14 d,28 d 各间隔时间的菌数减少值,并换算成1 g 值(见表2)。
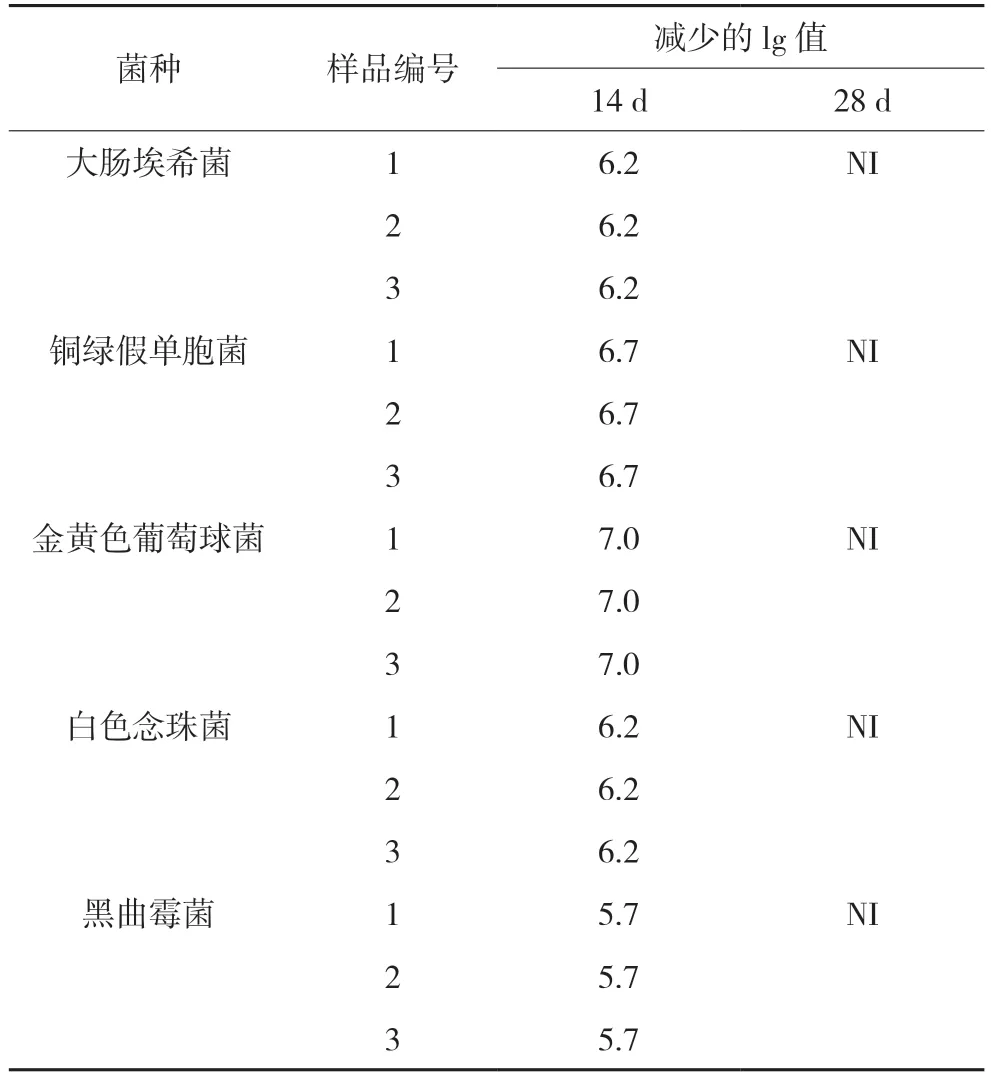
表2 抑菌效力测试结果
2.2.4 口服制剂抑菌效力判断标准根据《中国药典》2020 年版四部制剂通则“1121 抑菌效力检查法”的规定[2],口服制剂药品取样时间间隔为14 d 和28 d。细菌数量换算成lg 值后,在14 d 时减少的lg值要不小于3;真菌数量换算成lg 值后,在14 d 减少的lg 值要不小于1。细菌和真菌在28 d 数量相对于14 d 来看,数量增加不超过0.5 lg 视为未增加。
三批药品在第14 天,细菌菌数跟初始加入的菌数比,下降的lg 值均大于3,真菌菌数跟初始加入的真菌数比,下降的lg 值均大于1;在第28 天,三批药品的细菌数和真菌数与第14 天相比,减少的lg值为0,无增加;根据上述抑菌效力判断标准,该厂家提供的三批次药品均通过抑菌效力挑战试验。
3 讨论
抑菌剂也被称为防腐剂,在制剂中添加抑菌剂的时候,不仅要考虑抑菌效果,还要同时考虑抑菌剂的毒性[7]。《中国药典》2020 年版糖浆剂中规定添加苯甲酸的用量不得过0.3%(其钾盐、钠盐的用量分别按酸计)[2],这个范围很宽泛,本试验结果虽然表明该厂提供的药品制剂通过了抑菌效力测试,但对于抑菌剂添加量的确定还需要厂家进一步摸索试验[8]。
另外,厂家提供的是糖浆剂,糖浆剂本身是含有高浓度的蔗糖水溶液,这类口服制剂还可选用鲁氏酵母菌,该菌可耐受高糖高盐高渗环境,如果该抑菌效力测定中加入鲁氏酵母菌作为试验菌株,将更加全面、科学[9]。
抑菌剂的添加是为了保证用药安全,防止在使用期间药品被微生物污染,但添加抑菌剂的量及抑菌剂的种类,都需要生产企业严格把关,不能只为了抑菌效力达标,而盲目添加[10-11]。另外,全面了解各类抑菌剂的特性及影响因素,合理科学地添加才能保证用药安全。
