藏红花素通过Nrf2/HO-1通路对脑缺血再灌注大鼠血脑屏障的保护作用*
2022-08-31杨欢欢段毅
杨欢欢,段毅
(石家庄市第三医院,石家庄 050011)
脑卒中是危害人类生命健康的3大疾病之一,其中缺血性脑卒中约占80%[1]。血脑屏障(BBB)能够阻止某些物质进入脑组织,对维持脑神经系统内环境稳定发挥着重要作用。通过药物溶栓或手术治疗实现血流再通是抢救缺血性脑卒中患者的关键,但血流再灌注后将导致活性氧(ROS)和炎症因子大量释放,加重氧化应激和炎症反应,破坏BBB结构和通透性而引发血管源性脑水肿,是导致缺血性脑卒中患者死亡和残疾的重要因素[2-3]。核因子E2相关因子 2(Nrf2)/血红素加氧酶 1(HO-1)信号通路在机体氧化应激和炎症反应过程中发挥着重要的调控作用[4-5]。藏红花素是中药藏红花的主要活性成分,属于类胡萝卜素类化合物,具有抗炎、抗氧化、抗肿瘤等多种药理学作用。既往研究发现,藏红花素能够通过抗炎、抗氧化、保护线粒体对缺血性脑损伤起到一定保护作用[6];能够通过维持BBB完整性防止老年大鼠脑缺血损伤,但其机制尚未明确[7]。本研究探讨了藏红花素对脑缺血再灌注后BBB的影响及其机制,现报道如下。
1 材料与方法
1.1 动物 240只清洁级健康雄性SD大鼠购自河北省实验动物中心[生产许可证号:SCXK(冀)2018-004],体质量 220~250 g,动物合格号:202005011;实验动物饲料购自河北省实验动物中心。清洁环境分笼饲养7 d后进行实验,饲养环境:温度(23~25)℃、相对湿度(45~65)%、光照黑暗12 h/12 h,饮水进食不限。
1.2 药物与试剂 藏红花素(纯度≥98%)购自美国Sigma公司(批号:18215-2G);尼莫地平注射液购自济川药业集团有限公司(批号:200417);红四氮唑(TTC)、伊文思蓝购自国药集团化学试剂有限公司(批号:20191108、20190613);苏木精-伊红(HE)染色试剂盒和肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、干扰素-γ(IFN-γ)酶联免疫吸附法(ELISA)检测试剂盒购自南京建成生物工程研究所(批号:200124、191218、200316、200109);丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)试剂盒购自上海恒远生物科技有限公司(批号:7E284L5、8E406G3、4E317F2);胞浆胞核蛋白制备试剂盒购自北京普利莱基因技术有限公司(批号:0918A20);二辛可宁酸(BCA)、二氨基联苯胺(DAB)试剂盒购自北京索莱宝生物科技有限公司(批号:PC0020、DA1015);闭合蛋白(Occludin)、闭锁连接蛋白-1(ZO-1)、Nrf2、HO-1、核因子-κB p65(NF-κB p65)抗体、β-肌动蛋白(β-actin)和IgG二抗购自北京博奥森生物技术有限公司(批号:2001P19、2002P25、1911P03、2001P14、1909P16、1910P22-b、1908P30A)。
1.3 主要仪器 GFL-230型烤箱(天津市莱波瑞仪器设备有限公司);PE型全自动酶标仪(美国Perkin Elmer公司);UV-1200紫外-可见光分光光度计(上海美谱达仪器有限公司);RM2245型石蜡切片机(德国Leica公司);Mini-Protoan Tcua型电泳仪(美国Bio-Rad公司);DYCZ-40D型转膜仪(北京六一生物科技有限公司);CX-21型光学显微镜(日本Olympus公司)。
1.4 实验方法
1.4.1 动物分组、给药与模型制备 按随机数字表法将240只SD大鼠分为假手术组,模型组,低、中、高剂量藏红花素组和尼莫地平组,每组40只。因口服给药方式,影响药物吸收的因素较多,个体差异较大,经查阅文献,藏红花素给药方式多为腹腔注射给药[8-9]。造模手术前7 d开始,低、中、高剂量藏红花素组分别每日1次腹腔注射给予10、20、40 mg/kg的藏红花素[10],尼莫地平组每日1次腹腔注射给予2mg/kg的尼莫地平[11],假手术组和模型组均每日1次腹腔注射给予0.9%氯化钠溶液。末次给药24 h后,除假手术组外的各组大鼠均参照杨丽等[12]的报道,通过线栓阻断大脑中动脉2 h后恢复血流再灌注的方法制备脑缺血再灌注大鼠模型;假手术组行手术通路,但不插入线栓。
1.4.2 神经功能缺失评分 再灌注24 h后,各组随机取8只大鼠,按照Longa评分标准[13]进行神经功能缺失评分:无神经功能障碍表现,得0分;瘫痪侧前肢不能正常伸展,得1分;行走时向瘫痪侧转圈,得2分;向瘫痪侧倾倒,得3分;意识降低、不能主动爬行,得4分;得分越高则说明神经功能缺失越严重。
1.4.3 TTC染色法计算脑组织梗死率 神经功能缺失评分完成后,3 ml/kg腹腔注射10%水合氯醛溶液实施麻醉,颈椎脱臼处死、断头取脑,去除小脑、脑干,-20℃冻存15 min后冠状切片(厚度2 mm),置1%的TTC溶液中37℃避光孵育30 min(每5 min将脑切片翻转1次),苍白色为梗死区,通过图像分析软件计算脑组织梗死率,梗死率(%)=(梗死区总面积/切片总面积)×100%。
1.4.4 失质量法检测脑组织含水量 再灌注24 h后,在各组剩余大鼠中分别随机取8只大鼠,3 mL/kg腹腔注射10%水合氯醛溶液实施麻醉,颈椎脱臼处死、断头取脑,去除小脑、脑干后称质量为湿质量,置于95℃烘箱烘干至恒质量后称质量为干质量,含水量(%)=[(湿质量-干质量)/湿质量]×100%。
1.4.5 HE染色法观察脑组织病理学改变 再灌注24 h后,在各组剩余大鼠中分别随机取8只大鼠,3 mL/kg腹腔注射10%水合氯醛溶液实施麻醉,颈椎脱臼处死、断头取脑,去除小脑、脑干后置4%多聚甲醛溶液4℃固定72 h,石蜡浸润包埋、4 μm厚度连续切片,行二甲苯透明和梯度乙醇溶液水化后,按照HE试剂盒操作说明行HE染色,封片后通过光学显微镜观察脑组织病理学改变。
1.4.6 伊文思蓝渗透法检测BBB通透性 再灌注24 h后,在各组剩余大鼠中分别随机取8只大鼠,以4 mL/kg经尾静脉注射2%的伊文思蓝溶液,1.5 h以后3 mL/kg腹腔注射10%水合氯醛溶液实施麻醉,暴露心脏,由左心室-右心耳通路灌注400mL的0.9%氯化钠溶液,断头取脑,切取缺血侧脑半球、研磨匀浆后加入3倍量50%的甲酰胺溶液,60℃孵育24 h后3 000 r/min离心(离心半径10 cm)10 min取上清液,然后通过酶标仪检测610 nm波长处吸光度(OD)值,然后根据标准曲线计算脑组织伊文思蓝含量,脑组织伊文思蓝含量可反映BBB通透性。
1.4.7 脑组织 TNF-α、IL-1β、IFN-γ、MDA 含量和SOD、CAT活性检测 再灌注24 h后,取各组剩余的8只大鼠,3 ml/kg腹腔注射10%水合氯醛溶液实施麻醉,颈椎脱臼处死、断头取脑,切取缺血侧脑组织100 mg,剪碎后加入4℃裂解液,冰上静置30 min使其充分裂解,4℃、3500r/min离心(离心半径10cm)10 min取上清液,根据ELISA试剂盒操作说明,通过酶标仪检测TNF-α、IL-1β、IFN-γ含量;根据试剂盒操作说明进行处理后,通过紫外-可见分光光度计检测脑组织MDA含量和SOD、CAT活性。
1.4.8 Western blot法检测脑组织 Occludin、ZO-1、Nrf2、HO-1、胞浆 NF-κB p65、胞核 NF-κB p65 蛋白表达 取缺血侧脑组织100 mg,按照胞浆胞核蛋白提取试剂盒操作说明制备胞浆胞核蛋白,BCA法检测蛋白浓度后沸水浴10 min,上样后通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白,湿法转聚偏氟乙烯(PVDF)膜,室温封闭1 h后滴加 Occludin(1∶800)、ZO-1(1∶800)、Nrf2(1∶1 000)、HO-1(1∶1 000)、NF-κB p65(1∶1 000)、β-actin(1∶2 000)抗体 4 ℃孵育 12 h,洗膜后滴加 IgG 二抗(1∶4 000)室温孵育1.5 h,洗膜后滴加DAB显色,以目标蛋白与内参β-actin条带灰度值的比值做为目标蛋白的相对表达量。
1.5 统计学方法 运用SPSS 20.0软件对实验数据进行统计分析,数据以均数±标准差(±s)表示,多样本间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 藏红花素对脑缺血再灌注大鼠神经功能缺失评分、脑梗死率、脑含水量的影响 与假手术组相比,模型组神经功能缺失评分、脑梗死率、脑含水量显著升高(P<0.05);与模型组相比,中、高剂量藏红花素组和尼莫地平组神经功能缺失评分、脑梗死率、脑含水量显著降低(P<0.05);与尼莫地平组相比,高剂量藏红花素组神经功能缺失评分、脑梗死率显著降低(P<0.05),脑含水量差异无统计学意义(P>0.05)。见图 1、表 1。
表1 藏红花素对脑缺血再灌注大鼠神经功能缺失评分、脑梗死率、脑含水量的影响(±s)Tab.1 Effect of crocin on neurological deficit score,cerebral infarction rate,cerebral water content in rats with cerebral ischemia reperfusion(±s)
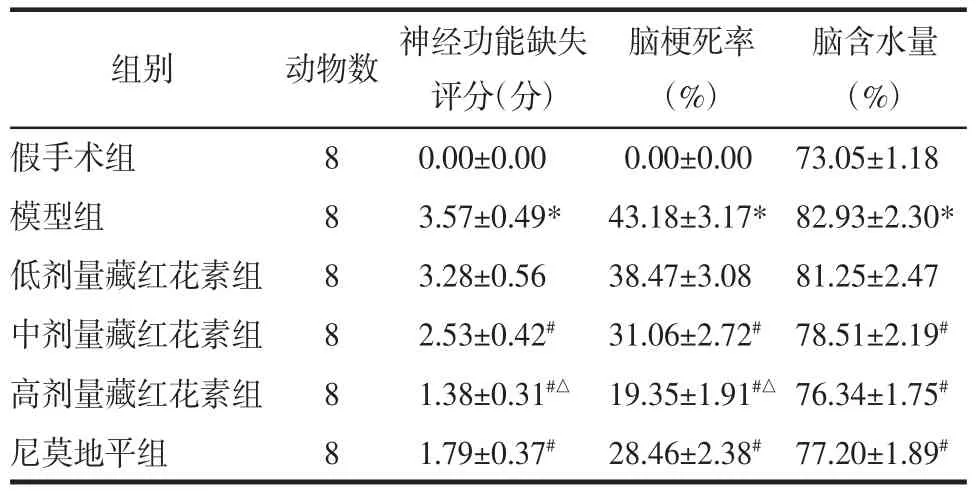
表1 藏红花素对脑缺血再灌注大鼠神经功能缺失评分、脑梗死率、脑含水量的影响(±s)Tab.1 Effect of crocin on neurological deficit score,cerebral infarction rate,cerebral water content in rats with cerebral ischemia reperfusion(±s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与尼莫地平组相比,△P<0.05。
脑含水量(%)假手术组 8 0.00±0.00 0.00±0.00 73.05±1.18模型组 8 3.57±0.49* 43.18±3.17* 82.93±2.30*低剂量藏红花素组 8 3.28±0.56 38.47±3.08 81.25±2.47中剂量藏红花素组 8 2.53±0.42# 31.06±2.72# 78.51±2.19#高剂量藏红花素组 8 1.38±0.31#△ 19.35±1.91#△ 76.34±1.75#尼莫地平组 8 1.79±0.37# 28.46±2.38# 77.20±1.89#组别 动物数 神经功能缺失评分(分)脑梗死率(%)
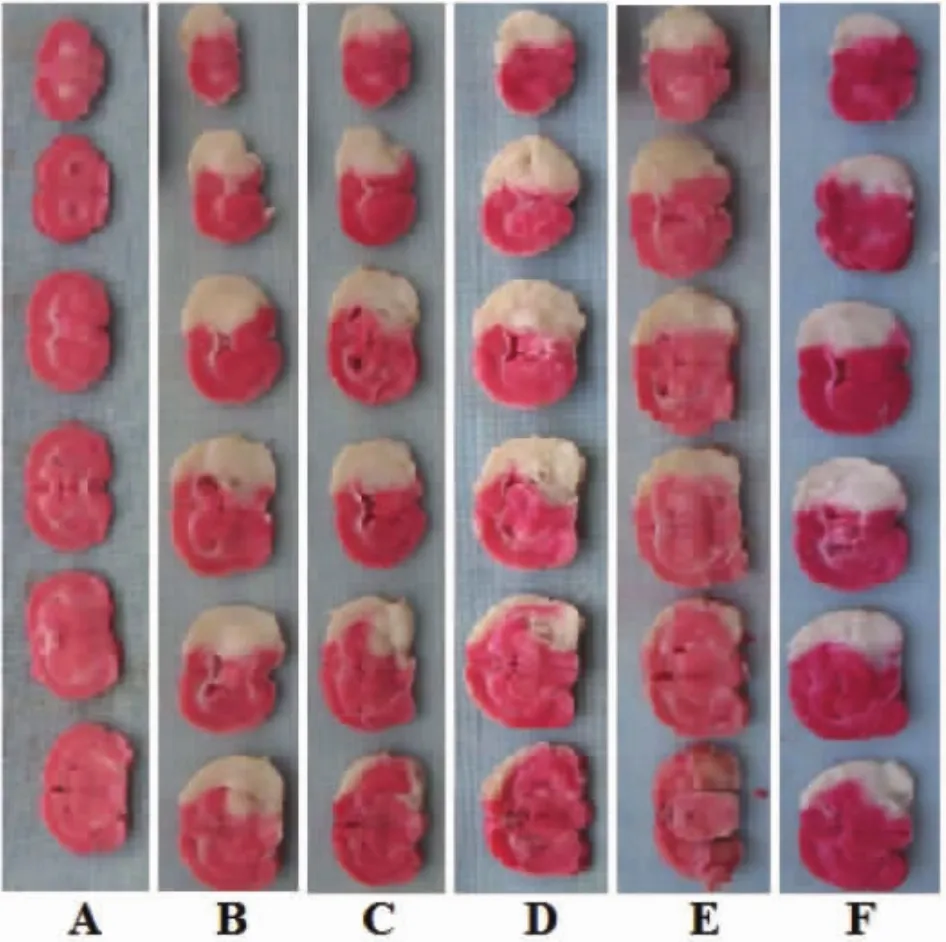
图1 藏红花素对脑缺血再灌注大鼠脑梗体积大的影响Fig.1 Effect of crocin on cerebral infarct volume in rats with cerebral ischemia reperfusion
2.2 藏红花素对脑缺血再灌注大鼠脑组织病理学改变的影响 假手术组脑组织形态和结构未见异常;模型组可见水肿,神经元数量减少、形态不规则,固缩、空泡变性,胞核深染,炎性细胞浸润等病理学改变;与模型组相比,低、中、高剂量藏红花素组和尼莫地平组脑组织病变呈不同程度改善,其中藏红花素各组呈现一定的剂量依赖性,高剂量藏红花素组改善效果优于其它组。见图2。
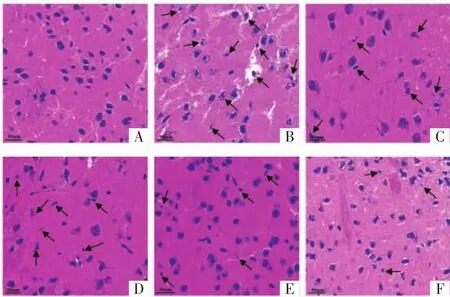
图2 藏红花素对脑缺血再灌注大鼠脑组织病理学改变的影响(HE,×400)Fig.2 Effect of crocin on the pathological changes of brain tissue in rats with cerebral ischemia and reperfusion(HE,×400)
2.3 藏红花素对脑缺血再灌注大鼠BBB通透性的影响 与假手术组相比,模型组脑组织伊文思蓝含量显著升高(P<0.05);与模型组相比,中、高剂量藏红花素组和尼莫地平组脑组织伊文思蓝含量显著降低(P<0.05);与尼莫地平组相比,高剂量藏红花素组伊文思蓝含量显著降低(P<0.05)。见表2。
表2 藏红花素对脑缺血再灌注大鼠BBB通透性的影响(±s)Tab.2 Effect of crocin on BBB permeability of rats with cerebral ischemia and reperfusion(±s) μg/g

表2 藏红花素对脑缺血再灌注大鼠BBB通透性的影响(±s)Tab.2 Effect of crocin on BBB permeability of rats with cerebral ischemia and reperfusion(±s) μg/g
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与尼莫地平组相比,△P<0.05。
组别 动物数 伊文思蓝含量假手术组 8 1.09±0.14模型组 8 11.96±1.48*低剂量藏红花素组 8 9.85±1.51中剂量藏红花素组 8 6.81±1.17#高剂量藏红花素组 8 4.73±0.80#△尼莫地平组 8 6.29±0.93#
2.4 藏红花素对脑缺血再灌注大鼠脑组织TNF-α、IL-1β、IFN-γ含量的影响 与假手术组相比,模型组脑组织TNF-α、IL-1β、IFN-γ含量显著升高(P<0.05);与模型组相比,中、高剂量藏红花素组和尼莫地平组 TNF-α、IL-1β、IFN-γ 含量显著降低(P<0.05);与尼莫地平组相比,高剂量藏红花素组TNF-α、IFN-γ 含量显著降低(P<0.05),IL-1β 含量差异无统计学意义(P>0.05)。见表3。
表3 藏红花素对脑缺血再灌注大鼠脑组织TNF-α、IL-1β、IFN-γ 含量的影响(±s)Tab.3 Effect of crocin on the content of TNF-α,IL-1β,IFN-γ in brain tissue of rats with cerebral ischemia reperfusion(±s)
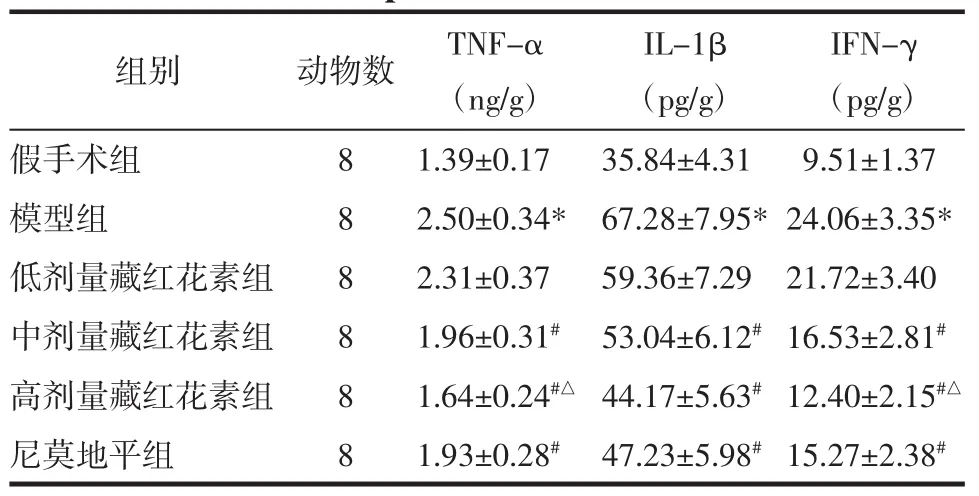
表3 藏红花素对脑缺血再灌注大鼠脑组织TNF-α、IL-1β、IFN-γ 含量的影响(±s)Tab.3 Effect of crocin on the content of TNF-α,IL-1β,IFN-γ in brain tissue of rats with cerebral ischemia reperfusion(±s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与尼莫地平组相比,△P<0.05。
IFN-γ(pg/g)假手术组 8 1.39±0.17 35.84±4.31 9.51±1.37模型组 8 2.50±0.34* 67.28±7.95*24.06±3.35*低剂量藏红花素组 8 2.31±0.37 59.36±7.29 21.72±3.40中剂量藏红花素组 8 1.96±0.31# 53.04±6.12#16.53±2.81#高剂量藏红花素组 8 1.64±0.24#△ 44.17±5.63#12.40±2.15#△尼莫地平组 8 1.93±0.28# 47.23±5.98#15.27±2.38#组别 动物数 TNF-α(ng/g)IL-1β(pg/g)
2.5 藏红花素对脑缺血再灌注大鼠脑组织MDA含量和SOD、CAT活性的影响 与假手术组相比,模型组脑组织MDA含量显著升高,SOD、CAT活性显著降低(P<0.05);与模型组相比,中、高剂量藏红花素组和尼莫地平组MDA含量显著降低,SOD、CAT活性显著升高(P<0.05);与尼莫地平组相比,高剂量藏红花素组MDA含量显著降低,SOD、CAT活性显著升高(P<0.05)。见表4。
表4 藏红花素对脑缺血再灌注大鼠脑组织MDA含量和SOD、CAT 活性的影响(±s)Tab.4 Effect of crocin on the content of MDA and the activity of SOD,CAT in the brain tissue of rats with cerebral ischemia reperfusion(±s)
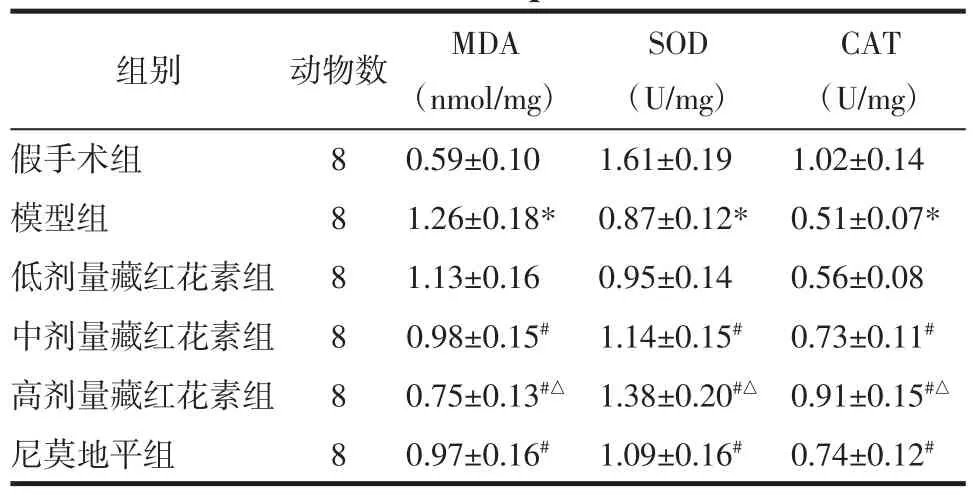
表4 藏红花素对脑缺血再灌注大鼠脑组织MDA含量和SOD、CAT 活性的影响(±s)Tab.4 Effect of crocin on the content of MDA and the activity of SOD,CAT in the brain tissue of rats with cerebral ischemia reperfusion(±s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与尼莫地平组相比,△P<0.05。
CAT(U/mg)假手术组 8 0.59±0.10 1.61±0.19 1.02±0.14模型组 8 1.26±0.18* 0.87±0.12* 0.51±0.07*低剂量藏红花素组 8 1.13±0.16 0.95±0.14 0.56±0.08中剂量藏红花素组 8 0.98±0.15# 1.14±0.15# 0.73±0.11#高剂量藏红花素组 8 0.75±0.13#△ 1.38±0.20#△ 0.91±0.15#△尼莫地平组 8 0.97±0.16# 1.09±0.16# 0.74±0.12#组别 动物数 MDA(nmol/mg)SOD(U/mg)
2.6 藏红花素对脑缺血再灌注大鼠脑组织Occludin、ZO-1、Nrf2、HO-1、胞浆 NF-κB p65、胞核NF-κB p65蛋白表达的影响 与假手术组相比,模型组脑组织 Occludin、ZO-1、Nrf2、HO-1 表达量显著降低,胞浆 NF-κB p65、胞核 NF-κB p65 表达量和胞核NF-κB p65/胞浆NF-κB p65比值均显著升高(P<0.05);与模型组相比,中、高剂量藏红花素组和尼莫地平组 Occludin、ZO-1、Nrf2、HO-1 表达量显著升高,胞浆 NF-κB p65、胞核 NF-κB p65 表达量和胞核NF-κB p65/胞浆NF-κB p65比值均显著降低(P<0.05);与尼莫地平组相比,高剂量藏红花素组 Occludin、ZO-1、Nrf2、HO-1 表达量显著升高,胞浆NF-κB p65、胞核NF-κB p65表达量和胞核NF-κB p65/胞浆 NF-κB p65 比值均显著降低(P<0.05)。见图 3、表 5。
表5 藏红花素对脑缺血再灌注大鼠脑组织Occludin、ZO-1、Nrf2、HO-1、胞浆NF-κB p65、胞核NF-κB p65蛋白表达和胞核 NF-κB p65/胞浆 NF-κB p65 比值的影响(±s)Tab.5 Effect of crocin on the expression of Occludin,ZO-1,Nrf2,HO-1,cytoplasm NF-κB p65,nucleus NF-κB p65 protein and the ratio of nucleus NF-κB p65/cytoplasm NF-κB p65 in brain tissue of rats with cerebral ischemia reperfusion(±s)
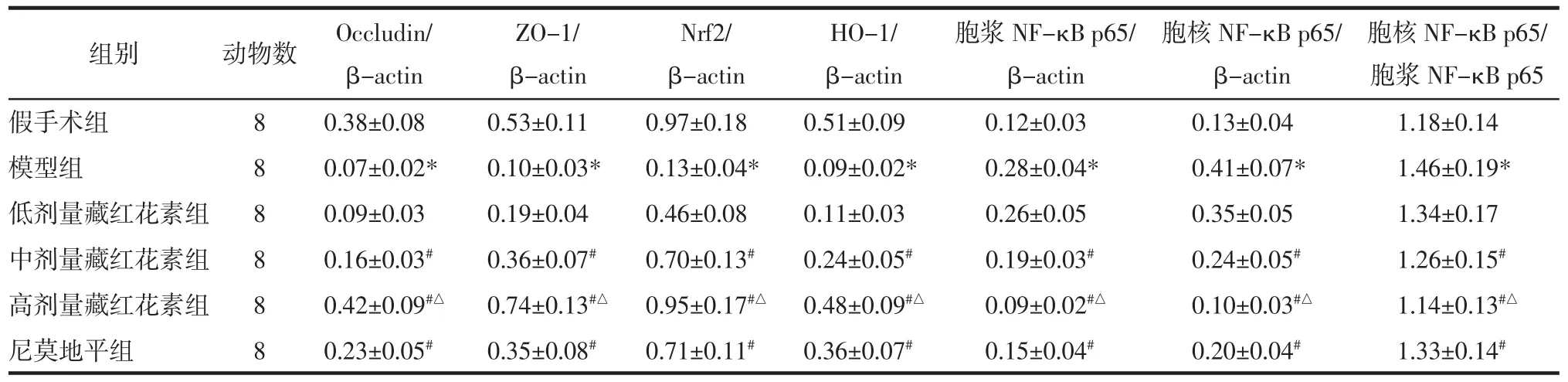
表5 藏红花素对脑缺血再灌注大鼠脑组织Occludin、ZO-1、Nrf2、HO-1、胞浆NF-κB p65、胞核NF-κB p65蛋白表达和胞核 NF-κB p65/胞浆 NF-κB p65 比值的影响(±s)Tab.5 Effect of crocin on the expression of Occludin,ZO-1,Nrf2,HO-1,cytoplasm NF-κB p65,nucleus NF-κB p65 protein and the ratio of nucleus NF-κB p65/cytoplasm NF-κB p65 in brain tissue of rats with cerebral ischemia reperfusion(±s)
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与尼莫地平组相比,△P<0.05。
组别 动物数 Nrf2/β-actin假手术组 8 0.97±0.18模型组 8 0.13±0.04*低剂量藏红花素组 8 0.46±0.08中剂量藏红花素组 8 0.70±0.13#高剂量藏红花素组 8 0.95±0.17#△尼莫地平组 8 0.71±0.11#Occludin/β-actin 0.38±0.08 0.07±0.02*0.09±0.03 0.16±0.03#0.42±0.09#△0.23±0.05#ZO-1/β-actin 0.53±0.11 0.10±0.03*0.19±0.04 0.36±0.07#0.74±0.13#△0.35±0.08#HO-1/β-actin 0.51±0.09 0.09±0.02*0.11±0.03 0.24±0.05#0.48±0.09#△0.36±0.07#胞浆NF-κB p65/β-actin胞核NF-κB p65/胞浆 NF-κB p65 0.12±0.03 0.13±0.04 1.18±0.14 0.28±0.04* 0.41±0.07* 1.46±0.19*0.26±0.05 0.35±0.05 1.34±0.17 0.19±0.03# 0.24±0.05# 1.26±0.15#0.09±0.02#△ 0.10±0.03#△ 1.14±0.13#△0.15±0.04# 0.20±0.04# 1.33±0.14#胞核NF-κB p65/β-actin
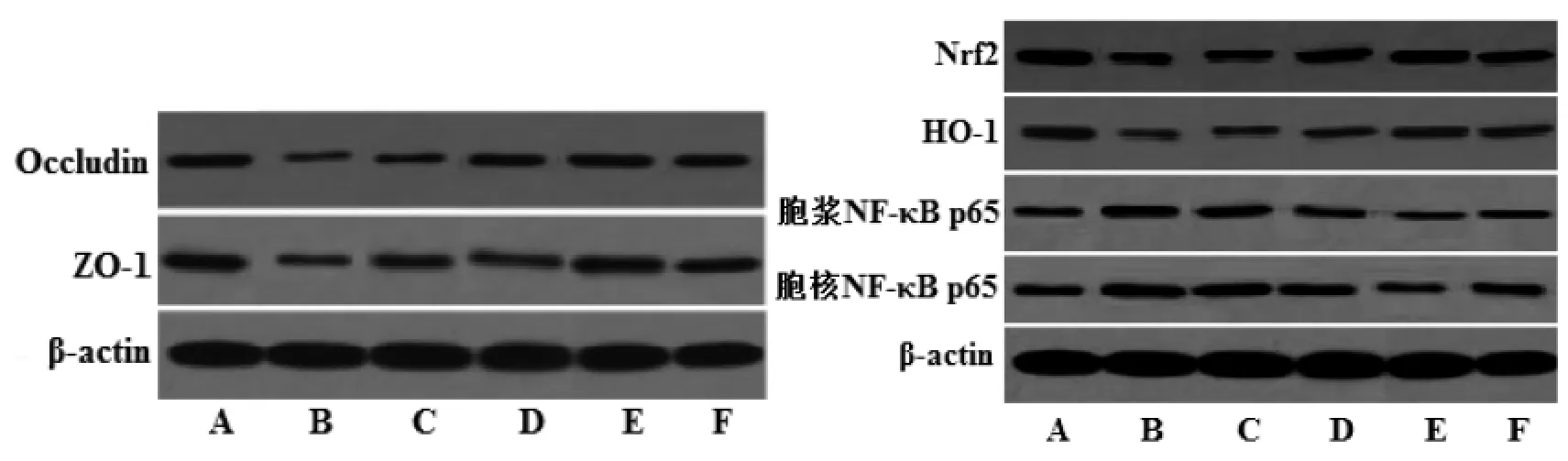
图3 藏红花素对脑缺血再灌注大鼠脑组织Occludin、ZO-1、Nrf2、HO-1、胞浆NF-κB p65、胞核NF-κB p65蛋白表达的影响Fig.3 Effect of crocin on the expression of Occludin,ZO-1,Nrf2,HO-1,cytoplasm NF-κB p65,nucleus NF-κB p65 protein in brain tissue of rats with cerebral ischemia reperfusion
3 讨论
BBB是由脑组织毛细血管内皮细胞、胶质细胞、周细胞以及基底膜、细胞间紧密连接蛋白复合体(TJPs)等构成的一道生理屏障,对维持中枢神经系统内环境稳定具有重要意义[14]。有研究发现,脑缺血再灌注导致BBB受损而引发的血管源性脑水肿,在缺血性脑损伤疾病进展过程中发挥着重要作用,其病理机制与炎症反应、氧化应激等密切相关[15]。
藏红花又名番红花、西红花,《本草纲目》记载其性平、味甘,具有活血化瘀、散郁开结之功效,常用于胸膈痞闷、惊怖恍惚、瘀血腹痛等症的治疗。藏红花素是藏红花的主要活性成分,是中国药典中评价藏红花质量的指标。近代药理学研究发现,藏红花素具有良好的抗炎、抗氧化等多种药理学作用[9]。尼莫地平是临床上常用的一种钙离子拮抗剂类降压药,常用于急性脑血管病的防治,对脑缺血再灌注损伤具有明显改善作用[16]。伊文思蓝是一种偶氮染料,与血浆白蛋白具有高度亲和力,正常状态下伊文思蓝不能透过BBB,但BBB受损后则能够通过BBB进入脑组织,因此脑组织伊文思蓝渗透量能够反映BBB完整性[17]。本研究发现,经藏红花素或尼莫地平干预能够明显改善脑缺血再灌注大鼠神经功能,降低脑梗死率和含水量;抑制神经元数量减少、胞核偏移固缩深染、炎性细胞浸润等病变,降低脑组织伊文思蓝含量,并且高剂量藏红花素组对神经功能、脑梗死率、脑组织病变及伊文思蓝含量的改善作用均优于尼莫地平组,提示藏红花素对大鼠脑缺血再灌注损伤具有保护作用,其机制可能与保护BBB有关。
TJPs是BBB的基础结构,是保证BBB完整性的关键,主要由跨膜蛋白、细胞骨架蛋白、胞质附着蛋白等构成;Occludin是一种小分子跨膜蛋白,能够封闭内皮细胞间隙,Ayer RE等[18]研究发现Occludin缺失将导致TJPs细胞突起减少和TJPs骨架破坏;ZO-1为TJPs重要组成部分,维持细胞极性和胞旁屏障,Branca JJV等[19]研究发现ZO-1缺失将影响TJPs生成,破坏BBB结构,导致BBB通透性升高。脑缺血再灌注后ROS大量产生,以ROS为底物的SOD、CAT等抗氧化酶被过度消耗,导致ROS不能及时清除,过剩的ROS将攻击细胞膜结构、诱导Occludin蛋白降解,从而破坏TJPs结构,导致BBB完整性受损、通透性升高[20]。脑缺血再灌注过程将病理性刺激炎性因子 TNF-α、IL-1β、IFN-γ 释放,其中 TNF-α、IL-1β能够刺激粒细胞进一步释放炎性因子而加重炎症反应[21]。陆正齐[22]研究发现,炎症反应能够诱导Occludin蛋白降解而破坏TJPs结构,诱导内皮细胞黏附分子表达并与内皮细胞黏附,进而增加BBB通透性。本研究发现,经藏红花素或尼莫地平干预能够明显上调脑缺血再灌注大鼠脑组织Occludin、ZO-1 蛋白表达,降低 TNF-α、IL-1β、IFN-γ、MDA含量并提高SOD、CAT活性,并且高剂量藏红花素组上述效应优于尼莫地平组,提示藏红花素对脑缺血再灌注大鼠BBB结构和通透性具有保护作用,其机制可能与抑制氧化应激和炎症反应有关。
Nrf2是细胞内广泛存在的一种抗氧化因子,正常状态下以“Nrf2-Keap1”复合体形式存在而无活性,ROS能够破坏复合体结构并激活Nrf2,活化Nrf2核转位后能够诱导SOD、CAT等抗氧化酶转录表达,从而降低氧化应激损伤;HO-1为Nrf2靶基因,能够诱导血红素以及一氧化氮(NO)等ROS还原而抑制氧化应激和炎症反应[23]。生理状态下,NF-κB以p50/p65二聚体形式存在并与特异性酶抑制剂结合而无生理活性;病理状态下,p50/p65与酶抑制剂解离而被激活,入核后p65亚基与DNA特异性位点结合诱导炎性因子表达与释放,进而介导炎症反应[24]。此外,HO-1能够抑制NF-κB表达与活化,从而间接抑制机体炎症反应[25]。此外,HO-1能够抑制NF-κB表达与活化,从而间接抑制机体炎症反应[26]。近年来,张蕾等[27]发现阿托伐他汀能够激活Nrf2/HO-1通路、降低氧化应激损伤而减轻肠缺血再灌注小鼠肠黏膜损伤。牟俊杰等[28]报道淫羊藿苷减轻大鼠肾缺血再灌注损伤与其介导Nrf2/HO-1通路活化而抑制氧化应激有关。苏凡等[29]发现葡萄籽原花青素抑制脑缺血再灌注损伤与活化Nrf2/HO-1通路进而抑制氧化应激有关;常江等[30]发现甘草查尔酮A抑制脑缺血再灌注损伤与激活Nrf2/HO-1通路而抑制炎症反应有关。本研究发现,经藏红花素或尼莫地平干预能够明显上调Nrf2、HO-1表达并下调胞浆NF-κB p65、胞核NF-κB p65表达,降低胞核NF-κB p65/胞浆NF-κB p65比值,并且高剂量藏红花素组对 Nrf2、HO-1、胞浆 NF-κB p65、胞核 NF-κB p65 表达和胞核 NF-κB p65/胞浆 NF-κB p65比值的调控作用优于尼莫地平组,提示藏红花素对脑缺血再灌注大鼠氧化应激和炎症反应的抑制作用可能与激活Nrf2/HO-1通路及抑制NF-κB p65核转位有关。
综上所述,藏红花素对脑缺血再灌注大鼠BBB结构和通透性具有一定的保护作用,能够减轻脑组织损伤,其机制可能与激活Nrf2/HO-1通路,抑制NF-κB入核,进而抑制氧化应激和炎症反应有关。本研究结果为藏红花素用于防治脑缺血再灌注损伤提供了理论支持。
