苦豆子根、茎、叶浸提液对4种牧草种子萌发的化感作用
2022-08-31石国庆隋晓青崔国盈
石国庆, 隋晓青*, 杨 静, 刘 毅, 崔国盈, 张 博
(1.新疆农业大学草业学院, 西部干旱荒漠区草地资源与生态教育部重点实验室, 新疆草地资源与生态重点实验室,新疆 乌鲁木齐 830052; 2.乌鲁木齐市林业和草原局, 新疆 乌鲁木齐 830000)
竞争在自然界中普遍存在,而化感作用(Allelopathy)就是某些植物在有限的资源和空间中竞争所产生适应性进化的结果[1-2]。化感物质(Allelochemical)通常是活体植物自身产生的某些化学物质,一般由植物的组织或器官合成,该化学物质能够通过地下部根系分泌,地上部雨雾淋溶、挥发或残茬分解茎叶等多种途径释放到自然界,以此促进或抑制其他植物的正常生长发育[3-6],例如舟叶橐吾(Ligulariacymbulifera)地上部和根部的水浸提液抑制白三叶(Trifoliumrepens)、多年生黑麦草(Loliumperenne)、鸭茅(Dactylisglomerata)种子萌发和幼苗生长[7];燕麦(Avenasativa)不同浓度的茎叶、根系浸提液抑制野生垂穗披碱草(Elymusnutans)种子萌发和幼苗生长[8]。我国对于植物化感作用研究起步晚,20世纪80年代有零星报道,从90年代开始,化感研究开始迅速崛起[9]。
苦豆子(Sophoraalopecuroides)为豆科中旱生、多年生草本植物,根茎生长发达,繁殖能力强,体内含有生物碱等化学成分[10-11]。由于我国草地的过度利用,导致天然草地的严重退化,出现了草地毒害草化,苦豆子、醉马芨芨草(Achnatheruminebrians)等毒害草蔓延过度,使得苦豆子在我国西北地区部分草地形成了优势种群[12-13]。从草地畜牧业的角度来看,苦豆子的繁殖入侵造成牧草产量降低,家畜因饥饿被迫采食而引起中毒、腹泻等症状时有发生,这也给草地畜牧业造成一定的经济损失[14-15]。研究表明苦豆子具有一定化感作用[16-18],在经济作物黄瓜(Cucumissativus)、西瓜(Citrulluslanatus)、甜瓜(Cucumismelo)、西葫芦(Cucurbitapepo)、向日葵(Helianthusannuus)等已得到了验证[17,19],但关于苦豆子对牧草种子萌发的化感作用研究还鲜有报道。
种子的发芽是植物生长发育的开始,苦豆子与优良牧草能否共生主要取决于牧草的种子是否能定殖下来。若在幼苗生长发育过程中受到其他植物的抑制或促进作用,将会影响种子萌发或幼苗生长[20]。根据化感物质不同的释放途径,可采用浸提法、水蒸气蒸馏法、培养-吸附法等方法来收集化感物质进行研究[21]。因此,本实验通过模拟自然界的环境下化感物质进到泥土的方式,提取出苦豆子不同部位浸提液对4种优良草种:紫花苜蓿(Medicagosativa)、红豆草(Onobrychisviciifolia)、无芒雀麦(Bromusinermis)和老芒麦(Elymussibiricus)进行牧草种子萌发的化感实验,明确苦豆子不同部位浸提液对牧草种子萌发存在的不同化感作用影响程度,以期为今后草地建植与修复、苦豆子防控及利用提供一定的理论和实践依据。
1 材料与方法
1.1 试验材料
本试验供体植物苦豆子取自新疆农业大学三坪草业综合试验站,受体植物为2种豆科牧草种子和2种禾本科牧草种子:‘新牧4号’紫花苜蓿(MedicagosativaL.‘XinMu No.4’)、红豆草、老芒麦,取自新疆农业大学三坪草业综合试验站,‘乌苏1号’无芒雀麦(Bromusinermis‘Wusu No.1’),取自新疆乌苏市草原站林草局,种子净度均为95%以上。
1.2 苦豆子浸提液的制备
新鲜苦豆子去杂,蒸馏水洗净,存放于阴凉干燥处自然晾干。样品分成根、茎、叶三部分,剪成约1 cm小段粉碎,称取100 g放于烧杯中,加1 000 mL的蒸馏水,室温浸泡48 h,浸提液采用双层纱布过滤取得粗提液后用定性滤纸进行二次过滤,制成0.1 g·mL-1的苦豆子浸提液母液,将母液用蒸馏水分别稀释到0.005 g·mL-1,0.025 g·mL-1,0.045 g·mL-1和0.065 g·mL-1的4个浓度的苦豆子根、茎、叶浸提液,贮存于4℃冰箱备用[18]。
1.3 发芽实验
用培养皿双层滤纸床法,培养皿底部直径120 mm,取健康匀称饱满、灭菌的4种供试种子,根据种子大小每皿50粒或者100粒,分别均匀播种至酒精杀菌的双层滤纸培养皿中,分别滴加0.005 g·mL-1,0.025 g·mL-1,0.045 g·mL-1,0.065 g·mL-1苦豆子根、茎、叶浸提液,对照组加蒸馏水,每个处理4次重复,置于光照培养箱培养。
1.4 指标测定方法
为保证浓度一致,定时更换滤纸并分别注入等量苦豆子根、茎、叶浸提液,对照组加入等量蒸馏水。每日以胚芽突破种皮1~2 mm为标准记录其发芽种子数[22],直至各草种发芽结束,发芽结束后统计各类种子的根长、芽长。各草种发芽周期根据《国家草种子检验规程》(GB/T2930.4-2017)进行实验和记录,其中紫花苜蓿发芽初期为第4 d、发芽终期为第10 d,红豆草发芽初期为第4 d、发芽终期为第14 d,无芒雀麦发芽初期为第7 d、发芽终期为第14 d,老芒麦发芽初期为第5 d、发芽终期为第12 d。根长、芽长的测量方法为随机取出10株幼苗,用游标卡尺测定并记录。
1.5 化感效应评价指标
发芽势(Germination potential,GP):GP(%)=(发芽初期发芽种子粒数∕供试种子总粒数)×100。
发芽率(germination rate,GR):GR(%)=(发芽终期发芽种子粒数∕供试种子总粒数)×100。
发芽指数(Germination index,GI):GI=∑(Gt/Dt);式中,Gt表示在t时间内的发芽数目,Dt为相应的发芽天数。
化感效应指数(Allelopathic response index,RI):RI=1-C/T (T≥C)或RI=T/C-1(T
化感综合效应指数(Synthetic effects of allelopathic index,SE)反应化感效应的强弱,用供体对同一受体发芽率、发芽势、发芽指数等测试项目RI的算术平均值进行评价,SE<0时抑制作用,SE>0时促进作用。SE绝对值大小表示化感效应作用强度。
1.6 数据分析
数据采用SPSS 21.0进行单因素方差分析和Duncan法进行多重比较,Excel 2019进行表格制作。
2 结果与分析
2.1 苦豆子浸提液对4种牧草种子发芽势的影响
苦豆子不同部位、不同浓度的浸提液对4种牧草种子发芽势产生抑制作用,差异显著(P<0.05);其中,红豆草、无芒雀麦、老芒麦的发芽势仅在苦豆子根浸提液0.005 g·mL-1作用下高于CK(表1)。苦豆子根、茎浸提液处理对无芒雀麦和老芒麦的发芽势抑制程度大于紫花苜蓿和红豆草的发芽势,且在0.065 g·mL-1处理时4种草种的发芽势达到最低值。苦豆子叶浸提液处理对紫花苜蓿和老芒麦的发芽势抑制程度大于无芒雀麦和红豆草的发芽势,老芒麦的发芽势在0.025 g·mL-1处理时为最低值,紫花苜蓿的发芽势在0.045 g·mL-1处理时为最低值,无芒雀麦和红豆草的发芽势在0.065 g·mL-1处理时为最低值。紫花苜蓿、红豆草、无芒雀麦和老芒麦的发芽势与CK相比,在苦豆子根浸提液0.065 g·mL-1处理时分别降低了39.68%,34.69%,93.44%和100%;在苦豆子茎浸提液0.065 g·mL-1处理时分别降低了79.89%,77.55%,89.34%和100%;在苦豆子叶浸提液0.065 g·mL-1处理时均为0。

表1 苦豆子根、茎、叶浸提液对4种牧草种子发芽势的影响Table 1 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination potential of four forages
2.2 苦豆子浸提液对4种牧草种子发芽率的影响
随着苦豆子根、茎、叶浸提液浓度的增加,4种牧草种子的发芽率均呈降低趋势(P<0.05)(表2)。苦豆子根、茎浸提液处理对无芒雀麦和老芒麦的发芽率抑制程度总体大于紫花苜蓿和红豆草的发芽率,在0.065 g·mL-1处理时4种草种的发芽率达到最低值。苦豆子叶浸提液处理对紫花苜蓿和老芒麦的发芽率抑制程度大于无芒雀麦和红豆草的发芽率,紫花苜蓿和老芒麦的发芽率在0.045 g·mL-1处理时为最低值,无芒雀麦和红豆草的发芽率在0.065 g·mL-1处理时为最低值。紫花苜蓿、红豆草、无芒雀麦和老芒麦的发芽率与CK相比,在苦豆子根浸提液0.065 g·mL-1处理时分别降低了37.70%,25.99%,79.76%和61.45%;在苦豆子茎浸提液0.065 g·mL-1处理时分别降低了62.30%,76.38%,72.02%和100%;在苦豆子叶浸提液0.065 g·mL-1处理时均为0。苦豆子根、茎、叶浸提液对4种牧草种子的发芽率抑制情况总体表现为叶的抑制强度大于根和茎。
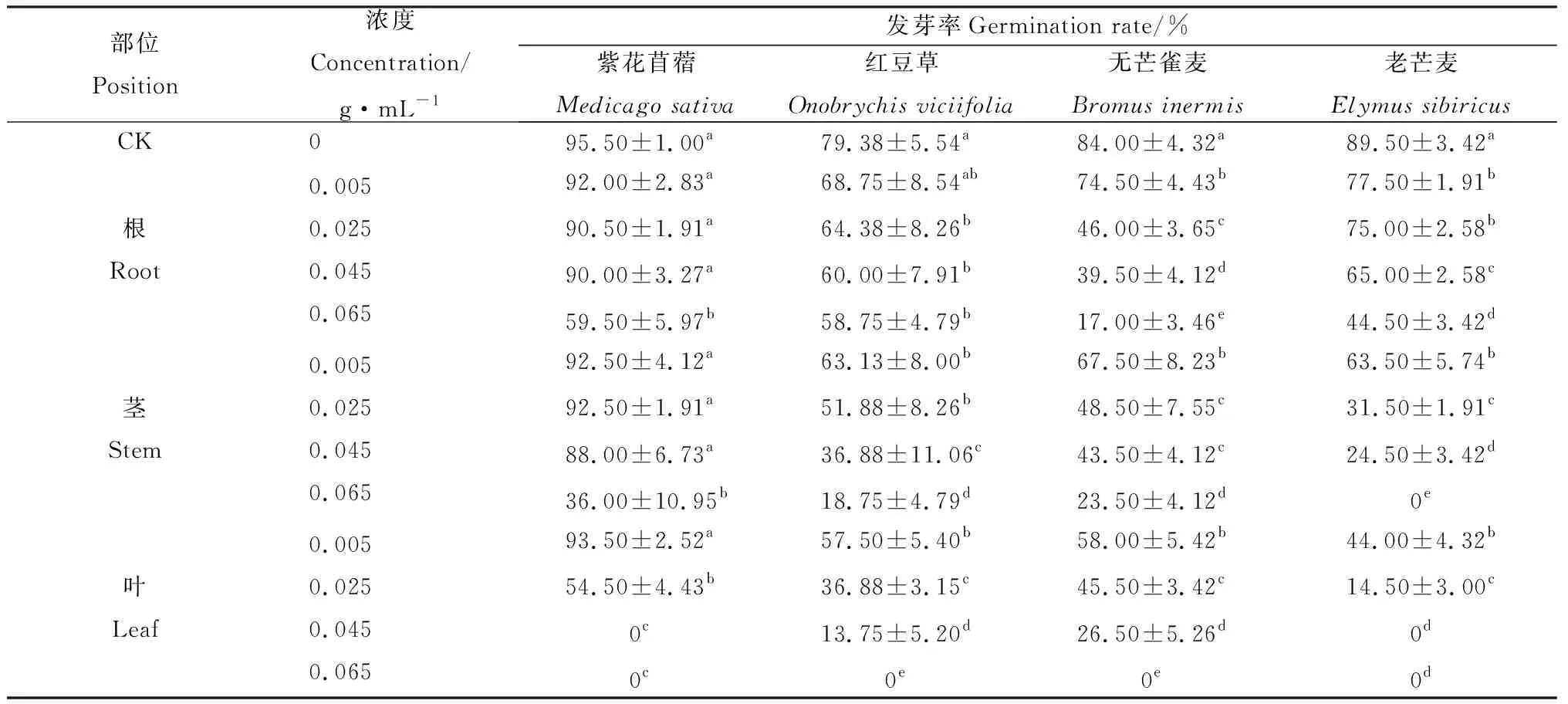
表2 苦豆子根、茎、叶浸提液对4种牧草种子发芽率的影响Table 2 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination rate of four forages
2.3 苦豆子浸提液对4种牧草种子发芽指数的影响
苦豆子不同部位、不同浓度的浸提液对4种牧草种子发芽指数产生抑制作用,具有显著差异(P<0.05)(表3)。苦豆子根、茎浸提液处理对无芒雀麦和老芒麦的发芽指数抑制程度大于紫花苜蓿和红豆草的发芽指数,且在0.065 g·mL-1处理时4种草种的发芽指数达到最低值。苦豆子叶浸提液处理对紫花苜蓿和老芒麦的发芽指数抑制程度大于无芒雀麦和红豆草的发芽指数,紫花苜蓿和老芒麦的发芽指数在0.045 g·mL-1处理时最低,无芒雀麦和红豆草的发芽指数在0.065 g·mL-1处理时最低。紫花苜蓿、红豆草、无芒雀麦和老芒麦的发芽指数与CK相比,在苦豆子根浸提液0.065 g·mL-1处理时分别降低了67.08%,30.19%,88.05%和68.00%;在苦豆子茎浸提液0.065 g·mL-1处理时分别降低了85.79%,75.38%,82.80%和100%;在苦豆子叶浸提液0.065 g·mL-1处理时均为0。
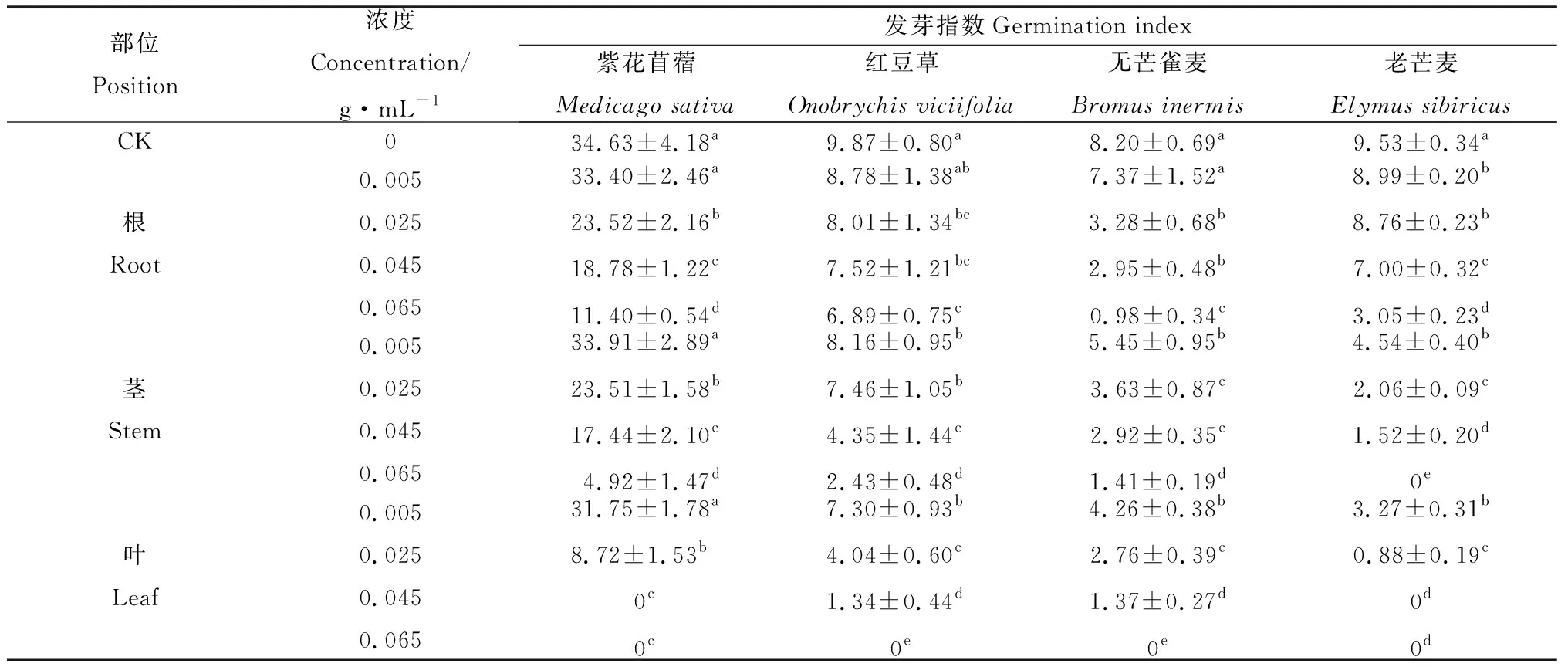
表3 苦豆子根、茎、叶浸提液对4种牧草种子发芽指数的影响Table 3 Effect of extracts from roots,stems and leaves of Sophora alopecuroides on seed germination index of four forages
2.4 苦豆子浸提液对4种牧草种子根长、芽长的影响
随着苦豆子根、茎、叶浸提液浓度的增加,对4种牧草种子的根长、芽长整体表现降低趋势(表4)。紫花苜蓿根长与CK相比,在苦豆子根、茎浸提液大于0.025 g·mL-1、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了52.97%,85.16%;红豆草根长与CK相比,在苦豆子根、茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了62.16%,83.88%;无芒雀麦根长与CK相比,在苦豆子根浸提液大于0.045 g·mL-1,茎浸提液大于0.005 g·mL-1、叶浸提液大于0.025 g·mL-1处理时差异显著(P<0.05),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了28.03%,70.79%;老芒麦根长与CK相比,在苦豆子根浸提液大于0.025 g·mL-1,茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根浸提液0.065 g·mL-1为最低值,降低78.42%。
紫花苜蓿芽长与CK相比,在苦豆子根浸提液大于0.065 g·mL-1,茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05)(表4),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了18.69%,70.33%;红豆草芽长与CK相比,在苦豆子根、茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了67.31%,86.56%;无芒雀麦芽长与CK相比,在苦豆子根浸提液大于0.025 g·mL-1,茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根、茎浸提液0.065 g·mL-1为最低值,分别降低了38.05%,59.79%;老芒麦芽长与CK相比,在苦豆子根浸提液大于0.025 g·mL-1,茎、叶浸提液大于0.005 g·mL-1处理时差异显著(P<0.05),苦豆子根浸提液0.065 g·mL-1为最低值,降低81.69%。老芒麦根长、芽长在茎浸提液0.065 g·mL-1、叶浸提液0.025 g·mL-1时为0。4种牧草种子的根长、芽长在苦豆子叶浸提液0.065 g·mL-1下均为0。苦豆子根、茎浸提液处理对无芒雀麦和老芒麦的根长、芽长抑制程度大于紫花苜蓿和红豆草的根长、芽长。

表4 苦豆子根、茎、叶浸提液对4种牧草种子根长、芽长的影响Table 4 Effects of extracts from roots,stems and leaves of Sophora alopecuroides on seed root length、bud length of four forages
2.5 苦豆子浸提液对4种牧草种子化感效应的影响
由表5可知,在苦豆子根浸提液0.005 g·mL-1下红豆草、无芒雀麦、老芒麦发芽势的化感指数大于0,在苦豆子其余部位浸提液的浓度作用下发芽势、发芽率和发芽指数的化感指数小于0,且化感指数的绝对值随着浸提液浓度升高而增大,表明发芽初期在苦豆子根浸提液0.005 g·mL-1下表现低浓度促进高浓度抑制;苦豆子根、茎、叶浸提液对4种牧草种子的抑制作用也逐渐增强。
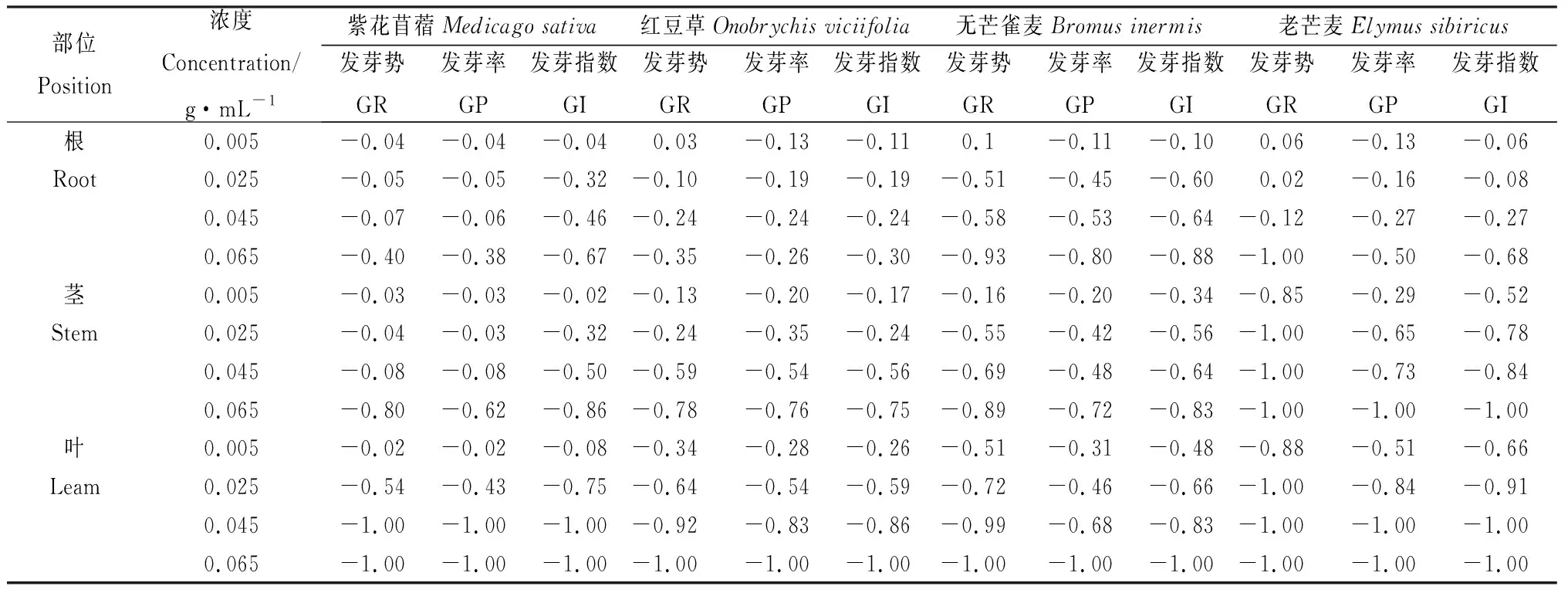
表5 苦豆子根、茎、叶浸提液对4种牧草种子化感效应指数Table 5 Allelopathy index of extracts from roots,stems and leaves of Sophora alopecuroides to four forage seeds
由表6可知,苦豆子根、茎、叶浸提液对4种牧草种子均存在较强的化感抑制作用,随着的苦豆子浸提液浓度增加,其化感抑制效果逐渐加强。4种牧草种子中,无芒雀麦、老芒麦相比红豆草、紫花苜蓿更易受苦豆子浸提液的影响,其中苦豆子根浸提液对4种牧草种子的抑制作用强弱顺序为无芒雀麦>老芒麦>紫花苜蓿>红豆草;苦豆子茎、叶浸提液对4种牧草种子的抑制作用强弱顺序为老芒麦>无芒雀麦>红豆草>紫花苜蓿。通过化感综合效应指数来看,苦豆子化感作用的强弱与作用浓度有关。
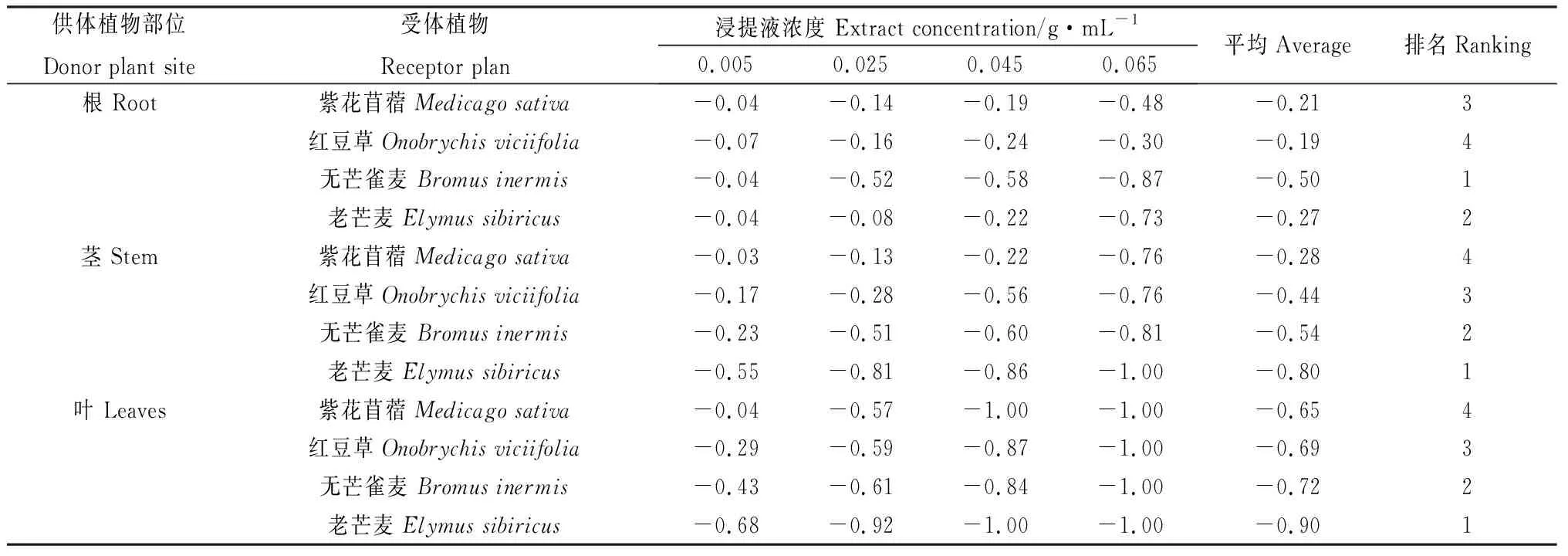
表6 苦豆子根、茎、叶浸提液对4种牧草种子化感综合效应Table 6 Synthetic effects of allelopathic index of extracts from roots, stems and leaves of Sophora alopecuroides on four forage seeds
3 讨论
化感是植物为本物种在竞争中能够更好生存而进化出的适应机制,化感物质能够抑制种子胚生长、影响种子细胞结构及种子萌发过程中的代谢途径、打破种子内源激素平衡等[24-25]。植物化感作用受化感物质种类、浸提液浓度及受试植物种类影响,其存在浓度效应和化感作用不同[26-27]。化感物质几乎都是植物次生代谢物质,其能有效提高植物生存竞争能力[25]。自然界中常见的化感作用的物质有:生物碱类物质、黄酮类物质、类萜、单宁、氨基酸和多肽、苯醌等[28]。其中,苦豆子中存在的生物碱由槐胺碱、苦参碱、异槐果碱、槐果碱、槐定碱等构成[29-30]。
随着苦豆子根、茎、叶浸提液浓度的逐渐增大,紫花苜蓿、红豆草、老芒麦和无芒雀麦的发芽势、发芽率、发芽指数、根长和芽长均出现了不同程度的降低,表明苦豆子浸提液对4种牧草种子萌发呈现明显抑制效果。周立彪等[31]发现不同溶剂的苦豆子浸提物对老瓜头(Cynanchumkomarovii)种子的萌发均具有明显的抑制作用,其萌发率、萌发指数、幼苗活力指数降低;吕笃康等[18]在研究苦豆子种子浸提液对禾本科牧草种苗的生长、发育中发现,随着浓度的增加,化感抑制作用增强,影响作用较为显著,这与本研究结果基本一致。在苦豆子根浸提液0.005 g·mL-1下红豆草、无芒雀麦、老芒麦发芽势的化感指数大于0,表明此浓度下对这3种牧草种子的发芽初期表现出一定的“低浓度促进高浓度抑制”现象,其原因一方面可能是低浓度下的化感物质有限,未能有效抑制这3种牧草种子的生长;另一方面,低浓度处理下,浸提液中的一些营养物质可能对牧草的生长有利,与马银山等[32]研究结果一致。在苦豆子各部位浸提液浓度升高至0.065 g·mL-1浓度时,4种牧草种子萌发均受到了明显抑制;大部分处理组所测指标的化感效应指数小于0。高浓度下苦豆子根部的化感作用要显著低于茎叶部分,这可能是苦豆子所含的生物碱在地上部分含量要远高于根部的含量,所以根部化感作用要小于茎叶部分[33]。化感综合效应表明,苦豆子的浸提液对无芒雀麦、老芒麦的化感抑制效果强于紫花苜蓿和红豆草,原因可能是豆科相比禾本科表面有一层坚硬的外壳,对化感有较好的抗性,也可能是所测的豆科相比所测的禾本科种子内部含有特殊的物质对苦豆子有较好的耐受力,具体原因需做深入细致的研究。4种牧草对苦豆子不同部位,不同浓度浸提液的化感耐受力表现出一定的差异,苦豆子同一部位、相同浓度浸提液对4种牧草化感作用也不同,可能苦豆子的化感作用具有品种间差异性、物种选择性及浓度效应[34]。
化感作用可能是苦豆子的蔓延重要原因之一。苦豆子一方面是以毒害草的“身份”存在,对草地畜牧业的发展产生了一定的影响,可以在放牧地或割草地筛选出对苦豆子抗性强的牧草或者在实际牧草建植时尽量彻底清除苦豆子植株,当地的自然条件、土质都会影响到草地的建植,需要对土壤进行分析研究,以免土壤残留的苦豆子化感物质对植物正常生长产生影响;另一方面,在生态作用中,苦豆子又是天然草地生态群落中的一部分,具有耐干旱、耐盐碱、抗风固沙、适应逆境等特性,一般生长在生态环境较为脆弱或草地严重退化的地方,对于维护生态平衡、防止土地沙漠化、促进退化草地的自我修复等具有重要生态作用,因此,用可持续发展的思路去合理看待这些毒害草。此次,本研究仅限所测4种牧草,实际生产实践中和牧草的幼苗生长及其他牧草对苦豆子化感适应性的情况,仍需进一步研究。
4 结论
不同浓度的苦豆子根、茎、叶浸提液对紫花苜蓿、红豆草、老芒麦和无芒雀麦的种子萌发均存在不同程度的化感作用,且抑制作用随浓度升高而增强;苦豆子浸提液对无芒雀麦和老芒麦种子萌发的抑制作用强于紫花苜蓿和红豆草,其中苦豆子不同部位浸提液浓度升高至0.065 g·mL-1时,4种牧草种子萌发均受到了明显抑制。
