基于SRAP分子标记分析彩色马铃薯品种间遗传关系
2022-08-27金晓蕾周继鸿郭斌煜郭景山韩志刚
谢 锐, 金晓蕾, 周继鸿, 郭斌煜, 郭景山, 韩志刚
(1.内蒙古自治区农牧业科学院, 呼和浩特 010031; 2.河北农业大学, 河北 保定 071000;3.巴林左旗农牧局, 内蒙古 赤峰 025450)
马铃薯(SolanumtuberosumL.)是全球种植最为广泛的块茎类粮食作物之一,因其富含碳水化合物、蛋白质、维生素、矿质元素以及膳食纤维等营养成分,也是人类饮食中膳食热量和一些微量元素的重要来源[1-3]。彩色马铃薯是一种特殊的栽培马铃薯类型,由于富含花青素和类胡萝卜素而使其块茎的薯皮、薯肉呈现出黄、红、粉、紫、黑等颜色,另外块茎中含有多酚、类黄酮和维生素C等多种抗氧化活性物质,具有抗氧化、降三高、美容等保健功能,因此逐渐被消费市场认可[4-5]。近些年,彩色马铃薯新品种选育成为了研究的热点,而彩色马铃薯种质资源遗传背景及多样性等尚不清楚。因此,本研究对彩色马铃薯种质资源间遗传关系进行研究,为选育具有自主知识产权的优质彩色马铃薯新品种奠定基础。
分子标记技术是以DNA多态性为基础检测遗传多样性的方法,不受外界环境、组织部位或生育时期等因素的影响,在种质资源鉴定上比传统生化标记和形态标记更具鉴别力[6]。序列相关扩增多态性(Sequence Related Amplified Polymorphism, SRAP)标记,其目标是检测基因组中开放阅读框(Open Reading Frame, ORF)的多态性,相较于RAPD、AFLP、SSR等技术,SRAP具有操作简便、重复性好、效率高、成本低等特点[7-8]。目前,在彩色马铃薯遗传多样性研究方面所用的分子标记大多为SSR[9-10]和ISSR[11-12],利用SRAP分子标记研究彩色马铃薯遗传多样性的研究并不多。本研究利用SRAP分子标记技术对收集的24个彩色马铃薯种质资源进行遗传多样性分析,以期为内蒙古地区彩色马铃薯种质资源可持续利用提供理论依据。
1 材料与方法
1.1 试验材料
试验采用内蒙古自治区农牧业科学院收集的24份彩色马铃薯品种(系)开展研究。供试材料信息见表1。
1.2 试验方法
1.2.1DNA提取及SRAP引物来源
于苗期采集供试材料幼嫩叶片并用液氮速冻带回实验室,置于-80 ℃冰箱保存。称取0.5 g叶片组织,使用TianGen植物DNA提取试剂盒(DP 305)按操作说明提取样品DNA,用1.8%琼脂糖电泳检测DNA质量及浓度,-20 ℃保存备用。根据Pezzotti等[13]和Lin等[14]的 SRAP引物序列,随机选取正、反向引物各17条,具体信息如表2所示。
1.2.2SRAP-PCR扩增及产物检测
PCR反应体系:共20 μL,包括2 μL模板DNA(50 ng/μL),上、下游引物(10 mmol/L)各1 μL,2×TaqMaster Mix(0.1 U/μLTaqDNA聚合酶,3 mmol/L MgCl2,0.4 mmol/L dNTP,反应缓冲液)16 μL。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性1 min,35 ℃复性1 min,72 ℃延伸1 min,共5个循环;94 ℃变性1 min,52 ℃复性1 min,72 ℃延伸1 min,35 个循环;72 ℃温育10 min后4 ℃保存。
PCR产物检测:采用2%琼脂糖凝胶电泳,上样量为2.0 μL,电泳上槽缓冲液为1×TBE,120 V电压下电泳1.5 h。

表1 彩色马铃薯品种及性状Table 1 Varieties and traits of color potatoes
1.2.3数据分析
利用0/1赋值法将多态性标记转化为二进制数据,即有条带赋值为“1”,无条带赋值为“0”。运用Excel 2016软件整理为“0”“1”数据矩阵;运用PopGen 1.32软件计算遗传多样性指数,包括有效等位基因数(Ne)、Nei’s基因多样性指数(H)和Shannon’s指数(I);运用NTSYS PC 2.02 e软件计算各彩色马铃薯间的遗传相似系数(GS),再利用UPGMA方法进行聚类分析,通过Tree plot模块构建树状图、PCA散点分布图。多态性信息量值PIC(Polymorphism Index Contents)采用Nei’s多样性指数公式获得:
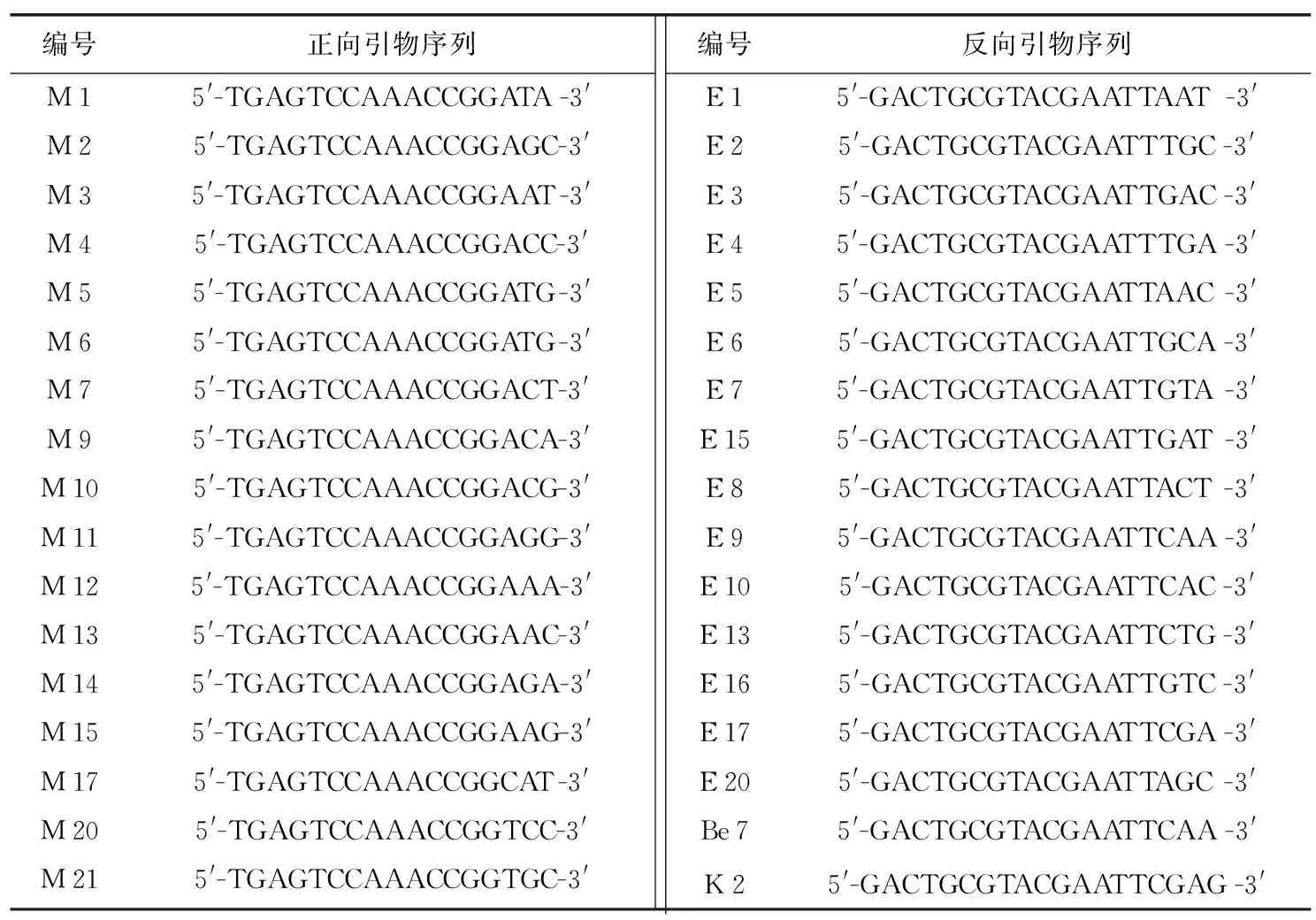
表2 SRAP引物序列Table 2 SARP primer sequences

注:M为DL 2 000;图中数字编号对应品种(系)与表1相同。下同。图1 彩色马铃薯DNA琼脂糖凝胶电泳Fig.1 DNA agarose gel electrophoresis of color potatoes
PICk=1-∑Pi2
2 结果与分析
2.1 DNA质量检测
使用TianGen公司的DNA提取试剂盒提取DNA。结果表明,试剂盒提取的DNA质量好,无降解,品种间DNA提取量均匀(图1),能够满足SRAP扩增对供试材料DNA的要求,经稀释后可用于SRAP分析。
2.2 SRAP引物多态性分析
利用17组SRAP引物(表2)对24份彩色马铃薯的基因组DNA扩增,其中有14对引物可扩增出清晰且重复性好的条带。利用筛选出的14对引物组合对24份彩色马铃薯进行PCR扩增(表3),共获得74个多态性条带,产物大小介于100~500 bp之间。SRAP引物在各种质材料间扩增出多态性条带为2~8条,每条引物平均扩增多态性条带数为5.3条。PIC值的范围在0.62~0.93之间,平均值为0.86,其中PIC值达到0.90的引物有7对,分别为M 3/E 10(0.93)、M 14/Be 7(0.92)、M 2/E 6(0.91)、M 1/E 2(0.9)、M 3/E 9(0.9)、M 11/E 2(0.9)、M 14/E 1(0.9),以上7对SRAP引物在品种间表现出良好的多态性且条带清晰稳定(图2),可用于马铃薯种质间的多样性分析。PIC值在0.84~0.88之间的引物有5对,也表现出较好的多态性;PIC值小于0.8的引物有2对,分别为M 5/E 10(0.77)、M 3/E 1(0.62)(表3)。
在物种水平,供试24个彩色马铃薯种质的有效等位基因数变幅为1.39~1.89,平均值为1.61;Nei’s遗传多样度变幅为0.25~0.47,平均值为0.36;Shannon信息指数介于0.40~0.66之间,平均值为0.54(表3),其中M 3/E 9引物组合在以上3个参数上均表现为最大,说明各种质在M 3/E 9扩增时多态性丰富,同时也表明供试彩色马铃薯种质间存在较丰富的遗传变异。
2.3 聚类分析
利用NTSYS-pc计算24份彩色马铃薯的遗传相似系数(GS),并建立矩阵,结果(表4)表明,24份彩色马铃薯种质的GS介于0.445 9~0.783 8之间,平均值为0.671 7,说明彩色马铃薯种质具有较丰富的遗传多样性且存在一定的遗传差异。其中Sienavodan和C 107相似系数最大(0.783 8),表明两种质间遗传差异较小,亲缘关系最近。而D 613和252遗传相似系数最小(0.445 9),表明两者间遗传差异较大,亲缘关系最远。
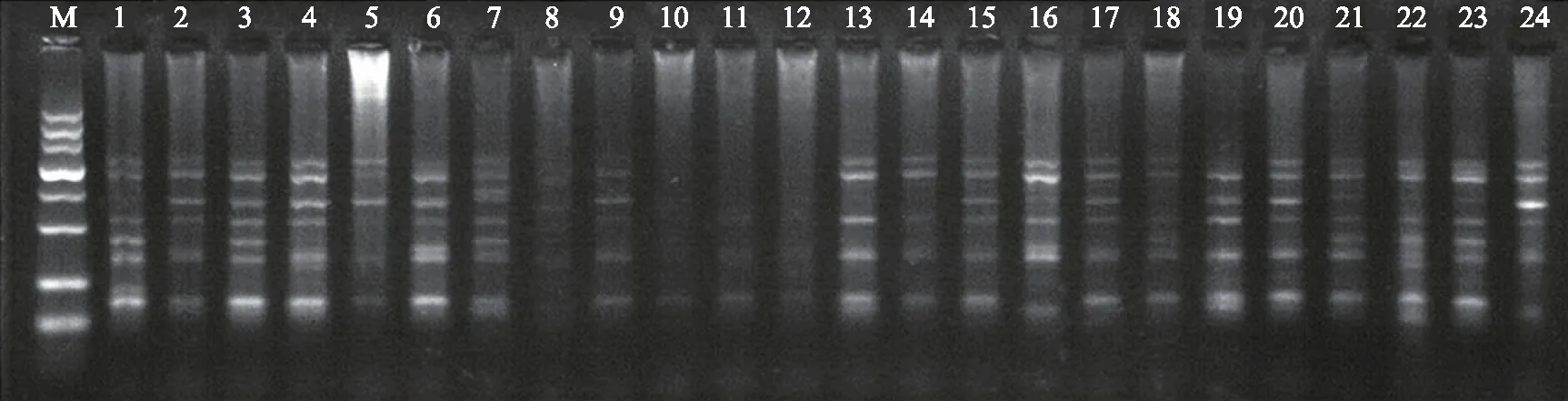
图2 引物组合M 2/E 6对24份彩色马铃薯的基因组DNA扩增结果Fig.2 Genmic DNA amplification results of primer combination M 2/E 6 to 24 color potatoes

图3 彩色马铃薯UPGMA聚类分析Fig.3 UPGMA cluster of color potatoes
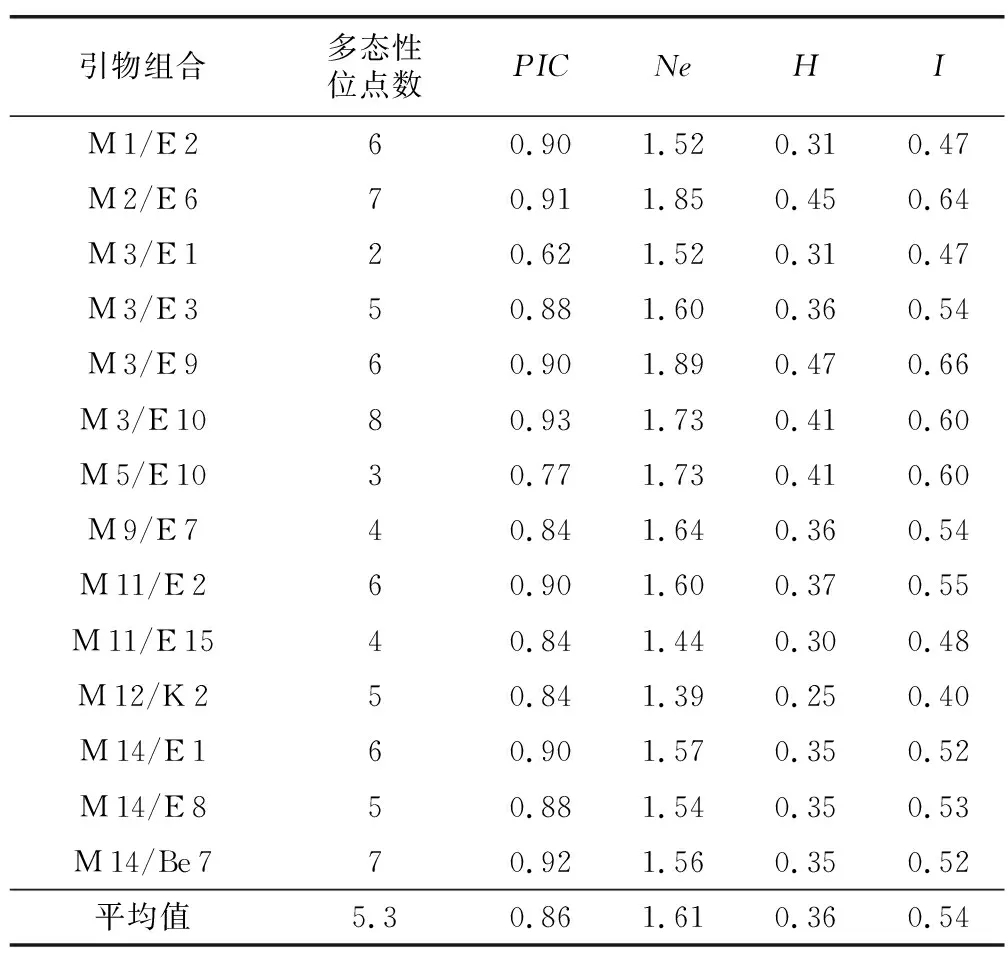
表3 SRAP引物组合多态性扩增结果Table 3 Polymorphic amplification results of SARP primer combinations
利用UPGMA方法对24份彩色马铃薯进行聚类分析,由图3可知,在遗传相似系数为0.61时,可将供试彩色马铃薯种质分为四大类群,第Ⅰ类群包含7份材料,其中5个材料为红皮马铃薯,2个材料为紫皮;第Ⅱ类群包含12份材料,其中红皮黄肉或白肉的有7份,红皮彩肉的有3份,紫皮的有2份;第Ⅲ类群包含2个品种,为黑金刚和黑美人,薯皮薯肉均为深紫色;第Ⅳ类群包含3份材料,均为紫皮紫肉种质。
2.4 主成分分析
利用主成分分析(PCA)通过各种质间位置可直观判断它们的亲缘关系,种质间位置越近表明它们的相似性越高,亲缘关系越近,反之则越远。基于“0”“1”矩阵,利用NTsys软件进行主成分分析,形成24份种质散点平面分布图。前3个解释总遗传变异的主成分贡献率依次为12.91%、9.35%、8.40%,占总遗传变异的30.66%。从图4可知,种质间有交叠现象,说明它们之间亲缘关系较近。

表4 24个彩色马铃薯种质间遗传相似系数Table 4 The genetic similarity coefficients among 24 color potatoes germplasms
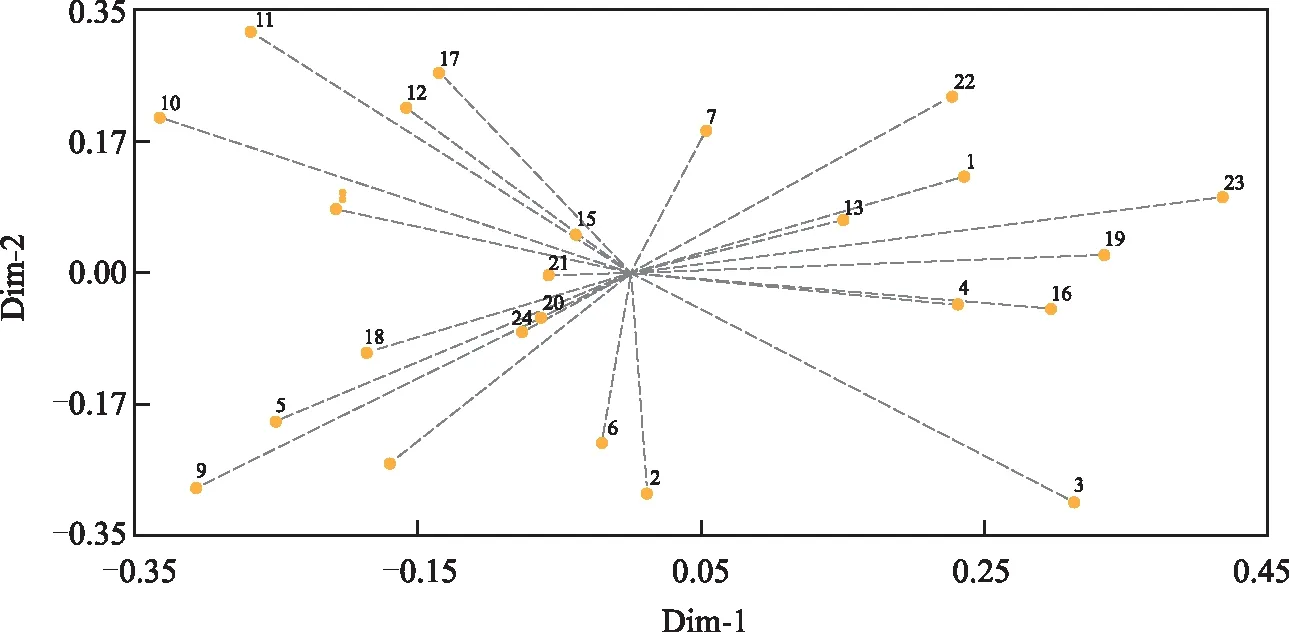
图4 彩色马铃薯主成分分析Fig.4 Principal component analysis of color potatoes
3 讨论与结论
彩色马铃薯是一种特殊的马铃薯,新品种选育虽有所成效,但仍面临资源缺乏、适栽品种较少以及消费市场有限等问题,使彩色马铃薯产业发展受限。另一方面,马铃薯遗传基础狭窄,且收集的种质资源由于退化难以对其进行准确表型鉴定,这在某种程度上限制了彩色马铃薯新品种培育和遗传改良工作的开展。分子标记技术从DNA水平直接反映物种的遗传变异,克服了形态学鉴定的困难以及生长期、环境的影响,且筛选出的特异性标记可作为该品种的分子生物学性状[15-16]。利用分子标记技术对彩色马铃薯种质资源遗传背景和多样性研究对杂交育种工作亲本的选配具有重要指导意义。SRAP标记具有操作简便、重复性好、多态性丰富、成本低等优点[17],在各物种遗传多样性分析、QTL定位、遗传图谱构建、品种鉴定等方面被广泛应用[18-21]。本研究以SRAP分子标记技术探究了24份彩色马铃薯种质间的遗传关系,研究发现,14对引物共扩增出74条多态性条带,平均每对引物可扩增出5.3个多态性条带,表明SRAP标记适合彩色马铃薯遗传多样性分析。另外,供试彩色马铃薯SRAP引物多态性信息量平均值为0.86,高于油梨等[22]的多态性信息量(0.33),而与忻雅等[23]研究的草莓多态性信息量(0.91)相当,说明SRAP-PCR技术适用于不同植物的遗传多样性分析,同时也表明彩色马铃薯在ORFs区具有丰富的遗传多态性。Shannon信息指数(I)和Nei’s基因多样度(H)是评价种质资源遗传多样性丰富度的常用指标[24],在物种水平上,本研究中24份彩色马铃薯H(均值)=0.36,I(均值)=0.54,表明其遗传多样性水平较丰富。
聚类分析与主成分分析是进行种质资源遗传多样性分析的有力工具,另外主成分分析更能直观地反映种质间的亲缘关系,也是对聚类分析的佐证[25],本研究中24份彩色马铃薯资源的遗传相似系数平均值为0.61,说明其亲缘关系相对较远。聚类树状图显示,在遗传相似系数为0.61时可将材料分为四类,其中,第Ⅲ类群只有2份材料,黑金刚和黑美人,薯皮薯肉均为深紫色;第Ⅳ类群包含3份材料,均为紫皮紫肉种质,表明这两个类群各材料间遗传背景差异较小。第Ⅰ类群、第Ⅱ类群皮色肉色都不尽相同,但其遗传背景较为相似,造成这种现象的主要原因可能是控制色素合成的基因差异较大。进一步采用主成分分析,结果与聚类分析结果并不完全一致,这可能是与两种分析方法的计算原理不同有关,另外,Ⅲ、Ⅳ类群间有重叠现象,说明其亲缘关系较近,这可能与杂交育种时亲本较为单一有关,因此,在常规杂交育种亲本选配时,应把育种目标和亲本间遗传差异共同考虑。
