钛酸钡/硅酸钙复合生物活性压电陶瓷的制备及性能研究
2022-08-25魏子钦夏翔李勤李国荣常江
魏子钦, 夏翔, 李勤, 李国荣, 常江
钛酸钡/硅酸钙复合生物活性压电陶瓷的制备及性能研究
魏子钦1,2, 夏翔2, 李勤2, 李国荣2, 常江1,2
(1. 上海师范大学 化学与材料科学学院, 上海 200234; 2. 中国科学院 上海硅酸盐研究所, 高性能陶瓷与超微结构国家重点实验室, 上海 200050)
压电材料产生的电信号能够促进成骨细胞增殖分化, 但不具有良好的诱导矿化能力; 生物活性材料在生理环境下能够诱导类骨羟基磷灰石的沉积, 但又不能产生电信号促进成骨。因此, 开发出一种既能产生电信号, 又能诱导矿化沉积的复合生物活性压电材料, 具有重要意义。本研究以钛酸钡为压电组分, 以硅酸钙为生物活性组分, 采用固相烧结法制备了钛酸钡/硅酸钙复合生物活性压电陶瓷, 测试了压电性能, 并用体外矿化实验评价了诱导矿化能力。硅酸钙复合含量达到30%时, 复合陶瓷仍具有一定的压电性能(33=4 pC·N–1), 并且能够在模拟体液中诱导磷酸钙沉积。钛酸钡与硅酸钙的复合能够同时具有压电性和生物活性, 为骨修复材料提供了新的选择。
钛酸钡; 硅酸钙; 压电性; 生物活性
骨缺损是临床上常见的创伤问题, 少量骨缺损可以自行生长愈合, 而大段骨缺损往往需要植入人工骨替代材料[1-3]。在骨修复过程中, 细胞的增殖分化有着至关重要的作用, 能够促进成骨细胞增殖分化的材料对骨修复有着明显的促进作用[4]。
研究发现, 天然骨骼, 由于骨胶原蛋白的中心不对称性, 存在压电信号, 能促进成骨细胞的增殖分化对新骨的生成有着良好的促进作用[5-7]。已有研究[8-11]表明, 钛酸钡是一类生物相容性良好的压电材料, 其产生的压电信号可以促进成骨细胞的增殖分化, 已被用于骨修复领域的研究。
骨骼再生是一个复杂的过程, 不仅需要有成骨细胞的增殖分化, 还需要磷酸钙的矿化沉积, 为细胞的迁移黏附等活动提供支持, 从而逐渐形成具有特定结构和功能的骨骼[3,12-13]。钛酸钡的矿化能力较差, 限制了其在骨修复领域的实际应用。硅酸钙是一种生物活性良好的生物陶瓷材料, 植入体内后能够释放出活性的Ca2+、SiO32–离子, 诱导矿化, 在材料表面沉积类骨羟基磷灰石, 促进新骨生成, 在骨修复领域具有良好的应用潜力[14-18]。
因此, 本研究设计将硅酸钙与钛酸钡复合, 既可保持钛酸钡压电性能又同时赋予材料诱导矿化的生物活性, 从而提升其骨修复能力。目前尚未见钛酸钡等压电材料兼具直接促进矿化作用的研究报道。基于此, 本研究采用传统的固相烧结技术, 制备了钛酸钡/硅酸钙复合生物活性压电陶瓷, 并探究了其压电性和体外诱导矿化的能力。
1 实验方法
1.1 实验材料
实验所用原料为钛酸钡粉体(BT, 粒径4 μm, 纯度为99.9%, 上海阿拉丁生化科技股份有限公司), 硅酸钙(CS, 纯度>98%, 昆山华侨科技新材料有限公司), 聚乙烯醇(PVA, 1799型, 醇解度: 98%~99% (摩尔分数), 上海阿拉丁生化科技股份有限公司)。
1.2 复合陶瓷的制备
本课题采用固相烧结法合成了不同摩尔比例的BT/CS复合陶瓷, 分别为BT、BT : CS=9 : 1(以下记为0.9BT0.1CS)、BT : CS=8 : 2(以下记为0.8BT0.2CS)、BT : CS=7 : 3(以下记为0.7BT0.3CS)、BT : CS= 6 : 4(以下记为0.6BT0.4CS)、CS, 图1为简要合成工艺流程。首先, 按照表1所示配比分别称取BT粉末、CS粉末于玛瑙研钵中, 加入4%质量分数的PVA溶液, 充分研磨后, 过孔径200 µm (80目)筛; 然后在10 MPa的压力下压制成直径为13 mm、高为1 mm的生坯片, 之后马弗炉中进行两段升温烧结: 以1 ℃/min的升温速率升温至550 ℃, 保温4 h, 进行排胶处理, 随后再以3 ℃/min升温至相应烧结温度, 保温4 h, 待自然冷却至室温。根据预实验确定不同组分的烧结温度, BT、0.9BT0.1CS、0.8BT0.2CS、0.7BT0.3CS、0.6BT0.4CS和CS的烧结温度分别为1300、1200、1125、1110、1100和1150 ℃。
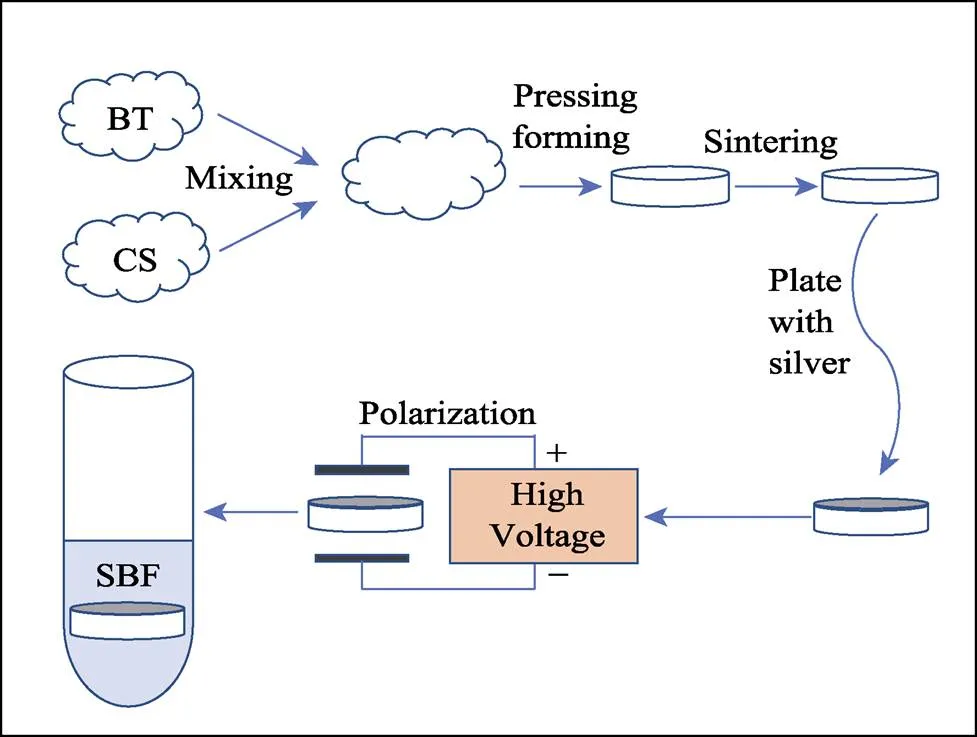
图1 工艺流程示意图
1.3 复合陶瓷的极化
压电陶瓷烧成以后, 需要在高压直流电场下极化处理, 以激发其压电性。将制得的复合陶瓷表面打磨光滑, 控制厚度为1 mm。清洗烘干后, 在其上下表面刷一层厚薄均匀的导电银浆, 以2 ℃/min升温至720 ℃, 保温10 min, 然后自然冷却至室温。镀银电极后的陶瓷在硅油中以3 kV/mm的电场强度极化30 min后取出, 使用乙醇超声清洗掉表面的硅油。
1.4 压电性能表征
电滞回线和压电常数是压电陶瓷常用的表征参数。复合陶瓷镀银后, 先使用德国aixACCT TF2000铁电综合测试系统测试其电滞回线, 以初步判断其压电性能, 随后在3 kV/mm的高压电场下对其极化, 并采用中国科学院声学研究所生产的ZJ-4AN型准静态33测量仪测试其压电常数33, 以表征材料最终的压电性能。

表1 复合陶瓷的原料组成
1.5 体外矿化实验
对复合陶瓷进行体外模拟矿化实验以验证复合陶瓷的生物活性。将极化后的陶瓷表面银电极层磨去并清洗干净、烘干。按Kokubo等[19]报道配置SBF溶液, 将烘干后的复合陶瓷置于离心管中, 按照公式(1)的比例加入SBF溶液,
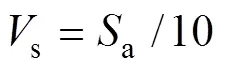
其中,S为SBF的体积(mL),a为陶瓷的表面积(mm2)。之后将离心管置于37 ℃恒温摇床中, 每48 h更换液体, 取浸泡14 d的样品, 经超声水洗和醇洗, 然后烘干备用。
1.6 生物相容性表征
本实验选用人体成纤维细胞(Human diploid fibroblast, HDF)验证材料的细胞相容性, 具体操作步骤如下:
1)将BT和0.7BT0.3CS陶瓷粉体用细胞培养液配制成200 mg·mL–1标准浸提液, 随后过滤菌膜并梯度稀释至所需浓度。
2)用不同浓度的细胞浸提液在37 ℃、二氧化碳(CO2)浓度5%的细胞培养箱培养HDF。培养24 h后, 用Cell Counting Kit-8检测HDF细胞活性。
细胞实验重复三次且各组数据均经过检验,<0.05和<0.01时, 将两组数据分别看作有显著差异和极显著差异。
1.7 XRD、SEM、EDS表征
采用18 kW转靶X射线衍射仪(XRD)对烧结的陶瓷样品进行物相表征, 采用场发射扫描电子显微镜(SEM)SU8220观察浸泡SBF前后样品的微观形貌, 并对表面进行能谱(EDS)表征, 以分析其元素组成和比例。
2 结果与讨论
2.1 复合陶瓷的物相分析
复合陶瓷的XRD图谱如图2(a)所示, 不同组分的陶瓷的衍射峰主要对应于四方相BaTiO3(PDF#79- 2264)和CaSiO3(PDF#89-6463), 峰形的变化基本与组分含量变化保持一致, 当BT含量较多、CS含量较少时, XRD主要显示了BT的峰, 随着CS含量逐渐提升, CS的峰逐渐增多。未发现明显的第三相, 表明在陶瓷的烧结过程中, BT与CS并未发生反应。各组分的峰形均较为尖锐, 表明在实验选取的烧结温度下, 陶瓷的结晶度良好。
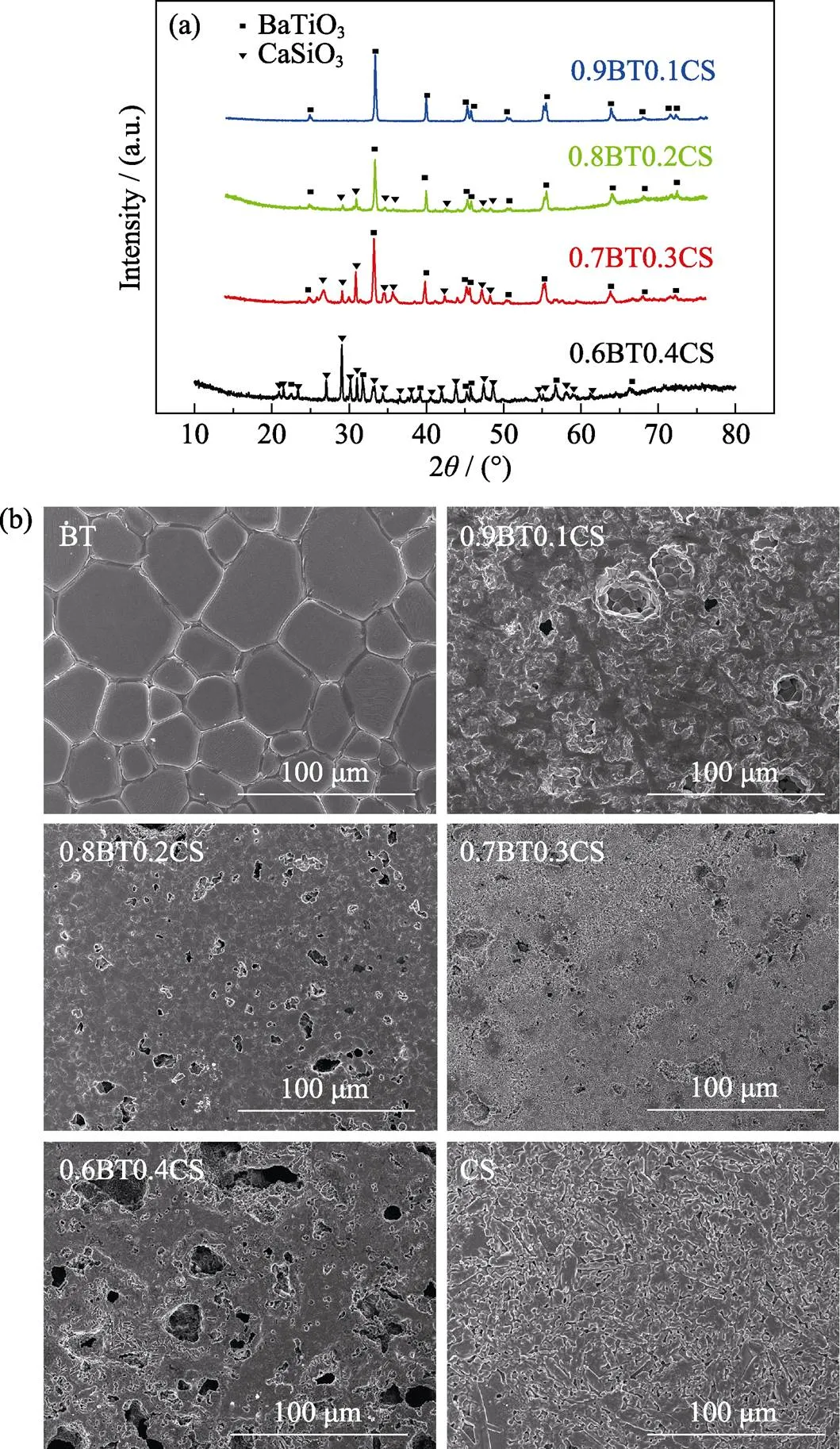
图2 复合陶瓷的XRD图谱(a)及其SEM照片(b)
不同组分陶瓷的SEM照片如图2(b)所示, BT是致密的陶瓷, 随着CS复合含量的增加, 复合陶瓷的致密程度明显下降, 这可能是由BT与CS两者烧结收缩率的差异而导致的。此外, 由于不同组分烧结温度不同, BT陶瓷的烧结温度最高, 使得BT陶瓷的晶粒明显大于其他组分。陶瓷的压电性能受烧结温度、晶粒大小、致密度等多种因素的影响[20], 再加上复合比例不同, 在这几种因素的共同作用下, 不同组分的复合陶瓷的压电性能表现出较大的差异(表2)。
2.2 复合陶瓷压电性能表征
图3展示了复合陶瓷的压电性能表征结果。如图3(a)所示, 纯BT的-曲线显现出明显的弛豫铁电体特征, 而图3(f)所示的CS的-曲线不具有铁电体的特征。在BT中掺入少量CS后, 复合陶瓷仍然具有铁电特性(图3(b~d))。不过随着CS含量逐渐增大, 复合陶瓷的铁电性逐渐减弱, 当CS复合含量达到40%时几乎完全消失(图3(e))。从图3(g)可以看到各组分的铁电性随CS掺杂含量增大而呈明显降低的趋势。

表2 复合陶瓷的压电常数d33

图3 复合陶瓷的压电性能表征
(a) BT; (b) 0.9BT0.1CS; (c) 0.8BT0.2CS; (d) 0.7BT0.3CS; (e) 0.6BT0.4CS; (f) CS; (g) Variation trend of hysteresis loop; (h) Piezoelectric constant Colorful figures are available on website
图3(h)和表2展示了复合陶瓷的压电常数33测试结果。纯BT的33为169 pC·N–1, 显示出较强的压电性能。CS的33为0, 表明其完全不具有压电性。当掺入10%的CS以后, 复合陶瓷的33迅速下降至44 pC·N–1, 随着CS含量进一步增大, 复合陶瓷的33显著下降, 当CS含量达到40%时, 复合陶瓷的33仅为1 pC·N–1。这是因为引入CS以后, 其均匀分散在复合陶瓷中, 降低了BT相的连续性, 进而使得在外力作用下因形变而产生的电荷聚集到陶瓷的表面能力下降, 最终表现为压电性能下降[21-22]。此外, 实验测试了矿化后的陶瓷的压电常数33, 发现不同组分复合陶瓷的压电性能均有一定程度的下降, 但CS复合比例≤30%的复合陶瓷的压电常数(表2)仍然大于骨骼的压电常数(0.2 pC·N–1)[23], 因此可以认为矿化后的复合陶瓷仍具备足够的压电性能。
根据Baxter等[11,24]的研究结果来看, 在与非压电材料复合的过程中, BT含量低于70%的复合陶瓷将不再具有压电性能, 这与本实验压电测试的实验结果一致, 而少量复合非压电陶瓷组分仍有可能保留陶瓷材料的压电性能, 虽然压电性会明显下降。考虑到生物应用对于压电性能的要求明显低于常规应用, 这种复合仍然具有骨生理学意义[25]。除了复合陶瓷需要保留一定的压电特性之外, 加入的CS能否赋予复合陶瓷生物活性, 是其是否具应用价值的另一个关键。因此, 为了证实制得的复合材料不仅具有压电性, 还具有诱导矿化的生物活性, 本实验对具有压电性的复合陶瓷0.9BT0.1CS、0.8BT0.2CS、0.7BT0.3CS进行了矿化实验, 探究其在模拟体液中诱导沉积羟基磷灰石的能力。
2.3 体外矿化结果分析
图4为复合陶瓷在SBF中浸泡前后的SEM照片和EDS扫描结果。从图4(a~h)可以看出, 浸泡SBF14 d以后, BT、0.9BT0.1CS和0.8BT0.2CS的表面并没有明显的矿化产物, 而0.7BT0.3CS的表面有一层蠕虫状沉积物。随后对矿化后的陶瓷表面进行元素分析, 结果如图4(i~l)与表3所示, BT的表面完全没有Ca和P, 而0.9BT0.1CS和0.8BT0.2CS的表面仅有微量的P元素, 但Ca元素相对较多, 使得Ca/P的比值较大。从表3可以看出, 0.8BT0.2CS表面的Ca含量约为0.9BT0.1CS的2倍, 这与陶瓷本身的Ca含量差值几乎保持一致, 这说明此处Ca的主要来源为陶瓷本身, 并不是由矿化沉积产生。而0.7BT0.3CS矿化后表面的主要元素为Ca和P, 其Ca/P为1.27, 这与文献[26]报道的硅酸钙陶瓷在SBF中浸泡诱导早期钙磷沉积的钙磷比相近。这个结果说明, 在BT中CS的掺入量达到30%的情况下, 复合陶瓷不仅具有一定压电性能, 而且具有一定的诱导矿化沉积磷酸钙的生物活性。
2.4 生物相容性
本实验对BT和复合后矿化效果最好的0.7BT0.3CS进行了细胞相容性实验, 结果如图5所示。与对照组相比, BT对HDF的生长几乎没有影响。而0.7BT0.3CS浸提液在稀释倍数为1/16时对HDF的生长有着显著的促进作用。由此可知, BT具有良好的细胞相容性, 与CS复合后表现出一定的生物活性。
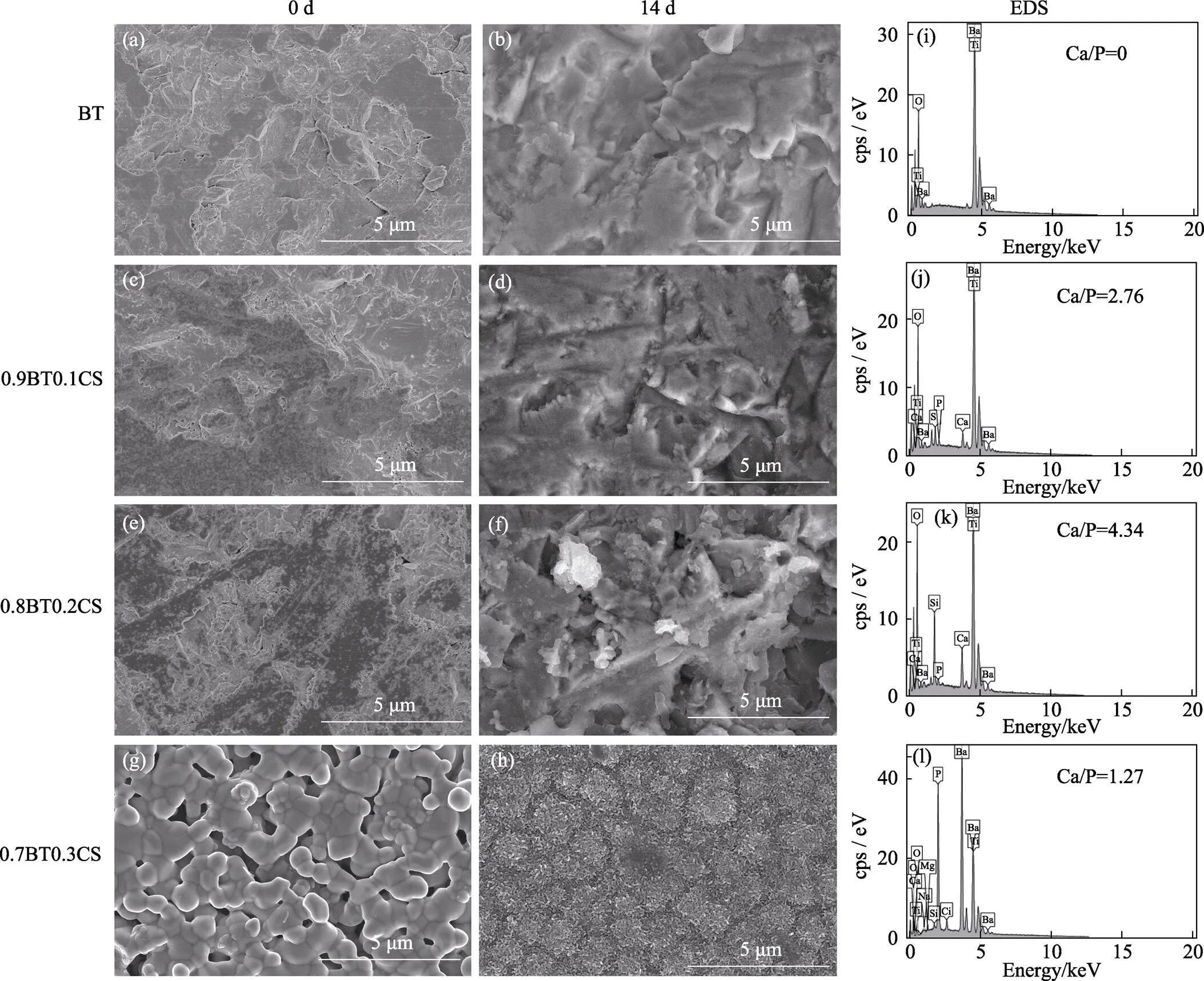
图4 体外矿化表征
(a-h) SEM images of different ceramics soaked in SBF for 0 and 14 d; (i-h) EDS spectra of different ceramics soaked in SBF for 14 d SBF: Simulated body fluid
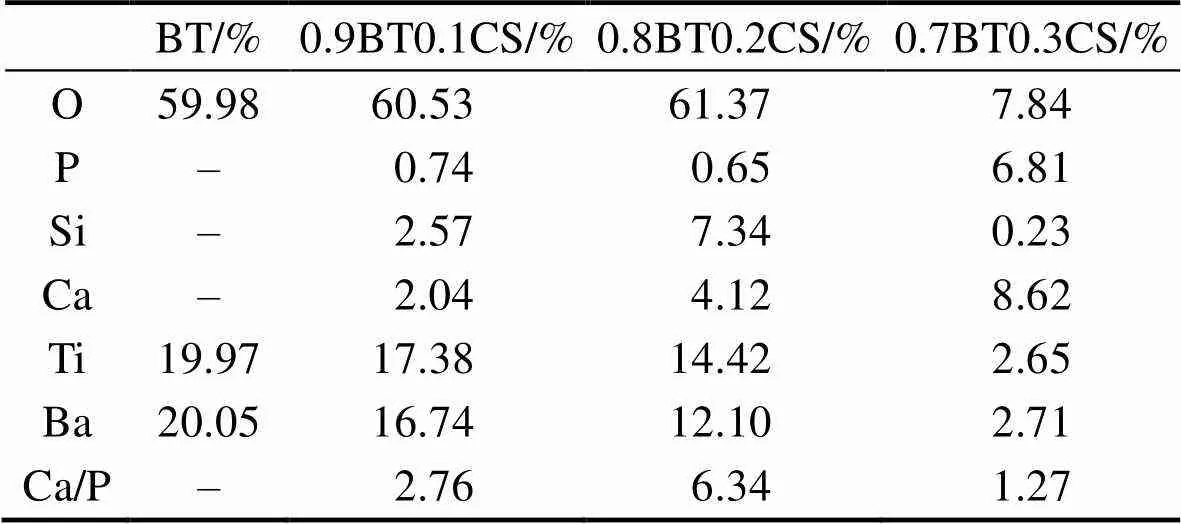
表3 样品矿化14 d后的表面元素组成
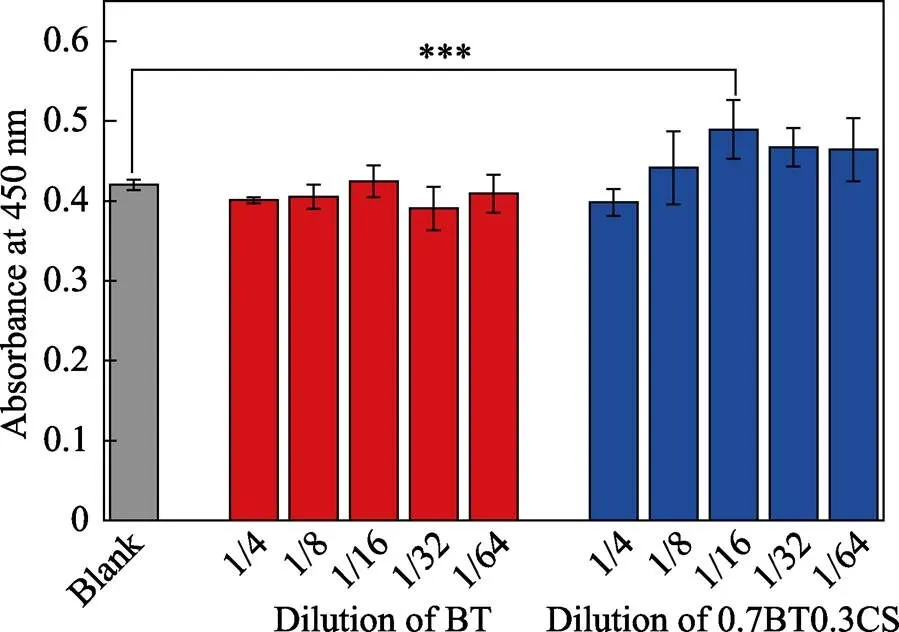
图5 不同稀释度的BT和0.7BT0.3CS浸提液对HDF细胞活力影响
*** indicates<0.01
3 结论
本研究采用固相烧结法制备了不同比例的钛酸钡/硅酸钙复合陶瓷, 通过对其压电性和体外生物活性的研究可获以下结论:
1)在不同的复合比例下, 随着硅酸钙含量增大, 复合陶瓷的压电性能逐渐下降, 但在硅酸钙复合含量30%、钛酸钡含量70%时仍保留一定的压电性。
2)相比于完全不具有诱导矿化沉积的钛酸钡材料, 复合30%CS的复合陶瓷(0.7BT0.3CS)有一定的体外诱导矿化并且促进HDF细胞增殖的生物活性。
综上可知, 在生物惰性的钛酸钡压电陶瓷材料中引入生物活性的硅酸钙材料, 当复合比例处于一定范围内, 材料可以兼具压电性和诱导矿化的生物活性。因此, 钛酸钡/硅酸钙生物压电复合材料具有一定的骨修复应用潜力, 但其实际应用效果还需进一步的生物学实验验证。
[1] ANTALYA H, JOHANNA B, RUSTOM L E,. Bone regeneration strategies: engineered scaffolds, bioactive molecules and stem cells current stage and future perspectives., 2018, 180: 143–162.
[2] LOBB D C, DEGEORGE B R, CHHABRA A B. Bone graft substitutes: current concepts and future expectations., 2019, 44(6): 497–505.
[3] MAAZOUZ Y, CHIZZOLA G, DOBELIN N,. Cell-free, quantitative mineralization measurements as a proxy to identify osteoinductive bone graft substitutes., 2021, 275: 120912.
[4] HENCH L L, POLAK J M. Third-generation biomedical materials., 2002, 295(5557): 1014–1017.
[5] FUKADA E, YASUDA I. On the piezoelectric effect of bone., 1957, 12(10): 1158–1162.
[6] BASSETT C A L, BECKER R O. Generation of electric potentials by bone in response to mechanical stress., 1962, 137(3535): 1063–1064.
[7] FUKADA E, YASUDA I. Piezoelectric effects in collagen., 1964, 3(8): 117–121.
[8] PARK J B, RECUM A F V, KENNER G H,. Piezoelectric ceramic implants-a feasibility study., 1980, 14(3): 269–277.
[9] ATTILIO M, JONATHAN B, GIUSEPPE D V,. Two-photon lithography of 3D nanocomposite piezoelectric scaffolds for cell stimulation., 2015, 7(46): 25574–25579.
[10] BUSUIOC C, OLARET E, STANCU I C,. Electrospun fibre webs templated synthesis of mineral scaffolds based on calcium phosphates and barium titanate., 2020, 10: 772.
[11] KHARE D, BASU B, DUBEY A K. Electrical stimulation and piezoelectric biomaterials for bone tissue engineering applications., 2020, 258: 120280–1–25.
[12] WEINER S, ADDADI L. Crystallization pathways in biomineralization., 2011, 41: 21–40.
[13] REZNIKOV N, STEELE J A M, FRATZL P,A materials science vision of extracellular matrix mineralization.,2016, 1(8): 16041.
[14] WU C T, CHANG J. Silicate bioceramics for bone tissue regeneration., 2013, 28(1): 29–39.
[15] LIN K L, CHANG J, WANG Z. Fabrication and the characterisation of the bioactivity and degradability of macroporous calcium silicate bioceramics., 2005, 20(3): 692–698.
[16] LIU X Y, DING C X, WANG Z Y. Apatite formed on the surface of plasma-sprayed wollastonite coating immersed in simulated body fluid., 2001, 22(14): 2007–2012.
[17] WANG X, ZHOU Y, XIA L,. Fabrication of nano-structured calcium silicate coatings with enhanced stability, bioactivity and osteogenic and angiogenic activity.,2015, 126: 358–366.
[18] WANG S G, XU Y C, ZHOU J,.degradation and surface bioactivity of iron-matrix composites containing silicate- based bioceramic., 2017, 2(1): 10–18.
[19] KOKUBO T, TAKADAMA H. How useful is SBF in predictingbone bioactivity?, 2006, 27(15): 2907–2915.
[20] LI H T, ZHANG B P, WEN J B,. Influences of sintering temperature on structure and properties of Cu-doped lead-free LNKN ceramics., 2011, 42(S5): 931–934.
[21] ZHANG S, YU F, GREEN D J. Piezoelectric materials for high temperature sensors., 2011, 94(10): 3153–3170.
[22] TANG Y, WU C, WU Z,. Fabrication andbiological properties of piezoelectric bioceramics for bone regeneration., 2017, 7: 43360.
[23] KIM D, HAN S A, KIM J H,. Biomolecular piezoelectric materials: from amino acids to living tissues., 2020, 32(14): 1906989.
[24] BAXTER F R, TURNER I G, BOWEN C R,. The structure and properties of electroceramics for bone graft substitution., 2008, 361(22): 99–102.
[25] MAEDA H, TSUDA K, FUKADA E. Dependence on temperature and hydration of piezoelectric, dielectric and elastic-constants of bone., 1976, 15(12): 2333–2336.
[26] SALAHINEJAD E, BAGHJEGHAZ M J. Structure, biomineralization and biodegradation of Ca-Mg oxyfluorosilicates synthesized by inorganic salt coprecipitation., 2017, 43(13): 10299–10306.
Preparation and Properties of Barium Titanate/Calcium Silicate Composite Bioactive Piezoelectric Ceramics
WEI Ziqin1,2, XIA Xiang2, LI Qin2, LI Guorong2, CHANG Jiang1,2
(1. College of Chemistry and Materials Science, Shanghai Normal University, Shanghai 200234, China; 2. State Key Laboratory of High Performance Ceramics and Superfine Microstructure, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
Electrical signals generated by piezoelectric materials can promote proliferation and differentiation of osteoblasts, but they can’t induce mineralization, while bioactive materials can induce the deposition of bone like hydroxyapatite in physiological environment, but can not generate electrical signal to promote osteogenesis. Therefore, it is of great significance to develop a composite bioactive piezoelectric material that can not only generate electrical signals, but also induce mineralization and deposition. Here, we used barium titanate as piezoelectric component and calcium silicate as bioactive component to prepare barium titanate/calcium silicate composite as bioactive/piezoelectric ceramics by solid-state sintering method. Piezoelectric properties of the ceramics were tested, and the ability of inducing mineralization was evaluated bymineralization experiment. The experimental results show that when the content of calcium silicate reaches 30%, the composite ceramics still have certain piezoelectric property (33=4 pC·N–1), and can induce the deposition of calcium phosphate in simulated body fluid. Therefore, the combination of barium titanate and calcium silicate can synchronously afford piezoelectric and biological activities, which provides a new choice for bone repair materials.
barium titanate; calcium silicate; piezoelectricity; bioactivity
1000-324X(2022)06-0617-06
10.15541/jim20210549
TQ174
A
2021-08-28;
2021-10-12;
2021-11-12
国家重点研发计划(2016YFC1100201)
National Key Research and Development Plan of China (2016YFC1100201)
魏子钦(1996–), 男, 硕士研究生. E-mail: 1149057072@qq.com
WEI Ziqin (1996–), male, Master candidate. E-mail: 1149057072@qq.com
常江, 研究员. E-mail: jchang@mail.sic.ac.cn
CHANG Jiang, professor. E-mail: jchang@mail.sic.ac.cn
