大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析
2022-08-23聂靖茹严达伟刘金桥董新星
聂靖茹,马 黎,严达伟,邓 俊,张 浩,张 博,刘金桥,董新星
(1.云南农业大学动物科学技术学院,昆明 650201;2.中国农业大学动物科学技术学院,北京 100193;3.云南农业职业技术学院畜牧兽医学院,昆明 650212;4.云南省畜牧总站,昆明 650224)
肌内脂肪(intramuscular fat,IMF)含量是肉质评定的首选指标,影响猪肉的风味、嫩度和多汁性[1],筛选调控猪肌内脂肪沉积的功能基因并解析其调控机制,对猪肉品质的遗传改良具有重要意义。随着高通量测序技术的发展,一些影响猪脂肪沉积的功能基因和转录调控因子被发现。李明洲等[2]研究发现,太湖猪在不同月龄脂肪细胞体积、肌内脂肪含量均高于长白猪,且在3月龄后差距逐渐明显;Wood等[3]研究发现,维生素D受体(vitamin D receptor,VDR)通过抑制CCAAT/增强子结合蛋白α(CCAAT/enhancer binding proteins alpha,C/EBPα)和过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor gamma,PPARγ)抑制脂肪生成;Tang等[4]研究发现,转录因子Sp1基因是前脂肪细胞向脂肪细胞分化所必需的关键基因;Huang等[5]研究发现,XLOC_046142、XLOC_004398和XLOC_015408可能分别以丝裂原激活蛋白激酶激活蛋白激酶2(MAPK-activated protein kinase 2,MAPK-APK2)、核受体亚家族1D组成员2(nuclear receptor subfamily 1 group D member 2,NR1D2)和醛酮还原酶家族1成员C4(aldo-keto reductase family 1 member C4,AKR1C4)为靶点,在猪肌内脂肪生成和脂质积累中起重要调节作用;Xing等[6]研究发现了脂质运载蛋白2(lipocalin 2,LCN2)、磷酸烯醇式丙酮酸羧激酶1(phosphoenolpyruvate carboxykinase 1,PCK1)、过氧化物酶体增殖激活受体γ辅激活因子1β(peroxisome proliferative activated receptor,gamma,coactivator 1 beta,PPARGC1B)、腺苷一磷酸脱氨酶1(adenosine monophosphate deaminase 1,AMPD1)和线粒体肌酸激酶2(creatine kinase,mitochondrial 2,CKMT2)5个影响脂肪沉积的候选基因;Ana等[7]研究发现,Retinto伊比利亚猪脂肪酸结合蛋白3(fatty acid binding protein 3, FABP3)、FABP5、长链脂肪酸转运蛋白1(solute carrier family 27 member 1,SLC27A1)等基因上调能够加速脂肪沉积,Torbiscal伊比利亚猪脂联素(adiponectin,C1Q and collagen domain containing,ADIPOQ)和肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)基因上调会抑制脂肪沉积。迪庆藏猪是中国特有的高原型猪种之一,具有沉脂能力强、肉质好等特点[8],目前关于迪庆藏猪的研究主要在起源与驯化[9]、遗传多样性[10-12]、低氧适应[13]、肉质[14-16]、杂交利用[17]等方面,迪庆藏猪肌内脂肪沉积遗传调控机制尚不明晰。本研究采用RNA-Seq技术筛选大型迪庆藏猪不同生长阶段肌内脂肪沉积差异的关键基因并分析其调控途径,以期为大型迪庆藏猪肉品质的遗传改良提供参考。
1 材料与方法
1.1 试验动物
选择胎次相同、出生日期及体重相近的纯种大型迪庆藏猪36头,随机分为3组,每组12头,在云南省香格里拉市绿源生态种养专业合作社藏猪养殖基地进行育肥试验,分别在体重达40、80、120 kg左右时屠宰,每组采集3头猪的背最长肌(S1-3LD、S2-3LD、S3-3LD),液氮速冻运回实验室,-80 ℃保存备用。
1.2 主要试剂及仪器
动物组织总RNA提取试剂盒、反转录-荧光定量试剂盒均购自天根生化科技(北京)有限公司。NanoDrop 2000核酸浓度测定仪购自ThermoFisher Scientific公司;荧光定量PCR仪(FQD-96A)购自杭州博日科技股份有限公司。
1.3 方法
1.3.1 RNA提取和质量检测 参考王志秀[18]采用TRIzol法结合动物组织总RNA提取试剂盒提取背最长肌总RNA,去除rRNA。利用1.0%琼脂糖凝胶电泳检测所提取总RNA的质量,以确定RNA是否存在降解及污染等情况;利用NanoDrop 2000测定仪对总RNA的纯度(D260 nm/D280 nm)进行测定,利用Qubit对总RNA进行精确定量,利用Agilent 2100核酸分析仪检测RNA的完整性,检测合格的总RNA用于转录组测序。
1.3.2 去核糖体链特异性文库构建及测序 从9个检测合格的样本RNA中各取3 μg建库,对测序文库进行质检,文库浓度要求不低于1 ng/μL,电泳观察构建的文库条带大小在350~450 bp;按照cBot User Guide(Part#15006165,Rev.F,Illumina)流程,在Illumina Hiseq 2000测序仪配套的cBot上完成Cluster的生成和第一向测序引物杂交;按照Hiseq 2000 User Guide(Part#15011190_H,Illumina)要求备好测序试剂,将携有cluster的flow cell上机,按程序进行Paired End 2×100 nt Multiplex测序,并进行数据的收集和实时数据分析。将mRNA进行Oligo(dT)磁珠富集,反转录合成cDNA文库。使用NlaⅢ内切酶产生标签5′-端,该内切酶可识别并切断cDNA上的CATG位点,利用磁珠纯化带有cDNA 3′-端片段,将其5′-端连接到Illumina接头1上;Illumina接头1与CATG位点的结合处是MmeⅠ内切酶的识别位点,该内切酶可将识别位点与酶切位点分离,酶切位置在CATG位点下游17 bp处,从而产生带有接头1的Tag;采用聚丙烯酰胺凝胶电泳进行纯化,利用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-time PCR System对构建好的文库进行质检,质检合格的文库用Illumina Hiseq 2000上机测序。
1.3.3 测序数据处理及差异表达基因聚类分析 对测序获得的原始数据(raw reads),去除污染和低质量片段后获得过滤后的有效数据(clean reads),采用HISAT2软件将clean reads与猪的参考基因组(Susscrofa11.1)进行比对,对比对到基因组各染色体上的clean reads进行统计,以log2|FoldChange|>1且P<0.05作为筛选条件,将片段每百万碱基碎片数(fragments per kilobase million,FPKM)值归一化进行差异表达基因分析。将3个生长阶段分为3个比较组(S1vsS2:40 kgvs80 kg;S2vsS3:80 kgvs120 kg;S1vsS3:40 kgvs120 kg),对每个比较组的阳性共表达基因聚类分析。
1.3.4 差异表达基因功能富集分析 对筛选出的差异表达基因进行GO功能和KEGG通路富集分析,筛选与迪庆藏猪脂肪沉积相关的差异表达基因,按富集度count≥2且校正P<0.05作为显著富集基因的阈值。
1.3.5 差异表达基因STEM分析 采用短时间序列表达分析(short time-series expression miner,STEM)对差异表达基因进行趋势分析,数据过滤标准为3个时间节点两两比较的组内表达差异倍数在2倍以上且P<0.05,对显著差异表达的模块进行GO功能和KEGG通路富集分析。
1.3.6 差异表达基因互作网络分析 利用Cytoscape 3.9.1软件挖掘差异表达基因间的互作关系,构建差异表达基因的互作网络。
1.3.7 实时荧光定量PCR 用Primer Premier 5.0软件设计实时荧光定量PCR引物(表1),利用反转录试剂盒将RNA反转录为cDNA,以GAPDH作为内参基因,采用ABI HT7900定量PCR仪对筛选到的差异表达基因进行实时荧光定量PCR检测。PCR扩增体系20 μL:2×T5 Fast qPCR Mix(SYBR Green Ⅰ) 10 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板1 μL,ddH2O 7.4 μL。PCR扩增条件:95 ℃预变性1 min;95 ℃变性15 s,退火15 s(退火温度见表1),72 ℃延伸30 s,共40个循环;循环结束后开始熔解曲线分析:95 ℃ 5 s,60 ℃ 1 min,温度以0.11 ℃/s的速率从60 ℃递增到95 ℃。每个样本设3个重复,根据2-ΔΔCt值计算定量结果。

表1 引物信息
2 结 果
2.1 大型迪庆藏猪背最长肌RNA提取质量及测序数据统计
用1.0%琼脂糖凝胶电泳检测总RNA质量,样品总RNA的28S和18S条带清晰,28S的亮度约为18S的2倍,质量达到RNA-Seq上机测序的要求。由表2可知,每个样品的raw reads数都在48 Mb以上,clean reads比例均超过88%,有效Q30比例均在94%以上,比对率均在95%以上,测序数据符合生物信息学分析要求。

表2 RNA-Seq测序数据统计
2.2 大型迪庆藏猪背最长肌差异表达基因聚类分析
对3个比较组的阳性共表达基因进行聚类发现,每个组内部聚为一类,组间明显分开(图1),可进行后续分析。
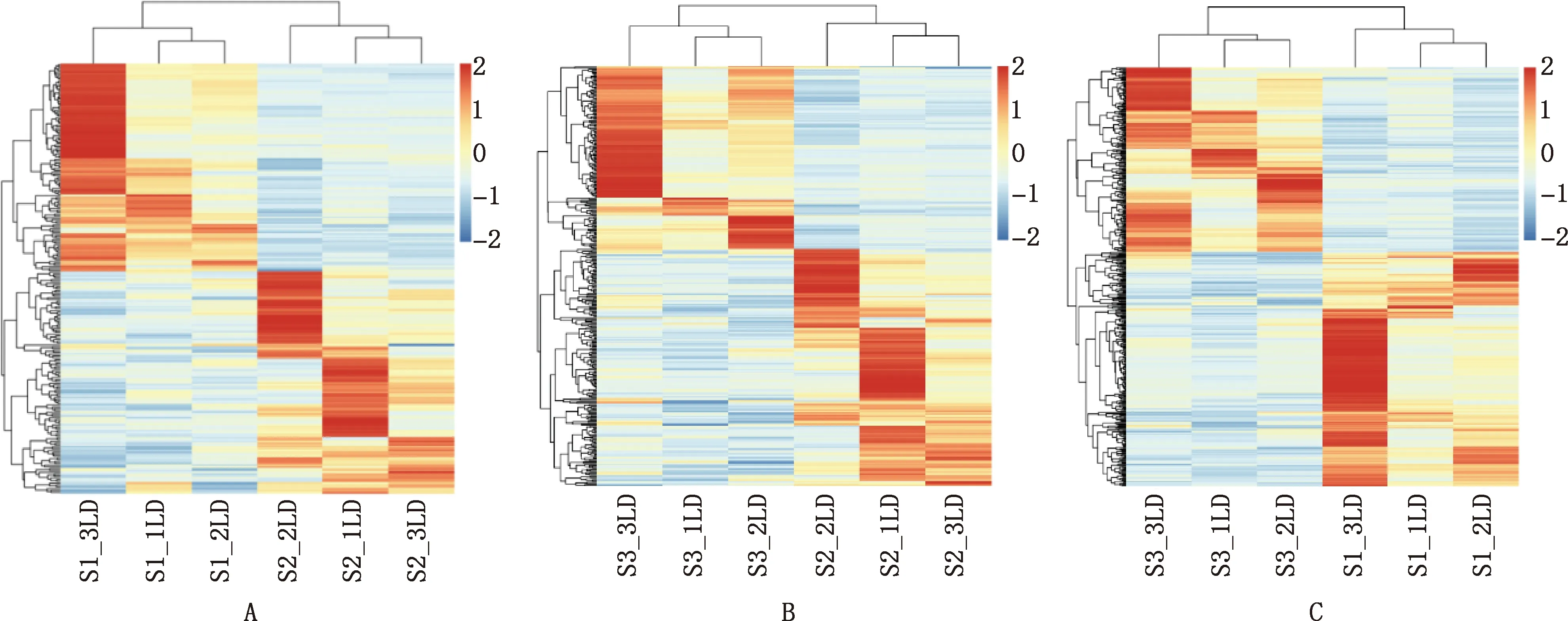
A,S1 vs S2;B,S2 vs S3;C,S1 vs S3。图2同A,S1 vs S2;B,S2 vs S3;C,S1 vs S3.The same as fig.2图1 大型迪庆藏猪背最长肌差异表达基因聚类热图Fig.1 Clustering heat map of differentially expressed genes in longissimus dorsi muscle of large Diqing Tibetan pigs
2.3 不同体重阶段大型迪庆藏猪背最长肌显著差异基因筛选
以log2|FoldChange|>1且P<0.05为筛选显著差异基因的阈值,S1vsS2阶段共筛选到730 个基因显著差异表达,其中,上调基因341个,下调基因389个(图2A);S2vsS3阶段共筛选到981个基因显著差异表达,其中,530个基因上调,451个基因下调(图2B);S1vsS3阶段共筛选到735个基因显著差异表达,其中,364个基因上调,371个基因下调(图2C)。
2.4 不同体重阶段大型迪庆藏猪背最长肌显著差异表达基因功能富集分析
S1vsS2阶段,GO功能分析结果显示,差异表达基因主要富集在凋亡过程调控、胰岛素应答、脂肪细胞分化等过程(图3A);KEGG通路分析结果显示,差异表达基因主要富集在FOXO信号通路、脂肪细胞因子信号通路、胰岛素抵抗等通路(图3B)。S2vsS3阶段,GO功能分析结果显示,差异表达基因主要富集在葡萄糖稳态、脂肪垫发育、脂肪酸氧化正调控等过程(图3C);KEGG通路分析结果显示,差异表达基因主要富集在胰岛素信号通路、PPAR信号通路、脂肪细胞因子信号通路等(图3D)。S1vsS3阶段,GO功能富集分析显示,差异表达基因主要富集在葡萄糖应答、脂肪细胞分化、能量稳态等过程(图3E);KEGG通路富集分析显示,差异表达基因主要富集在胰岛素信号通路、胰岛素抵抗信号通路等(图3F)。

图2 大型迪庆藏猪背最长肌差异表达基因火山图Fig.2 Volcanic map of differentially expressed genes in longissimus dorsi muscle of large Diqing Tibetan pigs

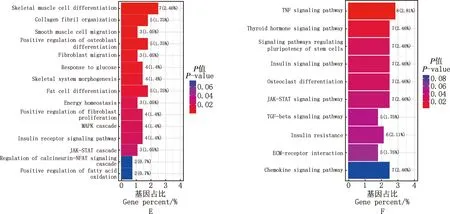
A、C、E,S1 vs S2、S2 vs S3和S1 vs S3 GO功能富集图;B、D、F,S1 vs S2、S2 vs S3和S1 vs S3 KEGG通路富集图A,C and E,GO function enrichment histograms of S1 vs S2,S2 vs S3 and S1 vs S3,respectively;B,D and F,KEGG pathway enrichment histograms of S1 vs S2,S2 vs S3 and S1 vs S3,respectively图3 大型迪庆藏猪背最长肌差异表达基因GO功能和KEGG通路富集分析图Fig.3 GO function and KEGG pathway enrichment histograms of differentially expressed genes in longissimus dorsi muscle of large Diqing Tibetan pigs
2.5 大型迪庆藏猪背最长肌差异表达基因STEM分析
对筛选到的显著差异表达基因进行STEM分析,共有4个差异显著模块(图4),模块11和14的差异表达基因聚为一类,先表达上调后呈现轻微表达下调;模块9和10的差异表达基因聚为一类,先表达上调后表达下调;其余模块差异不显著。模块11和14的基因集GO功能分析显示,差异表达基因主要富集到BMP信号通路的负调控、JUN激酶活性激活等过程(图5A),KEGG通路分析显示,差异表达基因主要富集到PI3K-Akt信号通路、ECM受体相互作用等通路(图5B);模块9和10基因集GO功能主要富集到细胞对脂多糖反应、T细胞凋亡过程的正调控(图5C),KEGG通路主要富集到Ⅱ型糖尿病、T细胞受体信号通路等通路(图5D)。
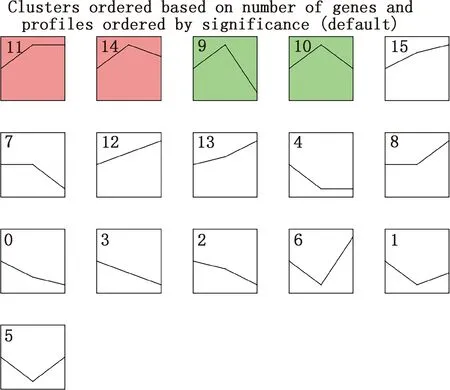
颜色背景表示趋势显著(P<0.05),相同颜色表示模块内所包含的基因表达趋势相似;白色背景模块表示趋势不显著(P>0.05)The trend of color background is significant (P<0.05),the same color indicates that the gene expression trend contained in the module is similar;The trend of white background module is not significant (P>0.05)图4 大型迪庆藏猪背最长肌STEM分析Fig.4 STEM analysis of longissimus dorsi muscle in large Diqing Tibetan pigs

A、B,模块11、14的GO功能和KEGG通路富集图;C、D,模块9及10的GO功能和KEGG通路富集图A and B,GO function and KEGG pathway enrichment histograms of module 11 and 14,respectively;C and D,GO function and KEGG pathway enrichment histograms of module 9 and 10,respectively图5 大型迪庆藏猪背最长肌差异表达基因显著富集模块GO功能和KEGG通路富集分析图Fig.5 GO function and KEGG pathway enrichment histograms of differentially expressed genes of significant enrichment modules in longissimus dorsi muscle of large Diqing Tibetan pigs
2.6 不同体重阶段大型迪庆藏猪背最长肌差异表达基因互作网络
2.6.1 S1vsS2 选择S1vsS2阶段显著富集通路中的基因绘制网络图,结果见图6。由图6可知,转录激活因子3(activating transcription factor 3,ATF3)、核受体亚家族4A组成员3(nuclear receptor subfamily 4 group A member 3,NR4A3/NOR-1)、AMP激活蛋白激酶γ2调节亚单位(protein kinase AMP-activated non-catalytic subunit gamma 2,PRKAG2)、早期生长应答因子1(early growth response 1,EGR1)、早期生长应答因子2(early growth response 2,EGR2)基因位于网络核心,其中ATF3、NOR-1、PRKAG2基因表达上调,ATF3基因与脂联素表达有关,NOR-1和PRKAG2基因会影响胰岛素敏感性;EGR1、EGR2基因表达下调,这2个基因与脂质代谢、脂肪生成有关。

图6 S1 vs S2阶段差异表达基因互作网络Fig.6 Interaction network diagram of differentially expressed genes at S1 vs S2 stage
2.6.2 S2vsS3 选择S2vsS3阶段显著富集通路中的基因绘制网络图,结果见图7。由图7可知,过氧化物酶体增殖物激活受体δ(peroxisome proliferator activated receptor delta,PPARD)、丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase 4,PDK4)、叉头盒O1(forkhead box O1,FOXO1)、过氧化物酶体增殖激活受体γ辅激活因子1α(peroxisome proliferative activated receptor,gamma,coactivator 1 alpha,PPARGC1A/PPARGC-1)、ATF3、信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1)、脂肪酶E(lipase E,LIPE)基因位于网络中心,其中,LIPE、ATF3基因表达上调,LIPE基因参与抗脂分解、脂质稳态等过程,ATF3基因可调控脂联素表达;PPARD、PDK4、FOXO1、PPARGC-1、STAT1基因表达下调,PPARD基因在脂肪代谢中发挥作用,PDK4和FOXO1基因可相互作用影响葡萄糖摄取及游离脂肪酸含量,PPARGC-1基因在脂肪储存中起调控作用,STAT1基因可在脂肪细胞分化过程中起作用。
2.6.3 S1vsS3 选择S1vsS3阶段显著富集通路中的基因绘制基因网络图,结果见图8。由图8可知,ATF3、NOR-1、EGR1、EGR2、STAT1基因位于网络中心,其中,ATF3、NOR-1基因表达上调,ATF3基因可调控脂联素表达,NOR-1基因影响胰岛素敏感性;EGR1、EGR2、STAT1基因表达下调,EGR1、EGR2基因影响脂质代谢,STAT1基因与脂肪细胞分化有关。

图7 S2 vs S3阶段差异表达基因互作网络Fig.7 Interaction network diagram of differentially expressed genes at S2 vs S3 stage
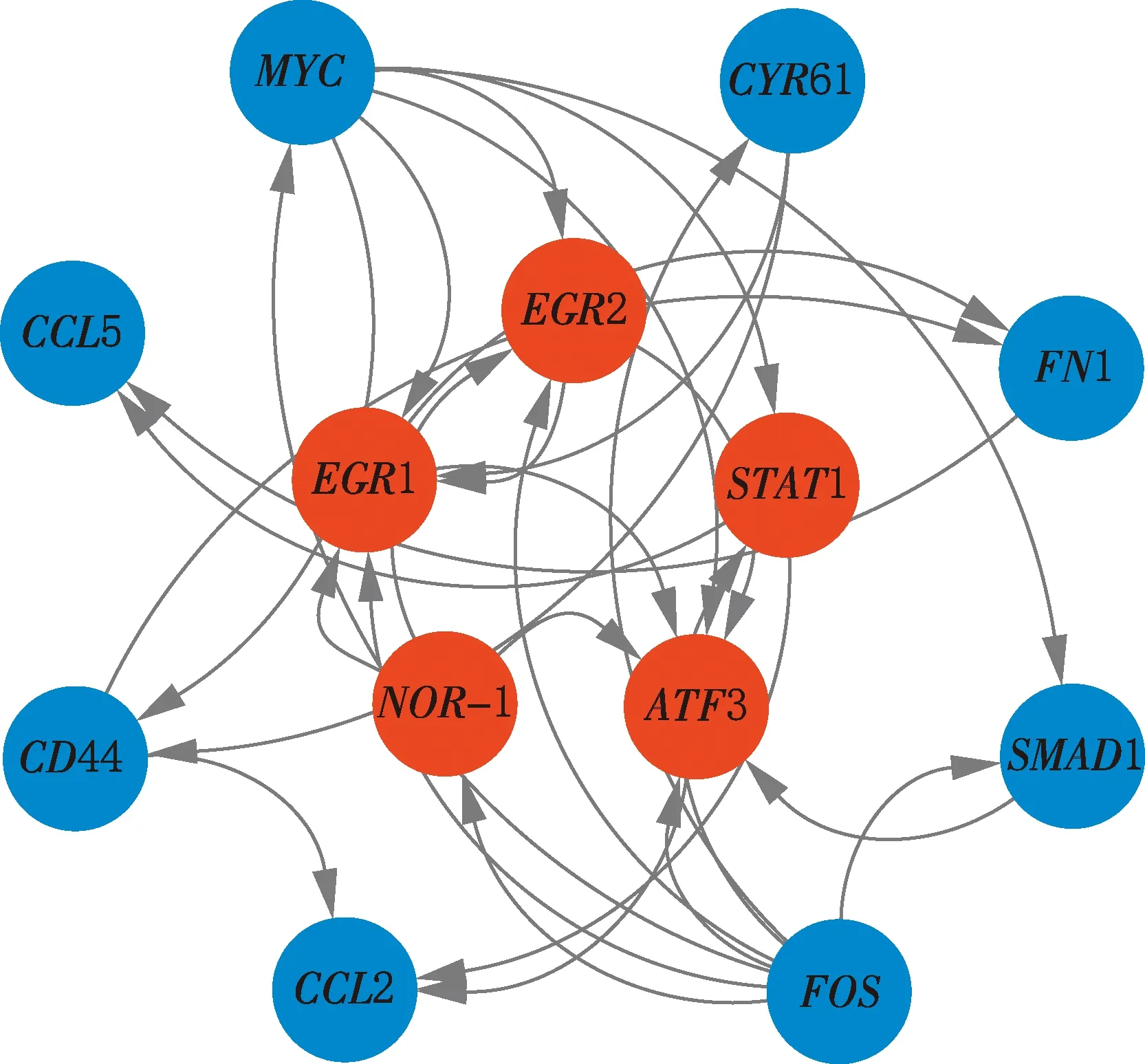
图8 S1 vs S3阶段差异表达基因互作网络Fig.8 Interaction network diagram of differentially expressed genes at S1 vs S3 stage
2.7 大型迪庆藏猪背最长肌脂肪沉积差异表达基因实时荧光定量验证
随机挑选了EGR1、FOXO1等10个差异表达基因进行实时荧光定量PCR验证,EGR1、FOXO1、PDK4、PPARD、PPARGC-1、STAT1基因表达下调,ATF3、LIPE、NOR-1、PRKAG2基因表达上调,与RNA-Seq结果一致(图9)。

图9 大型迪庆藏猪背最长肌差异表达基因实时荧光定量PCR验证结果Fig.9 Real-time quantitative PCR verification results of differentially expressed genes in longissimus dorsi muscle of large Diqing Tibetan pigs
3 讨 论
3.1 大型迪庆藏猪S1 vs S2背最长肌脂肪沉积差异表达基因
大型迪庆藏猪40 kgvs80 kg阶段,ATF3、NOR-1、PRKAG2基因表达上调,EGR1、EGR2基因表达下调。ATF3、NOR-1和PRKAG2基因均在胰岛素抵抗信号通路中富集,当诱发胰岛素抵抗时,脂肪细胞、肌肉细胞对正常浓度的胰岛素反应不足,使得胰岛素作用的敏感性降低,促进葡萄糖摄取和利用效率下降,能量摄入过多[19],脂肪分解减少[20]。而脂联素能够激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),减少丙二酰辅酶A生成,促使脂肪酸进入线粒体得到氧化[21]。当发生脂联素抵抗时,脂联素对AMPK的刺激减弱,骨骼肌中脂肪酸氧化的作用减弱,从而促进胰岛素抵抗[22]。ATF3基因是脂联素基因表达的负调节因子,脂联素基因低表达会导致肥胖和胰岛素抵抗[23]。NOR-1基因在骨骼肌和脂肪组织中大量表达,参与肌内脂肪形成[24],NOR-1基因过度表达会导致循环儿茶酚胺浓度降低,引起胰岛素敏感性降低[25],导致脂肪分解减少,脂肪沉积增加[20]。PRKAG2基因编码AMP活化蛋白激酶γ2亚单位,该基因上调导致AMPK活性增加,糖原合成激活、葡萄糖摄取增加,诱发胰岛素抵抗,脂肪沉积增多[26]。本试验中,ATF3基因表达上调,引起脂联素基因下调,可能导致脂肪含量增加;NOR-1基因上调引起胰岛素敏感性降低,导致脂肪分解减少;PRKAG2基因上调导致糖原合成激活、葡萄糖摄取增加,脂肪沉积增多。
EGR1和EGR2基因属于早期生长反应因子家族,与脂质代谢、脂肪生成、胰岛素及胆固醇生物合成有关,在脂肪细胞分化信号通路中富集。EGR1基因是3T3-L1脂肪细胞分化的负调节因子,敲除EGR1基因能增强脂肪细胞分化[27]。EGR2基因是脂肪细胞分化负调节因子miR-224-5p的直接靶点,miR-224-5p在早期脂肪形成中调节EGR2基因表达[28]。本试验中,EGR1和EGR2基因表达下调,可能促进脂肪细胞分化和脂肪形成。
3.2 大型迪庆藏猪S2 vs S3背最长肌脂肪沉积差异表达基因
大型迪庆藏猪80 kgvs120 kg阶段,LIPE、ATF3基因表达上调,PPARD、PDK4、FOXO1、PPARGC-1、STAT1基因表达下调。LIPE和ATF3基因均富集到葡萄糖稳态信号通路中,影响肌肉组织对葡萄糖的吸收与利用及脂肪组织对胰岛素的敏感性[29]。LIPE基因参与游离脂肪酸的动员[30]、抗脂分解及脂质稳态,导致高肌内脂肪含量[31]。ATF3基因通过负调控脂联素基因而引起肥胖和胰岛素抵抗[23]。本试验中,LIPE基因表达上调可能减少脂肪分解、提高肌内脂肪含量,ATF3基因表达上调可引起脂联素基因表达下调,可能导致肌内脂肪含量增加。
PPARD基因在Wnt和PPAR信号通路中富集,参与脂肪代谢、能量调控,进而影响脂肪细胞的分化[32]。研究发现,Wnt信号通路能够调节脂肪沉积[33],同时能维持前脂肪细胞向脂肪成熟细胞分化的状态,Wnt信号通路减弱时,可分化大量脂肪细胞[34]。PPARD基因是胰岛素敏感和脂肪代谢的关键调节因子,在脂肪代谢中发挥作用,主要参与脂肪酸分解[35],增强脂肪酸运输、氧化、能量解偶联、线粒体呼吸、产热等相关基因的转录[36],上调脂肪酸氧化相关基因,降低体重、脂滴数量和脂滴大小[35]。猪PPARD基因定位在7号染色体一个脂肪沉积的数量性状基因座(quantitative trait locus,QTL)附近,可促进胆固醇和血清高密度脂蛋白积累[37]。PDK4、FOXO1、PPARGC-1、STAT1基因均在葡萄糖稳态、胰岛素受体及胰岛素信号通路过程中富集,通过影响脂联素及胰岛素作用的敏感性,进而影响葡萄糖摄取和利用效率及能量代谢,从而影响肌内脂肪含量。FOXO1基因会对脂联素受体的表达及脂联素敏感性的调节产生影响[38],同时FOXO1基因在调节胰岛素信号转导的糖异生和糖原分解中发挥重要作用,通过抑制细胞周期蛋白依赖激酶而阻止脂肪生成转录因子表达[39],在终末分化开始时,FOXO1基因被激活并转移到前脂肪细胞的细胞核,与PPARG基因的启动子结合,导致有丝分裂后细胞生长停滞,负调控脂肪生成[40]。此外,FOXO1与PDK4基因的启动子区结合,增加肌肉中PDK4基因mRNA的表达[41],减少丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDC)通量,减弱碳水化合物氧化和葡萄糖摄取,并减少游离脂肪酸[42]。PPARGC-1是一种转录共激活因子,可调控能量代谢,在米色和棕色脂肪组织中对脂肪代谢、脂肪细胞增殖、脂肪储存起重要调控作用[43],脂肪组织中缺乏PPARGC-1基因的小鼠会产生胰岛素抵抗[44]。STAT1基因位于PPARG基因下游,在脂肪细胞分化中通过级联调节负调控脂肪形成[45]。本试验中,PPARD、FOXO1、PPARGC-1、STAT1、PDK4基因表达下调,PPARD基因表达下调可能使脂肪酸运输、氧化等相关基因的转录下调,脂肪酸分解减少、脂肪酸积累增多、脂滴变大。FOXO1基因表达下调导致与PPARG基因的启动子结合减少,脂肪生成增多;另外,FOXO1与PDK4基因的启动子结合减少,葡萄糖摄取增加,游离脂肪酸增多。PPARGC-1基因表达下调可能使骨骼肌对胰岛素的敏感性降低,肌内脂肪含量增加。STAT1基因位于PPARG基因下游,PPARG基因通过级联调控引起STAT1基因表达下调,促进脂肪生成。
3.3 大型迪庆藏猪S1 vs S3背最长肌脂肪沉积差异表达基因
大型迪庆藏猪40 kgvs120 kg阶段,ATF3、NOR-1基因表达上调,STAT1、EGR1、EGR2基因表达下调。ATF3和NOR-1基因富集到胰岛素信号通路中,通过影响肌肉组织和脂肪组织中胰岛素敏感性来影响葡萄糖摄取及能量代谢效率,增加肌内脂肪含量[19-20]。STAT1基因在能量稳态、胰岛素抵抗信号通路中富集,通过级联调节负调控脂肪形成[45]。EGR1、EGR2基因属于立早基因(immediate early genes,IEGs),参与细胞生长、分化,富集到脂肪细胞分化信号通路。EGR1和EGR2为脂肪细胞分化的负调节因子[27-28],其表达下调促进脂肪形成。
4 结 论
ATF3、NOR-1、PRKAG2、EGR1、EGR2、LIPE、PPARD、PDK4、FOXO1、PPARGC-1、STAT1作为核心基因调控大型迪庆藏猪肌内脂肪沉积;不同生长阶段参与调控的核心基因并不完全相同,40 kgvs80 kg阶段,ATF3、NOR-1、PRKAG2基因表达上调,EGR1、EGR2基因表达下调;80 kgvs120 kg阶段,LIPE、ATF3表达上调,PPARD、PDK4、FOXO1、PPARGC-1、STAT1基因表达下调;40 kgvs120 kg阶段,ATF3、NOR-1基因表达上调,EGR1、EGR2、STAT1基因表达下调。
