结直肠恶性肿瘤患者围手术期输血和术后感染并发症的相关性研究*
2022-08-22周琳慈璇邵小宝王华杨圆高凤威朱培元
周琳 慈璇 邵小宝 王华 杨圆 高凤威 朱培元
结直肠肿瘤手术在围手术期可能需要输血[1],而输注异体血与免疫抑制、感染性疾病传播和过敏反应的风险增加有关[2]。长期以来人们一直认为,输注异体血可损害宿主对病原体和循环肿瘤细胞的适应性免疫反应[3]。有研究表明,结直肠肿瘤手术患者在围手术期输注异体血与术后感染性并发症和吻合口瘘有关[4-5],也和肿瘤复发相关[6],而且与肿瘤复发的相关性在发生感染并发症时更明显[7]。但是,针对中国结直肠患者的相关报道并不多。本研究回顾性分析了我院收治的643例结直肠恶性肿瘤患者,使用倾向评分匹配排除患者部分影响因素,探讨非转移性结直肠恶性肿瘤患者围手术期输血与术后感染并发症之间的关系。
资料与方法
1 病例资料 回顾性收集2019年2月~2021年6月在南京中医药大学附属南京中医院(南京市中医院)进行结直肠肿瘤手术的患者资料。纳入标准:经病理检查确诊的非转移性结直肠恶性肿瘤患者。排除标准:姑息性治疗;合并血液系统恶性肿瘤;转移性结直肠肿瘤;术前已存在感染并发症。所有患者均签署输血知情同意书。
2 方法 通过查阅病历收集患者数据,包括部分实验室血液检测结果、改良的格拉斯哥预后评分(modified Glasgow Prognostic Score,mGPS)、手术方式(腹腔镜或开放式)、手术时间、肿瘤体积大小、肿瘤部位、TNM分期、住院天数、是否术后有感染并发症及人口统计学变量。
3 诊断标准 根据我国贫血定义,将成年男性血红蛋白<120 g/L,成年女性血红蛋白<110 g/L诊断为贫血。根据术前检验结果计算mGPS评分,将CRP升高(>10 mg/L)和低蛋白血症(<35 g/L)两项均为阳性记作2分,1项异常记作1分,无异常记作0分。浅表手术部位感染定义为从伤口排出或自发排出脓液,深部手术部位感染通过影像学或腹内引流液为脓液诊断,吻合口漏通过剖腹手术或CT确诊,下呼吸道感染通过胸片CT扫描确诊,尿路或导管相关感染是指存在全身炎症反应综合征且尿培养阳性。我们参考国外文献[8-9]将围手术期输血定义为术前30 d至术后30 d内输注红细胞制剂。
4 统计学分析 采用SPSS 25.0统计学软件分析结果,P<0.05表示有统计学意义。连续数据以中位数(四分位差)表示,采用Mann-Whitney U检验进行比较;分类数据比较使用卡方检验。为确定感染的预测因素,我们对所有变量先进行单因素logistic回归分析,对P<0.05的变量再进行多因素logistic回归分析。然后,对单因素logistic回归分析中P<0.05的变量进行倾向匹配评分,将围手术期输血和未输血患者进行1∶1配对(卡钳值=0.02,顺序随机,不替换),通过匹配前后每组的倾向评分频率进行视觉评估倾向评分匹配的适当性。
结果
1 患者基本情况 共643例患者符合纳入、排除标准,其中男性398例(61.9%),女性245例(38.1%);70岁以下177例(27.5%),70岁及以上466例(72.5%);术前贫血患者201例(31.3%),非贫血患者442例(68.7%)。术后115例患者(17.9%)发生感染并发症,其中切口感染41例(6.4%),吻合口瘘19例(3.0%),下呼吸道感染40例(6.2%);33例(5.1%)患者并发多处感染。围手术期输血患者156例(24.3%),未输血患者487例(75.7%)。156例输血患者中14例为术前输血,108例为术中或术后输血,34例患者在多个时间点接受输血。共输注悬浮少白红细胞617单位,其中输注量≤2单位55人,输注量>2单位101人,85人同时输注了血浆,共47775 mL。术前mGPS评分0分303例(47.1%),1分81例(12.6%),2分26例(4.0%),233例(36.2%)因无检测结果未做评分。
围手术期输血组与未输血组比较表明,围手术期输血与患者性别为女性(P=0.002)、年龄增加(P<0.001)、mGPS评分为2(P<0.001)、肿瘤部位在直肠(P=0.012)、肿瘤体积大(P<0.001)、手术时间长(P<0.001)有关。围手术期输血组患者术前血红蛋白数值明显低于未输血组(P<0.001),贫血患者占比高于未输血组(分别为69.2%、19.1%,P<0.001),围手术期输血患者术后感染并发症发生率明显高于未输血组(分别为30.1%、14.0%,P<0.001)。具体结果见表1。

表1 643例结直肠恶性肿瘤患者临床资料和输血相关性比较分析结果
单因素logistic回归分析显示,年龄大于70岁(OR=1.597,P=0.032)、TNM 4期(OR=6.306,P=0.017)、术前贫血(OR=1.679,P=0.015)、白细胞计数大于10×109/L(OR=3.497,P=0.003)、mGPS评分为1/2(OR=1.967,P=0.008)、开放式手术(OR=1.973,P=0.001)、手术时间大于240 min(OR=2.076,P=0.004)和围手术期输血(OR=2.657,P<0.001)是术后感染并发症的风险因素;对上述变量进行多因素logistic回归分析,显示围手术期输血(OR=2.003,P=0.024)是术后感染并发症发生的独立风险因素。结果见表2。
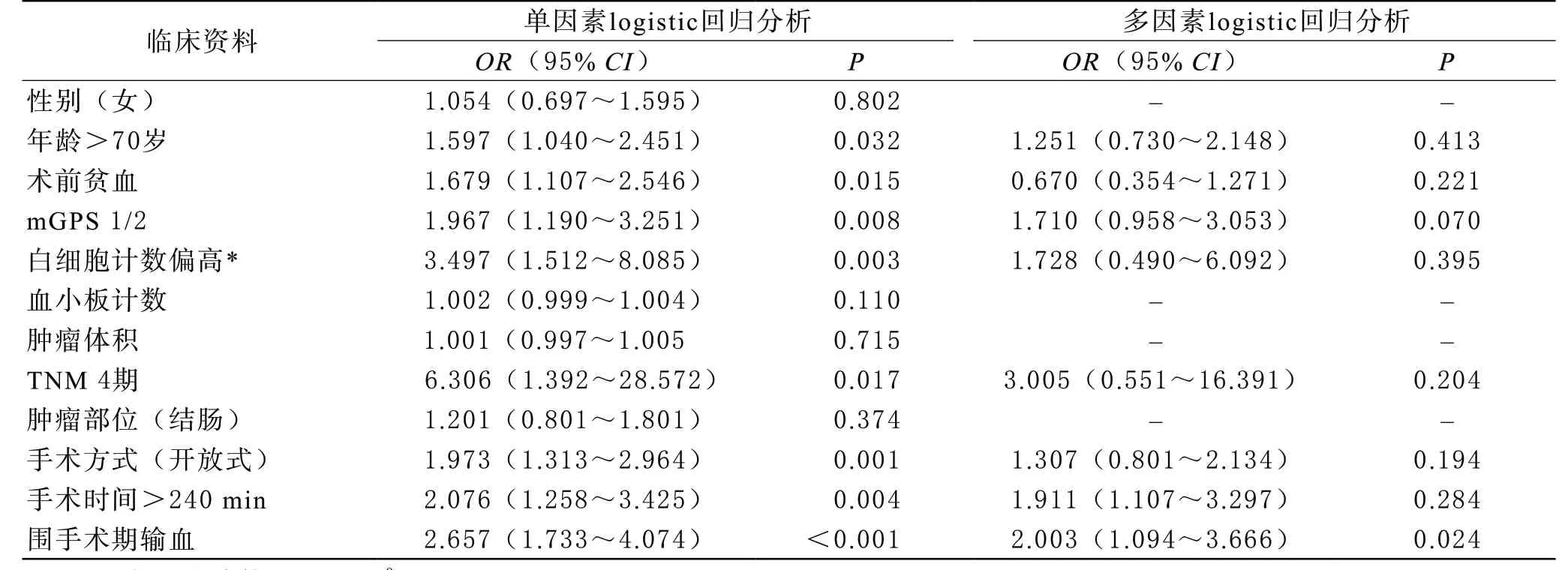
表2 与患者术后感染并发症有关logistic回归分析
2 倾向匹配队列分析结果 643例患者中233例缺乏术前mGPS评分,无法进行倾向匹配;剩余410例有术前评分,其中接受输血109例,未接受围手术期输血301例。为对围手术期输血和未输血患者进行1∶1匹配比较,将结果1中单因素logistic回归分析P<0.05的其他影响因素(年龄大于70岁、TNM 4期、术前贫血、白细胞计数大于10×109/L、mGPS评分为1/2、开放式手术、手术时间大于240 min)进行倾向评分,结果有162例患者数据符合条件(每组81例),如图1显示评分分布有明显改善。在倾向评分匹配队列中,接受围手术期输血患者感染并发症发生率显著高于未输血组(分别为32.1%和17.3%,P=0.029),更易发生切口感染(分别为16%、3.7%,P=0.008)和吻合口瘘(分别为10.6%、2.4%,P=0.016),住院天数中位数更长(分别为23 d、20.5 d,P=0.008),见表3。单因素logistic回归分析显示,围手术期输血是术后感染并发症的风险因素(OR=2.262,95%CI1.078~4.747,P=0.031)。

图1 围手术期输血组和未输血组患者的倾向评分分布直方图

表3 倾向评分匹配后临床资料和输血相关性比较分析
讨论
本研究共纳入643例非转移性结直肠恶性肿瘤手术患者,结果115例发生术后感染,主要为切口感染(41例,35.7%)、下呼吸道感染(40例,34.8%)和腹腔深部感染(19例,16.5%),并且有33例患者同时存在多部位的感染,说明结直肠肿瘤术后感染并发症具有其复杂性和独特性[10-11]。与未输血组相比,围手术期输血组患者术前血红蛋白数值明显较低(P<0.001),贫血患者占比较高(P<0.001),术后感染并发症发生率更高(P<0.001)。单因素logistic回归分析显示年龄高、TNM分期晚、术前贫血、白细胞计数高、开放式手术、手术时间长和围手术期输血与结直肠肿瘤患者术后感染并发症的发生有关,多因素logistic分析表明围手术期输血是术后感染并发症发生的独立危险因素。为了保证研究结果的可靠性,均衡围手术期输血组和未输血组之间各个特征变量的可比性,去除混杂偏倚,我们进行了倾向匹配分析,根据倾向评分对162例患者进行1∶1匹配,每组81例,显示评分分布有明显改善。结果显示,接受围手术期输血患者感染并发症发生率显著高于未输血组(分别为32.1%和17.3%,P=0.029),更易发生切口感染(P=0.008)和吻合口瘘(P=0.016),住院天数中位数更长(P=0.008);单因素logistic回归分析显示围手术期输血是术后感染并发症的风险因素(OR=2.262,P=0.031)。本研究结果与国外发表的一些研究相符[9,12-13]。
围手术期输血不仅存在输血不良反应的风险,包括溶血和非溶血输血反应、移植物抗宿主病、输血相关急性肺损伤(TRALI)和传播传染性疾病[14],也和术后感染率增加、疾病复发以及癌症患者生存率差有关[3,9,12],可能是由于输注血液制剂对人体免疫系统的负面影响所致,即输血相关免疫调节(TRIM)[14-15]。围手术期输血后受血者体内发生的免疫调节机制极其复杂,有研究表明可以通过减少淋巴细胞总数、减少CD4+T细胞数量、降低CD4+/CD8+T细胞比值、减少NK细胞绝对数、减弱淋巴细胞对有丝分裂原的反应等多方面改变受血者的免疫功能[16]。TRIM效应可能通过以下方式介导:输入的异体白细胞;异体血浆中的可溶性分子包括HLA Ⅰ类肽;从红细胞或血小板释放到上清液中的生物介质[17]。因此,加强结直肠肿瘤患者围手术期的血液管理,减少同种异体血液输注,有助于减少患者术后并发症的发生,改善患者预后。
患者血液管理(patient blood management,PBM)是一种基于循证医学的多学科协作的治疗方法,通过维持或优化患者血红蛋白水平、优化凝血,最大限度减少失血,从而减少输血,使可能需要输血的患者得到最优化的治疗[18-19]。PBM的主要内容是三柱理论:全面的贫血管理,及时诊断和纠正术前贫血(第一柱);围手术期最大限度控制失血(第二柱);利用和优化患者特定的贫血生理耐受性,限制性输血(第三柱),适用于择期手术患者的术前、术中和术后治疗各个阶段[20]。在恶性肿瘤患者中应用PBM具有独特的挑战性:首先,由于使用促红细胞生成药物与静脉血栓事件的风险增加相关,并且可能增加癌症复发的风险、缩短无病生存期,其治疗肿瘤相关性贫血的临床应用存在一些争议[21-22];其次, 由于肿瘤手术回收的自体血液中可能残存肿瘤细胞而导致肿瘤的血行传播,肿瘤手术能否使用自体回收血液存有争议[23-24]。即便如此,有研究表明实施PBM也可以使肿瘤患者受益。GROSS等[22]回顾研究缅因州东部医疗中心2008年1月~2013年7月恶性肿瘤患者在门诊和住院期间的输血情况,癌症患者采用限制性输血策略并限制使用促红细胞生成药物,结果实施PBM使接受促红细胞生成药物的患者比例从2008年的2.9%下降到2013年的1.1%,每例住院和门诊患者输注的红细胞从平均0.067单位降至0.038单位(P<0.001),而住院死亡率和住院时间没有显著变化。德国法兰克福大学医院的一项回顾性研究显示,术前贫血是唯一影响生存率的独立预测因素,实施PBM后患者术前血红蛋白值正常的频率明显高于实施前(分别为56.6%、35.7%,P<0.001),输血数量从(5.5±11.1)单位/例减至(3.0±6.9)单位/例(P<0.001),患者输血率从62.4%降至40.9%(P<0.001),2年总生存率从67.0%增加到80.1%(P=0.001)[25]。PBM计划重点包括术前血红蛋白水平的优化、血液保护技术、临床输血的标准化以及定期培训。如果患者血红蛋白值<12 g/dL(女性)或<13 g/dL(男性)且输血概率>10%,则测量血清铁含量,若证实缺铁是贫血的主要原因时静脉注射补充铁;在没有休克或呼吸困难等诱因时,将术中、术后的输血阈值调整为血红蛋白<60 g/L,如果患者存在特定的缺氧危险因素或体征,则调整为60~80 g/L,这些要求适用于每一次红细胞输注[25]。一项有关胃癌根治性手术中实施PBM的多中心前瞻性介入队列研究,共纳入789例患者,其中PBM实施前496例,实施后293例,结果输血率从39.1%降至27.0%,感染性并发症从25%减少到16.4%,再次手术率从8.1%减少到6.1%,中位住院时间从11 d降到8 d,住院率从14.1%降至8.9%,死亡率从7%降到4.8%,救援失败率从62.7%降至32.7%,证实实施PBM有助于降低输血率,改善术后预后[26]。
目前在结直肠癌患者中实施PBM的报道很少,信息有限[27]。本研究证实术前贫血在结直肠癌患者中非常普遍,156例围手术期输血组患者中108例(69.2%)在术中和术后输血,输注量≤2单位的有55人(35.2%),而围手术期输血是术后感染并发症的风险因素,因此在结直肠肿瘤患者围手术期实施PBM,可能有助于减少同种异体血液输注,减少患者术后并发症的发生,改善患者预后。当然,本研究为回顾性分析,存在不足之处,部分患者术前未检测CRP导致术前GPS评分缺失,在使用倾向评分后,匹配患者例数明显减少,对统计结果可能产生影响,还需要进行大样本的临床研究,从而更准确地为患者减少围手术期输血而减少相应感染并发症提供指导。此外,应该建立结直肠患者围手术期的输血指南,明确是否应该常规使用其他非输血方式改善术前贫血症状,从而减少围手术期输血,以降低术后感染并发症发生的可能性。
利益冲突所有作者均声明不存在利益冲突
