鄂西南地区稻瘟病菌AVR-Pia动态变化研究
2022-08-22韩旭晨韩豪杰谭艳平刘学群刘新琼王春台
韩旭晨,董 岩,韩豪杰,谭艳平,刘学群,刘新琼,徐 鑫,李 开,王春台
(中南民族大学生命科学学院/生物技术国家民委重点实验室/武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
0 引言
世界上一半以上的人口以水稻为主食[1]。由稻瘟病菌Magnaporthe oryzae引起的稻瘟病会造成水稻大量减产。培育抗耐病品种是防治稻瘟病最安全、经济有效的措施。选育含有主效抗性基因的品种在多种作物中已经被应用。到目前为止,已定位稻瘟病主效抗性基因100多个,已克隆出36个[2]。但是由于稻瘟病菌变异较快,从而导致其毒力变化快,形成新的致病小种使抗病品种失去抗病性。因此,研究不同地区稻瘟病菌的无毒基因分布、变异以及每年的动态变化,可为水稻产区抗病品种的选育和布局提供理论依据。
水稻-稻瘟病菌系统是典型的基因对基因系统[3]。无毒(Avr)基因编码的Avr蛋白可作为效应器,被植物细胞中相应的R蛋白直接或间接识别,这两种蛋白相互作用,引起寄主植物宿主快速防御反应。无毒基因高度多样化,具有快速自然变化的能力,包括全部或部分缺失、转座子插入、点突变、甚至易位等[4-6]。Avr基因的突变导致由R基因控制的抗性机制的崩溃,为了R基因的可持续利用,了解病原菌中Avr基因的变异机制具有重要意义。
鄂西南属云贵高原与东部低山丘陵的过渡区域,山河交错,雨热同期,降水充沛,且鄂西南地区稻区海拔不一,光照温度等自然条件多样,构成了复杂的气候资源,稻瘟病菌组成复杂且变异也特别快,选育适应该地区的水稻品种具有特别重要的意义。目前已有AVR-Pita[7]、AVR-Pizt[8]、AVR1-CO39[9]、ACE1[10]、AVRPia、AVR-Pii、AVR-Pik/km/kp[11]、PWL1[12]、PWL2[13]、AVRPib[14]、AVR-Pi9[15]和AVR-Pi54[16]12 个无毒基因被克隆。Avr-Pia编码长度为85个氨基酸的分泌蛋白,直接与水稻RGA5中的RATX1结构域互作,释放RGA4,引起植物抗病反应[17-18]。在山东水稻主产区分离的123个稻瘟病菌中,Avr-Pia的出现频率为10.57%[19]。云南省13个市采集分离的471株稻瘟病菌中有244株含有Avr-Pia,且主要是完全缺失变异[20]。鄂西南地区无毒基因AVR-Pia的分布情况和变异以及抗性基因Pia在该地区的有效性尚未清楚。
本研究通过对2017—2020年收集分离到的661株稻瘟病菌利用PCR检测来研究鄂西南地区稻瘟病菌无毒基因Avr-Pia的出现频率和分布,同时进行致病性鉴定来测定抗性基因Pia的有效性,结合生物信息学来分析无毒基因Avr-Pia的变异机理,为鄂西南地区针对性的聚合水稻主效抗性基因育种以及水稻品种合理布局提供参考。
1 材料与方法
1.1 实验材料
本实验所用感病稻杆采集自鄂西南的9个不同地点(咸丰、宣恩、柏杨、建始、鹤峰、来凤、忠路、贺家坪、野三关)[21]的不同品种(表1),经分离获得单孢菌株(表2),采用滤纸片保存法保存[22]。含有Pia基因的水稻单基因系IRBLa-A水稻品种及感病对照丽江新团黑谷由武汉中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室/生物技术国家民委重点实验室提供。

表1 各地区种植水稻品种

续表1

表2 2017—2020年各观测点感病品种和分离单孢数量
1.2 实验方法
1.2.1 DNA提取 稻瘟病菌活化后液体培养获得菌丝,冷冻干燥。采用CTAB(CTAB 2%、NaC1 1 mol/L、pH 8.0 Tris-HC1 100 mmol/L、EDTA 20 mmol/L)法提取DNA,溶于1×TE缓冲液后,于-20℃冰箱备用。
1.2.2AVR-Pia基因PCR检测与测序 根据报道的Avr-Pia无毒基因序列CDS区域和启动子区域序列合成引物(表3),由华大基因合成。20µL反应体系包括模板 DNA(20 ng/µL)2 µL、Avr-PiaF1和AVR-PiaR1(10 µmol/L)各0.3µL、10×PCR Buffer(Mg2+Plus)2µL、dNTPs(10 mmol/µL)1 µL、ExTaq(5 U/µL)0.1 µL、ddH2O 14.3 µL。反应程序:94℃预变性4 min;94℃变性30 s,59℃退火30 s,72℃延伸40 s,35个循环;72℃再延伸10 min,12℃保存。重复2次,制做浓度为1.0%的琼脂糖凝胶对产物进行电泳检测,统计无毒基因AVR-Pia所占比例,对含有无毒基因Avr-Pia的阳性产物送华大基因进行测序,同时结合致病性结果选取阳性菌株对启动子区域(AVR-PiaF2,AVR-PiaR2)进行扩增,送华大基因测序。

表3 AVR-Pia CDS与启动子区域引物
1.2.3 稻瘟病菌孢子悬浮液的制备 将实验室保存的661株稻瘟病菌株活化后接种到燕麦培养基,25℃下黑暗培养7~9天,当培养基平板被菌体覆盖后,使用棉签将菌体表面菌丝刮除,置于28℃产孢培养箱紫光产孢3~4天。产孢完成后,用准备好的无菌水将培养基表面灰色孢子用毛刷刷下双层纱布过滤,调节孢子悬浮液浓度为1.5×105个/mL,加入0.02%Tween-20后备用。
1.2.4 水稻稻瘟病接种与调查 将水稻单基因系IRBLa-A水稻品种和感病对照品种丽江新团黑谷种子浸种,再将铁盘装好土,做好标记后将种子放入土坑,每个品种播种10粒左右,用细土盖住种子,每天定时浇水,大约15天长至4叶期。接种前将铁盘加入足量的水保证土壤湿润,再在接种室中利用喷壶将孢子悬浮液均匀喷雾到水稻叶表面,喷好菌液后将幼苗转移至恒温保湿箱保湿24 h,保证湿度90%以上,保湿完成后转移至温室,光照培养5~7天,调查发病情况,调查标准参考文献[23]。
2 结果与分析
2.1 鄂西南地区稻瘟病菌无毒基因AVR-Pia的动态变化
对2017—2020年分离保存的661株稻瘟病菌单孢菌株经过PCR检测,有49株能扩增出预计463 bp的特异性条带(图1),612株未扩增出该条带。2017年分离的106株稻瘟病菌中,只有8株含有无毒基因AVR-Pia,且只在柏杨和来凤地区,分别为7、1株,所占比例为22.6%、14.3%。2018年分离的134株中,AVR-Pia出现的地区增加,贺家坪、野三关、来凤和柏杨分别有2、3、7、11株,所占比例为20%、30%、53.8%、22.4%;2019年分离的161株稻瘟病菌中,仅在来凤分离的稻瘟病菌中检测到5株稻瘟病菌含有无毒基因AVR-Pia,所占比例为10.6%;2020年的260株稻瘟病菌中只有13株检测到含有AVR-Pia,柏杨、宣恩分别有6、7株,所占比例为8.7%、10.1%(表4)。总体来说,鄂西南地区每一年AVR-Pia出现都比较少,2017年、2019年、2020年出现频率都低于10%,只有2018年出现较多,达到16.0%,而且每一年地区分布差异较大。宣恩地区在2017—2019年未出现过,2020年才检测到含有AVRPia的菌株,总比例为6.1%;柏杨和来风地区相对来说AVR-Pia出现较多,4年中有三年和两年检测到AVRPia,比例分别为14.6%、14.6%;贺家坪、野三关只在2018年出现过含有AVR-Pia的菌株,所占比例分别为3.1%、15.8%;忠路只在2017年出现1株含有AVR-Pia的菌株,所占比例为3.2%;而咸丰、建始、鹤峰未检测到含有AVR-Pia的稻瘟病菌,表明无毒基因AVR-Pia在鄂西南地区和稻瘟病菌群体中的分布差异较大,且出现率较小。宣恩柏杨呈现出增多的趋势,而其他地区正在出现与消失的边缘往复(图2)。

图1 PCR扩增无毒基因AVR-Pia电泳图谱

图2 2017—2020年各地区含有AVR-Pia稻瘟病菌数的变化

表4 稻瘟病菌无毒基因AVR-Pia PCR扩增结果
2.2 抗性基因Pia的有效性
将2017—2020年分离的661株稻瘟病菌单孢菌株,制备孢子悬液后分别喷雾接种在IRBLa-A和丽江新团黑谷三叶期的叶片上。结果显示661株稻瘟病菌均能侵染感病对照,对含有单抗性基因Pia的IRBLa-A致病率达到86.2%。2017年稻瘟病菌群体中,宣恩、柏杨、建始、太平、忠路、贺家坪对IRBLa-A有致病性的菌株分别为16、22、22、5、6、18株,所占比例分别为94.1%、80.0%、81.5%、83.3%、85.7%、100%,总致病率为84.0%。2018年稻瘟病菌群体中,咸丰、宣恩、柏杨、建始、来凤、贺家坪、野三关对单基因系IRBLa-A有致病性的菌株分别为27、14、37、3、7、8、7,所占比例分别为87.1%、77.8%、75.5%、100.0%、53.8%、80.0%、70.0%,总致病率为76.9%;2019、2020年稻瘟病菌群体总致病率分别为88.8%、90.4%,除未分离出稻瘟病菌单孢的地点外,所有地点致病率均大于80%。而2017—2020年间抗性基因Pia有效性呈下降的趋势(图3)。表明鄂西南地区水稻抗性基因Pia抗性逐年下降,且不适合在鄂西南地区以Pia作为主效抗病基因来育种。

表5 鄂西南地区2017—2020年稻瘟病菌菌株对水稻抗性基因Pia的致病性
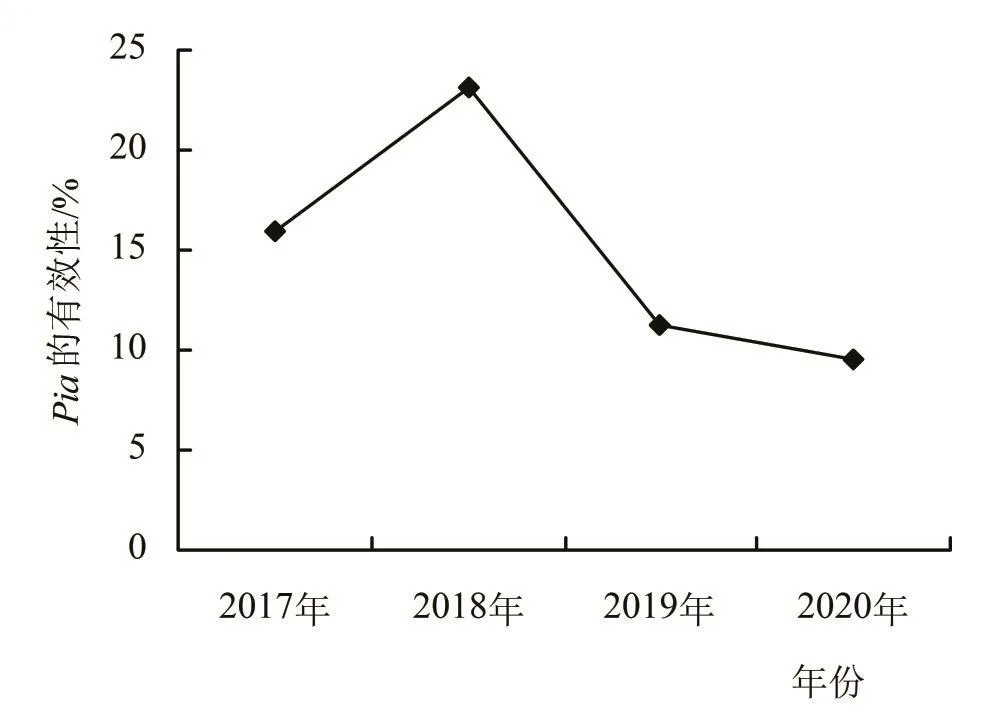
图3 2017—2020年抗性基因Pia有效性变化
2.3 AVR-Pia变异机理
将能扩出463 bp的特异性条带的49株稻瘟病菌的PCR产物进行测序,将测序的AVR-PiaCDS序列与已克隆的AVR-Pia序列比对,结果显示,49株稻瘟病菌均与已克隆基因序列一致,表明鄂西南地区无毒基因CDS区域基因稳定,不发生突变(图4)。把2017—2018年240株稻瘟病菌的扩增结果与致病性鉴定结果结合分析,31株稻瘟病菌中含有AVR-Pia基因且对含有Pia抗性基因的水稻单基因系IRBLa-A无致病性的菌株有16株,含有AVR-Pia基因且对含有Pia抗性基因的水稻单基因系IRBLa-A有致病性的菌株有15株,利用特异性引物对其基因上游启动子区域进行扩增并测序,发现有7株稻瘟病菌AVR-PiaATG上游109处发生碱基替换(图5)。将启动子序列利用Neurel Network Promoter Prediction软件进行预测分析,结果显示,具有2个高分值的起始转录位点(表6)。用PLANTCARE对AVR-Pia基因启动子序列的顺式作用元件进行分析(表7),利用SCPD(酵母启动子数据库)预测调控元件(表8),结果显示,碱基替换位点均不在预测的启动子与调控元件中。这个点突变是否与该基因的表达有关有待进一步研究。

表6 启动子预测分析

表7 AVR-Pia基因启动子顺式作用元件

表8 利用SCPD(酵母启动子数据库)预测的调控元件

图4 无毒基因AVR-Pia CDS序列比对结果

图5 无毒基因AVR-Pia启动子区域序列比对结果
3 结论与讨论
鄂西南属云贵高原与东部低山丘陵的过渡区域,各地区海拔不一,且降水充沛,光照温度等自然条件多样,具有复杂的气候资源,使得水稻品种和稻瘟病菌交互变异,实时检测鄂西南各地区稻瘟病菌无毒基因动态变化及变异,对了解稻瘟病菌的群体遗传结构、有针对性的聚合育种具有重要的意义。本研究连续4年从鄂西南地区9个地点的100个水稻品种采集并分离661株稻瘟病菌单孢菌株,利用PCR技术对AVR-Pia进行扩增检测,结果显示有49个菌株含有无毒基因AVR-Pia,仅占所有分离菌株的7.4%。2017—2020各年AVR-Pia出现频率不同,分别为7.5%、16.0%、3.1%、5.0%。9个不同采样地点只有宣恩、柏杨、来凤、贺家坪、野三关、忠路检测到AVR-Pia,咸丰、建始和太平未检测到。这些结果表明无毒基因AVR-Pia在鄂西南地区稻瘟病菌群体中的出现率较小,分布差异较大,除了柏杨、来凤和野三关含有AVR-Pia的稻瘟病菌所占比
例在15%左右,其他地区均小于7%,说明AVR-Pia不是该区域的主要无毒基因。对比中国其他地区稻瘟病菌AVR-Pia的检出结果,在中国偏东北方的辽宁省2017—2018年采集的151株稻瘟病菌中,没有检测到AVR-Pia[24],2017年黑龙江省208个稻瘟病菌单孢菌株中,AVR-Pia的出现频率为16.35%[25],2018年山东省水稻主产区分离到的123株稻瘟病菌单孢中,AVR-Pia出现频率为10.57%[19],2013—2017年江苏省分离的621株中,只有9.34%的稻瘟病菌检测到AVR-Pia,均低于20%;而偏西南地区的云南省13个地市采集并分离的471株稻瘟病菌单孢中,51.8%菌株含有AVR-Pia[20],湖南省稻瘟病菌群体中,182株稻瘟病菌中98.8%检测到AVR-Pia,这些结果说明不同地区气候、海拔等环境因素,以及各地区种植水稻品种的差异,导致稻瘟病菌群体中无毒基因的组成以及进化速率存在差异,鄂西南地区AVR-Pia检出率与偏东北方的地区相似。
水稻-稻瘟病菌系统作为典型的基因对基因系统,水稻的抗瘟性与稻瘟病菌无毒基因密切相关,两者共同进化。稻瘟病菌作为真菌病原菌,其无毒基因非常不稳定,容易发生变异,无毒基因的变异使得产生新的致病菌株,其富集导致水稻品种抗瘟性丧失,因此研究稻瘟病菌无毒基因的变异机制可为了解稻瘟病菌群体进化提供理论基础,以及使水稻抗性时期的延长提供方向。AVR-Pia位于靠近染色体端粒区域,易发生变异,王群等[20]对云南省42株稻瘟病菌编码区进行测序,未发现缺失、插入和SNP等变异方式,主要变异方式为基因完全缺失。本研究对2017—2020年稻瘟病菌进行抗性检测,并结合基因测序对AVR-Pia变异机理进行探讨,661株菌株中有86.2%菌株使得含有单抗性基因Pia的IRBLa-A致病,表明稻瘟病菌对含有Pia的水稻品种适应性增强,使得Pia抗性逐渐衰退。能扩出特异性条带的49株菌株序列与已报道AVR-Pia序列CDS区域一致,表明AVR-Pia在鄂西南地区基因与云南地区变异情况相同。对2017—2018年含有AVR-Pia基因且对含有Pia抗性基因的水稻单基因系IRBLa-A有致病性的15株菌株利用特异性引物对其基因上游启动子区域进行扩增并测序,发现有7株稻瘟病菌AVR-Pia ATG上游109 bp处发生碱基替换,该位点不在生物信息学预测的调控元件上。因此这些菌株中无毒性的丧失需要更深入的研究来证实,例如启动子区域的克隆与分析,且有研究表明,不同的无毒菌株中AVR-Pia的拷贝数不同,同源重组会导致AVR-Pia的缺失[27],推测无毒基因AVR-Pia无毒性的丧失可能是受拷贝数的影响,从而影响分泌蛋白的量,从而影响其功能,同时表观遗传和蛋白修饰调控机制也会对稻瘟病菌致病过程产生影响。
鄂西南地区作为重要的水稻粮食产区,稻瘟病菌群体组成较复杂,本研究仅对稻瘟病菌无毒基因AVRPia各地区的监测以及变异机制进行分析,需进一步加强其他无毒基因的监测以及变异,可为其将来筛选抗病基因以及合理布局提供参考。
