miRNA–193a–3p 靶向TGF–β2 基因诱导肝癌细胞凋亡的分子机制研究
2022-08-22鞠宝玲海艳洁鄂志野张红军
鞠宝玲 海艳洁 鄂志野 张红军
1.牡丹江医学院免疫教研室,黑龙江牡丹江 157001;2.牡丹江医学院红旗医院肿瘤科,黑龙江牡丹江 157001
肝癌是世界范围内发病率较高的恶性肿瘤,具有患病率高、转移性强的特点。目前临床上治疗肝癌主要采用手术切除、辅助化疗及靶向治疗等,但易复发和转移,预后较差,5 年生存率较低。研究表明,非编码小RNA 分子(microRNA,miRNA)作为癌基因或抑癌基因参与了肝癌的发生发展和转移过程,因此,探讨miRNA 在肝癌中发生、发展的相关分子机制,由此开发分子靶向治疗位点,对于提高肝癌的临床疗效具有重要意义。本研究选取2019 年1 月至2021 年12 月在牡丹江医学院红旗医院收治的肝癌患者30 例,分析了目标miRNA 在肝癌发生发展中的作用及其作为分子靶向治疗位点的可行性,现报道如下。
1 对象与方法
1.1 研究对象
选取2019 年1 月至2021 年12 月在牡丹江医学院附属红旗医院进行手术切除的肝癌患者30 例,其中男性18 例,女性12 例;患者年龄40~69 岁,平均年龄(55.62 ± 7.93)岁;TNM 分期I期8 例,Ⅱ期10 例,Ⅲ期12 例;高中分化19 例,低未分化11 例,所有患者术前均未接受新辅助化疗,且临床资料完整。留取肝癌组织和相应癌旁正常组织(距离肝癌组织边缘2cm 以上,经病理确认无癌细胞浸润正常组织),手术取材后立即置于–80℃冻存备用。本研究经牡丹江医学院医学伦理委员会批准(伦理学审批号:20210304–50),所有研究对象均签署知情同意书。
1.2 细胞培养
肝癌HepG2 细胞系购自美国ATCC 细胞库,HepG2 细胞株接种于含10%胎牛血清的DMEM(dulbecco's modification of eagle’s medium,DMEM)完全培养液,置于37℃,5% CO恒温箱中培养,待细胞贴壁生长至 70%~80%融合度时进行实验。miR–193a–3p mimic 及无义miRNA(对照NC 组)、TGF–β2 过表达质粒及空质粒,稀释至100nmol/L,采用Lipofectamine 2000 转染试剂转染6h,更换培养液,继续培养48h。实验分组:miR–193a–3p mimic组和对照NC 组、miR–193a–3p mimic+空质粒组和miR–193a–3p mimic+TGF–β2 组。
1.3 miR-193a-3p 靶基因预测及双荧光素酶报告实验验证
采用TargetScan(http://targetscan.org/)和miRDB(http://mirdb.org/miRDB)靶基因预测网站预测miR–193a–3p 靶基因。构建TGF–β2 野生型质粒(TGF–β2–wild type,TGF–β2–Wt)和TGF–β2 突变型质粒(TGF–β2–mutant,TGF–β2–Mut),将质粒与miR–193a–3p mimic 共转染至细胞,48h 后,分别测定细胞萤火虫荧光素酶荧光强度(M1)以及内对照海肾荧光素酶荧光强度(M2),实验数据以荧光强度(M1)/荧光强度(M2)表示。
1.4 miR-193a-3p 检测
采用实时荧光定量PCR(real–time quantitative PCR,qRT–PCR)检测肝癌组织中miR–193a–3p 水平。Trizol 提取肝癌组织及癌旁正常组织中总RNA,反转录成cDNA,SYBR Green 法检测miRNAs 的表达,引物序列如下:miR–193a–3p,上游引物:5′–CGC GAA CTG GCC TAC AAA GTG–3′,下游引物:5′–AGT GCA GGG TCC GAG GTA TT–3′;U6,上游引物:5'–CTC GCT TCG GCA GCA CA–3′,下游引物:5'–AAC GCT TCA CGA ATT TGC GT–3′。反应条件:95℃预变性15min,94℃ 15s,55℃ 30s,70℃ 30s,共40 个循环。每个样本设3 个复孔,采用2法计算。
1.5 HepG2 细胞活性的检测
采用CCK–8 实验检测HepG2 细胞活性。调整HepG2 细胞浓度为1×10/L,接种于96 孔板。细胞施加不同作用因素后培养48h,弃去培养液,每孔加入90μl DMEM 培养液和10μl CCK–8 试剂,充分混匀,培养箱中孵育4h,于酶标仪450nm 波长处测定各孔吸光度值。
1.6 HepG2 细胞凋亡的检测
细胞施加不同作用因素后培养48h,以预冷PBS洗涤细胞并调整细胞密度为10~10/ml,加入5μl的Annexin V–FITC 避光孵育10min,再加入10μl 的碘化丙啶,低温避光孵育15min,1h 内应用流式细胞仪检测HepG2 细胞凋亡率。
1.7 HepG2 细胞迁移的检测
采用Transwell 侵袭实验检测HepG2 细胞的迁移。实验前将HepG2 细胞饥饿24h,收集细胞,以无血清培养基调整细胞密度为3×10个/ml,取300μl细胞悬液置于Transwell 小室(6.5mm,8.0μm 孔径,Corning)上室,下室加入750μl 含20%胎牛血清的完全培养液(去除下室培养液和小室之间气泡),培养24h。甲醛固定侵袭的细胞,10%结晶紫对贴壁细胞进行染色,显微镜下计数,评估HepG2 细胞的迁移能力。
1.8 统计学方法
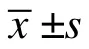
2 结果
2.1 miR-193a-3p 在肝癌组织中的表达
qRT–PCR 结果显示,肝癌组织中miR–193a–3p 的表达(0.27±0.03)显著低于正常肝脏组织(0.69±0.06),差异有统计学意义(<0.01),详见图1。
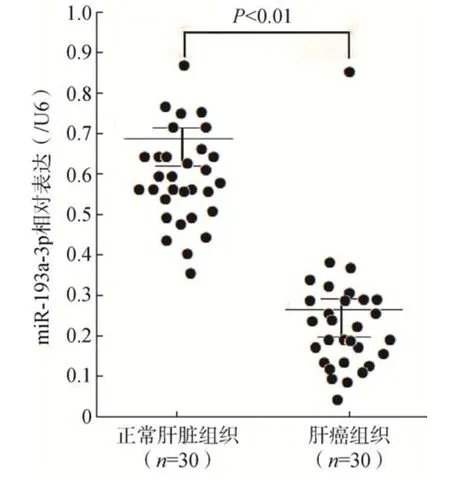
图1 肝癌组织中miR-193a-3p 的表达
2.2 miR-193a-3p 过表达对肝癌细胞生物学功能的影响
与NC 组比较,miR–193a–3p 组细胞的增殖活性及迁移数量减少,细胞凋亡率显著增加,差异有统计学意义(<0.05),且以时间依赖性方式诱导肝癌细胞凋亡,详见表1 和图2A、B。
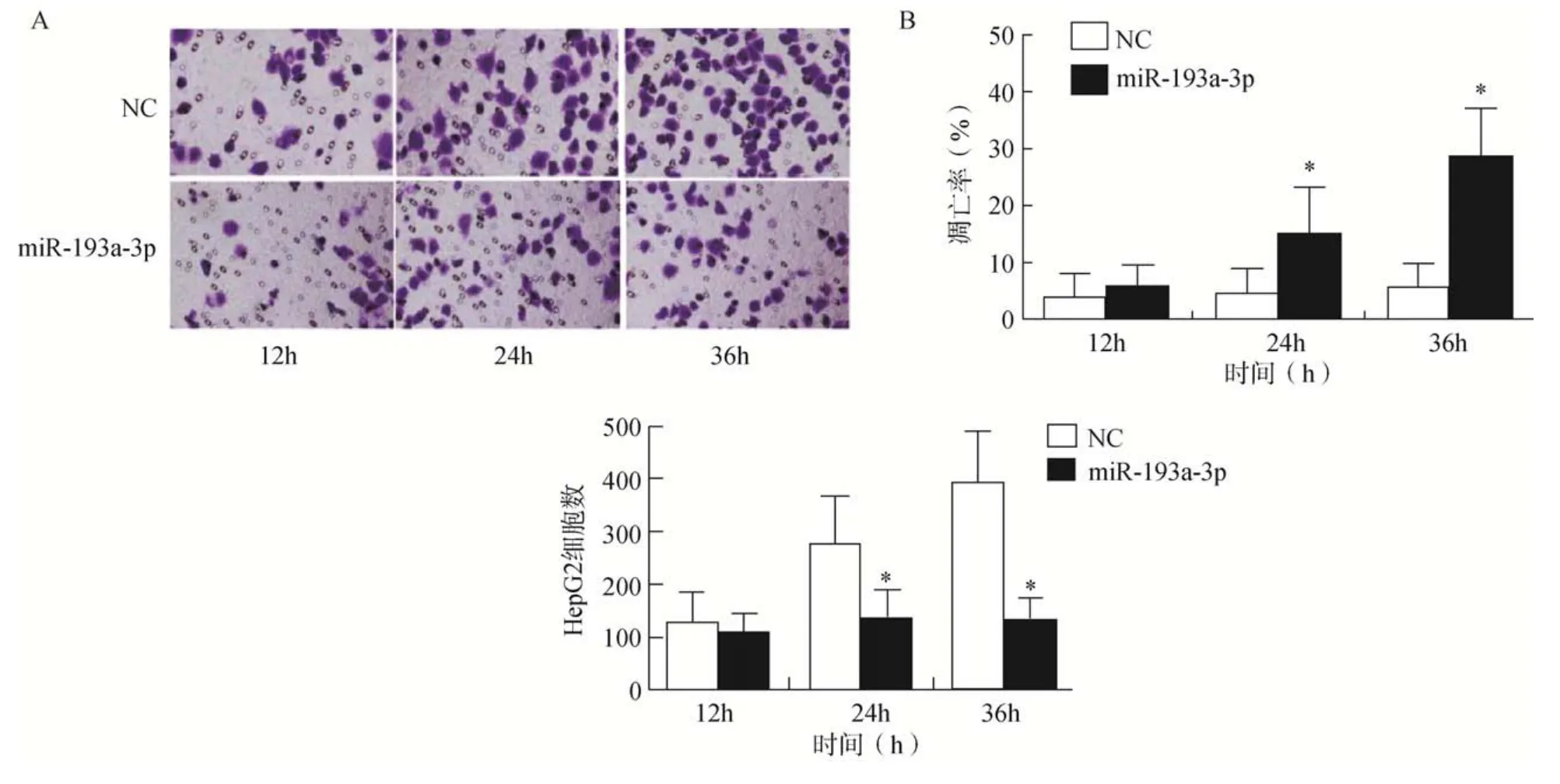
图2 HepG2 细胞的迁移和凋亡检测
表1 两组细胞的增殖活性、迁移及凋亡率比较()
2.3 miR-193a-3p 下游靶标的确定
取TargetScan 与miRDB 两个数据库预测的靶基因交集,进行GO 分析(功能富集分析)和Pathway分析(信号通路分析),结果提示:miR–193a–3p 可能与转化生长因子–β(transforming growth factor,TGF–β)、MAPK 信号通路(mitogen–activated protein kinase,MAPKs)、序列相似家族(family with sequence similarity,FAMs)以及基质金属蛋白酶(matrix metalloproteinase,MMPs)通路有关(表2),其中与TGF–β、MAPKs 通路相关的可能性最大(Pathway分析,<0.0001)。qRT–PCR 结果发现,miR–193a–3p可显著抑制TGF–β2 基因的表达,而对TGF–βR 和MAPK10 通路中预测靶标的影响不大(图3A),提示TGF–β2 可能是miR–193a–3p 的下游靶标:荧光素酶报告系统结果显示:miR–193a–3p 过表达可显著抑制TGF–β2 3’UTR 报告系统的荧光素酶活性(图3B):进一步生物信息学分析显示,miR–193a–3p与靶基因TGF–β2 的互补结合序列在进化上高度保守(图3C)。

表2 miR-193a-3p 靶基因生物信息学分析
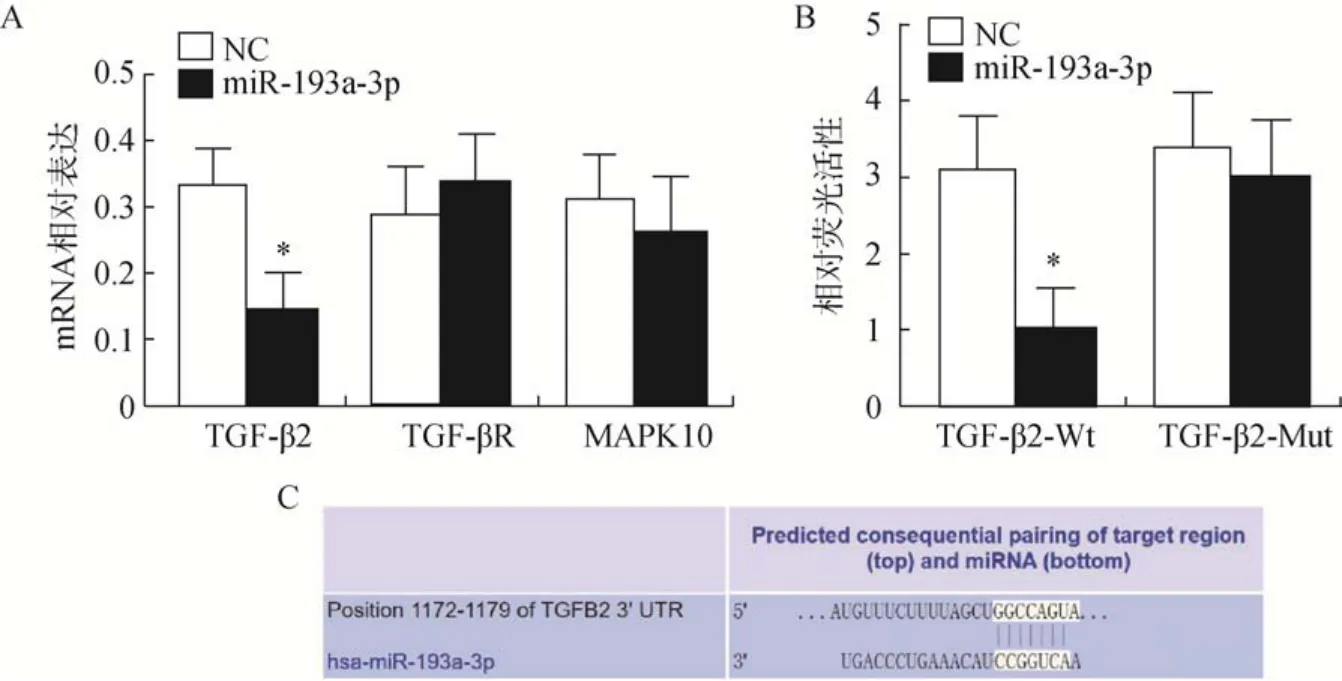
图3 miR-193a-3p 下游靶基因TGF-β2 的确证分析
2.4 miR-193a-3p/TGF-β2 轴对肝癌细胞生物学功能的影响
与miR–193a–3p+空质粒组比较,miR–193a–3p+TGF–β2 组肝癌细胞的增殖活性及迁移数量增多,细胞凋亡率显著减少,差异有统计学意义(<0.05),详见表3 和图4A、图4B。
表3 两组细胞的增殖活性、迁移及凋亡率比较()
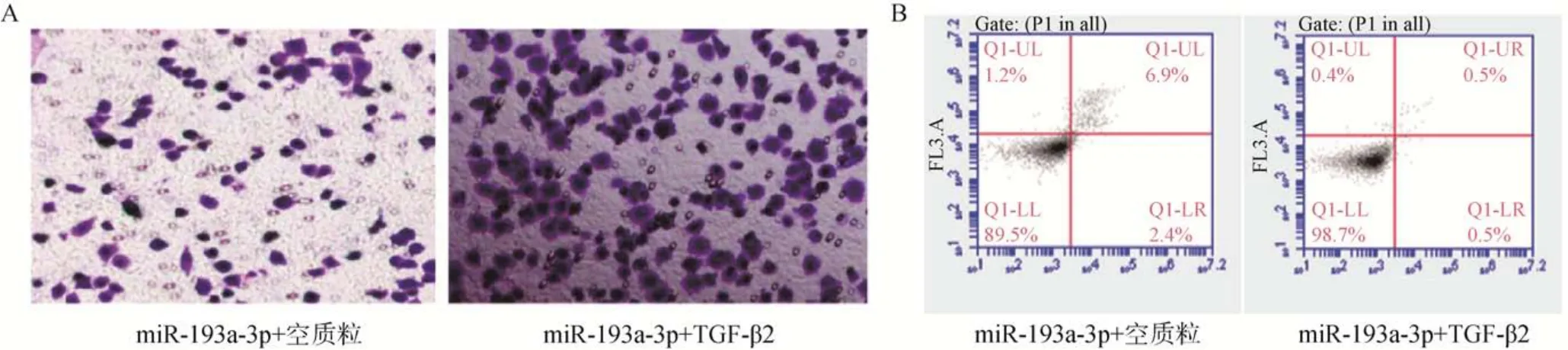
图4 HepG2 细胞的迁移和凋亡检测
3 讨论
miRNAs 为19~26 个核苷酸的短RNA 分子,通过负向调节靶基因的mRNA 表达或直接抑制其蛋白质翻译,参与调控细胞周期、增殖、凋亡和迁移等生理病理过程。肝癌因其病灶血供丰富,癌细胞增殖、迁移、侵袭能力极强,导致肝癌是预后较差的恶性肿瘤,因此,寻找更多肝癌细胞增殖、侵袭、转移的相关靶点对临床肝癌的靶向治疗具有重要意义。研究发现,miRNA 通过靶向与肿瘤细胞周期、细胞增殖有关的基因或与细胞侵袭、细胞迁移有关的基因,参与肝癌的发生、发展、转移及血管生成。如在索拉菲尼耐药的肝癌细胞中上调miRNA–200b,通过靶向调控Ras 同源基因家族蛋白A(rhoA protein,RhoA)的表达,进一步抑制肝癌细胞的侵袭和转移。miR–3188 上调表达于肝癌组织,过度表达的miR–3188通过靶向调控CXCL14调节肝癌细胞的生长和凋亡,有望成为肝癌早期筛查和诊断的分子标志物。过表达miR–1470 通过靶向调控ALX4 基因具有促进肝癌细胞的增殖、抑制肝癌细胞凋亡的作用。本研究结果显示,30 例肝癌组织中miR–193a–3p的表达显著低于癌旁正常组织,且体外细胞功能实验显示:miR–193a–p mimic 抑制HepG2 细胞活性和迁移,同时过表达miR–193a–3p具有显著诱导HepG2细胞凋亡的作用。
有文献报道显示,miR–193a–3p 在肿瘤发生、发展中的作用具有争议性,其在不同肿瘤中发挥着“癌基因”或“抑癌基因”的调节作用,如miR–193a–3p低表达于非小细胞肺癌中,miR–193a–3p 作为肿瘤抑制因子,通过调控p53/Slug/L1CAM 途径抑制非小细胞肺癌的迁移进展:而在对胃癌细胞的研究中显示,下调miR–193a–3p 通过靶向调控PTEN 基因抑制肿瘤的增殖、迁移和化疗耐受效应。但有关miR–193a–3p 与肝癌的研究却报道较少,本研究表明,miR–193a–3p 作为肿瘤抑制因子,具有以时间依赖性方式诱导肝癌细胞的凋亡作用,但其潜在的作用机制仍需要进一步探讨。通过生物信息学分析的方法提示TGF–β2 是miR–193a–3p 的下游作用靶标,文献复习发现,TGF–β2 通过诱导肝癌细胞自噬,抑制ROS 产生,进一步诱导上皮–间充质转化。有文献报道,RALYL 作为肝癌干细胞的特异性基因通过维持TGF–β2 mRNA 的稳定性来调节肝癌干细胞的生物学功能,因此TGF–β2 是肝癌干细胞维持生物学性状的重要基因。本研究显示,TGF–β2 过表达显著反转了miR–193a–3p抑制肝癌细胞的活性和迁移,减少了miR–193a–3p 诱导的HepG2 细胞的凋亡作用。因此,本研究有充分的理由证实,miR–193a– 3p在肝癌细胞发生、迁移和侵袭中作用,是通过靶向TGF–β2 基因的表达而发挥肿瘤抑制功能。
综上所述,过表达的miR–193a–3p 可通过靶向调控TGF–β2 基因的表达,抑制肝癌细胞的活性和迁移,同时具有显著促进肝癌细胞凋亡的作用,因此,本研究为miR–193a–3p 有望成为肝癌靶向治疗的潜在分子靶标提供新的思路和理论依据。
