单侧听觉剥夺对听觉发育关键期小鼠内耳的影响
2022-08-18齐悦于树夔杜政德曲腾飞柳柯龚树生
齐悦 于树夔 杜政德 曲腾飞 柳柯 龚树生
首都医科大学附属北京友谊医院耳鼻咽喉头颈外科(北京 100050)
发育关键期是发育过程的特殊时期,在发育关键期,外界刺激对发育产生的影响远大于其他时期[1]。在听觉发育过程中,环境声刺激是听觉正常发育的重要条件,发育关键期的听觉剥夺对听觉系统发育可产生显著影响[2-4],这种影响在听中枢和外周听觉系统发育中均被发现。听觉剥夺可通过干扰信号传递,导致听觉皮层突触可塑性异常,造成语言感知能力下降[5,6]。双耳听觉剥夺小鼠中也观察到耳蜗毛细胞带状突触数量异常减少,表现为感音神经性聋[7]。
目前研究发现,单侧听觉剥夺可导致表现为剥夺侧的突触减少和未剥夺侧的突触增多,产生双侧中枢听觉系统神经突触的重塑效应[8,9]。然而,单侧听觉剥夺对外周听觉感音系统中突触的影响,以及是否会出现与中枢听觉神经系统类似的、双侧耳蜗突触重塑现象均尚不明确。在本研究中,我们从小鼠出生后12天开始进行听觉剥夺,此时小鼠外耳道刚开始与外界相通,是小鼠出生后听觉发育的关键时期[10,11]。我们通过外耳道填塞、耳廓封闭的方法构建单侧听觉剥夺小鼠模型,使小鼠单侧耳在听觉发育关键期缺少环境声刺激,采用听性脑干反应、免疫荧光染色、激光共聚焦显微镜成像技术,观察单侧听觉剥夺对小鼠双耳听功能、耳蜗带状突触及耳蜗细胞形态的影响,进一步了解听觉剥夺在外周听觉系统的作用机制。
1 材料与方法
1.1 单侧听觉剥夺小鼠模型的构建
对22只出生后12天的C57BL/6小鼠依次编号,通过计算机生成随机数,将小鼠随机分为正常对照组和单侧听觉剥夺组。单侧听觉剥夺组:体视显微镜下将可塑耳塞(McKeon Products,美国)裁剪后,沿外耳道后壁将耳塞插入单侧耳道,胶带粘合或手术缝合封闭耳廓。饲养2周后取出耳塞,解除听觉剥夺。正常对照组:不进行听觉剥夺,饲养2周。本研究经首都医科大学动物伦理委员会批准,小鼠购自北京维通丽华动物公司,动物福利遵照《实验动物护理和使用指南》执行。
1.2 听功能检测
单侧听觉剥夺组的剥夺耳、未剥夺耳和正常对照组采用听性脑干反应(Auditory brainstem response,ABR)评估听功能。腹腔注射ketamine(100 mg/kg)和xylazine(10 mg/kg)进行麻醉,将记录电极插入颅顶正中,参考电极插入测试耳后,接地电极插入对侧耳后。短声(Click)及短纯音(Tone burst)为刺激声,测试频率分别为4、8、12、16、32、40 kHz和 clicks(100 μs),通过 System 3 hardware和SigGen/BioSig software完成ABR给声和记录。
1.3 耳蜗带状突触计数
颈椎脱位法处死正常对照组和单侧听觉剥夺组(每组5只)小鼠,取出听泡,4%多聚甲醛耳蜗灌流,4℃固定过夜。10% EDTA脱钙4 h。将基底膜顶、中、底转浸入含0.3% TritonX-100的PBS,室温30 min,含10%羊血清的PBS封闭1h。小鼠anti-CtBP2单克隆抗体(1:300,Abcam,美国)、小鼠anti-GluR2单克隆抗体(1:300,Millipore,美国)中4℃过夜,PBS清洗后加入对应二抗,避光孵育2h。PBS清洗后铺片,含DAPI抗荧光淬灭封片剂封片。共聚焦显微镜下层扫,层厚0.45um,叠加图像。突触数除以内毛细胞核数即为单细胞平均突触数。
1.4 耳蜗毛细胞形态检测
将耳蜗置于4%多聚甲醛4℃过夜,次日10% EDTA脱钙4h。将基底膜浸入含0.3% TritonX-100的PBS中,室温破膜30 min,含10%羊血清的PBS中封闭1h。PBS清洗后于兔Anti-myosin VIIa多克隆抗体(1:300,Proteus Biosciences,美国)中4℃过夜,清洗后加入对应二抗、Alexa Fluor™647 Phalloidin,室温避光孵育2h。清洗后封片。共聚焦显微镜下观察。
1.5 耳蜗螺旋神经节细胞形态检测
取出听泡,4%多聚甲醛中浸泡固定,4℃过夜。次日将耳蜗置于10% EDTA脱钙液,室温脱钙12h,20%蔗糖脱水4h,OCT包埋剂中浸泡2h。冰冻切片机切片,60℃烤片20min。免疫组化笔画圈,并于含0.3% TritonX-100的PBS中浸泡30min,含10%羊血清+1% BSA的PBS中封闭1h。置于小鼠antibeta Tubulin多克隆抗体(1:500,Abcam,美国)中4℃过夜,PBS清洗后加入相应二抗,避光孵育2h。PBS清洗后铺片,含DAPI封片剂封片。共聚焦显微镜下观察。
1.6 统计学方法
实验数据采用GraphPad Prism 7 software(GraphPad Software Inc,美国)和IBM SPSS Statistics software进行统计学分析。实验数据表示为平均值±标准误(SEM),置信区间设置为95%。采用多因素方差分析(ANOVA)比较多组间差异。P<0.05认为差异具有统计学意义。
2 结果
2.1 单侧气导听觉剥夺对小鼠听觉功能的影响
前期研究证明本研究采用的听觉剥夺方法可使小鼠clicks ABR阈值升高40±1.50 dB SPL,Toneburst ABR全频(4、8、12、16及32 kHz)阈值均升高,在32k Hz阈值升高最为显著。本研究采用ABR对听觉剥夺组(n=5)的剥夺耳、未剥夺耳和相同年龄正常对照组(n=5)小鼠左耳的听功能进行评估。Tone-burst ABR结果显示:听觉剥夺组小鼠的剥夺耳高频听阈升高,呈上升型听力曲线。统计学分析结果示,剥夺耳与对照组小鼠听阈相比较,在8 kHz和12 kHz上两者差异无统计学意义(t=0.95,P>0.05;t=0.72,P>0.05),而在4、16、32和40 kHz上两组间差异均有统计学意义(t=3.34,P<0.01;t=3.84,P<0.01;t=5.76,P<0.001;t=7.19,P<0.001),其中 32 kHz、40 kHz差异更为显著(图1A)。未剥夺耳和正常对照组间各频率听阈无明显差异(图1B)。
Click ABR结果显示:剥夺耳、未剥夺耳和正常对照组听阈分别为41±2.91 dB SPL、27±2.55 dB SPL和30±2.74 dB SPL,剥夺耳和正常对照组间有显著统计学差异(t=2.75,P<0.05),而未剥夺耳和正常对照组间差异无统计学意义(t=0.80,P>0.05)(图1C)。在90 dB SPL给声强度的声刺激下,对ABR波形进行分析,结果示:听觉剥夺组的剥夺耳I波潜伏期延长,和正常对照组相比有统计学差异(t=2.74,P<0.05),而I波潜伏期在未剥夺耳和正常对照组间无明显差异(t=1.24,P>0.05)(图1D)。差异;B.听觉剥夺组剥夺耳和正常对照组间tone-burst ABR平均听阈差异有统计学差异意义;C-D.听觉剥夺组未剥夺耳、剥夺耳和正常对照组小鼠之间click ABR的听阈差异(C)和 I波潜伏期差异(D)。各组 n=5,*P<0.05,**P<0.01,***P<0.001.
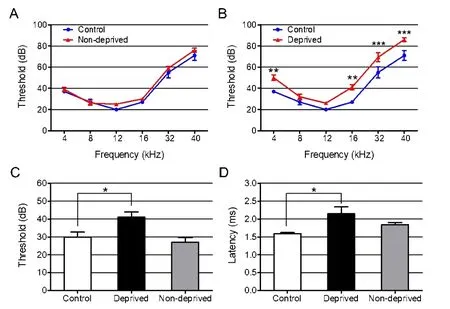
图1 单侧听觉剥夺对小鼠听功能的影响。A.听觉剥夺组未剥夺耳和正常对照组间tone-burst ABR平均听阈无明显Fig.1 The effects of unilateral auditory deprivation on auditory function of mice.A.No significant difference in toneburst ABR threshold was observed between the ears of normal control group and the non-deprived ears in deprivation group;B.Difference in tone-burst ABR threshold was observed between the ears of normal control group and the deprived ears in deprivation group;C-D.Difference of click ABR threshold(C)and difference of I wave latency were observed among ears of normal control group,deprived ears and non-deprived ears of unilateral auditory deprivation group(D).*P<0.05,**P<0.01,***P<0.001.
2.2 单侧气导听觉剥夺对小鼠耳蜗内毛细胞突触的影响
对听觉剥夺组的剥夺耳、未剥夺耳和相同年龄正常对照组(n=5)进行耳蜗内毛细胞带状突触进行免疫荧光标记和统计学分析,免疫荧光抗体anti-CtBP2标记突触前RIBEYE结构,anti-GluR2标记突触后结构(图2)。共聚焦荧光显微镜下见:听觉剥夺耳的内毛细胞突触数量比对照组减少(F=21.74,P<0.05),耳蜗底转差异较为显著,而未剥夺耳和正常对照组的带状突触数量没有明显差异(F=0.39,P>0.05),没有出现和中枢听觉重塑相似的,未剥夺耳突触代偿性增多的现象。

图2 正常对照组和单侧听觉剥夺组小鼠耳蜗带状突触的数量变化。A-C.免疫荧光染色标记正常对照组小鼠的带状突触(A)、单耳听觉剥夺小鼠剥夺耳的带状突触(B)、未剥夺耳的带状突触(C)。Anti-CtBP2标记突触前RIBEYE结构(红),Anti-GluR2标记突触后结构(绿),DAPI标记细胞核(蓝),标尺=10 μm。虚线框示例单细胞突触变化;D-E.各组小鼠耳蜗顶转、中转、底转内毛细胞突触前CtBP2(D)和突触后 GluR2(E)计数的统计学分析。*P<0.05,**P<0.01,***P<0.001。Fig.2 The number of ribbon synapses was measured in cochlea of normal control group and unilateral conduction auditory deprivation group.A-C.The ribbon synapses in ear of normal control group(A),in deprived ear(B)and non-deprived ear(C)of unilateral auditory deprivation group,respectively.Anti-CtBP2(red)marks the presynaptic structure(red),Anti-GluR2 labeled postsynaptic structure(green),DAPI(blue)marks nuclei.Scale bar=10 μm;D-E.The number of CtBP2(D)and GluR2(E)in cochlear apex turn,middle turn,and basal turn was counted in each group,respectively.*P<0.05,**P<0.01,***P<0.001.
2.3 单侧气导听觉剥夺对小鼠耳蜗内毛细胞的影响
共聚焦激光显微镜下观察正常对照组、单侧听觉剥夺组剥夺耳、未剥夺耳(n=5)的耳蜗毛细胞(图3)。毛细胞特异性抗体anti-myosin VIIa标记毛细胞胞浆,Phalloidin荧光染料标记毛细胞纤毛,免疫荧光染料DAPI标记细胞核。结果显示:正常对照组、单侧气导听觉剥夺小鼠的剥夺耳和未剥夺耳的耳蜗毛细胞均细胞完整、纤毛规则、细胞核清晰、胞浆形态正常。各组小鼠耳蜗内毛细胞和外毛细胞排列整齐,无异常的毛细胞丢失出现,各组之间内毛细胞和外毛细胞计数均无统计学差异(F=0.22,P>0.05;F=1.55,P>0.05)。
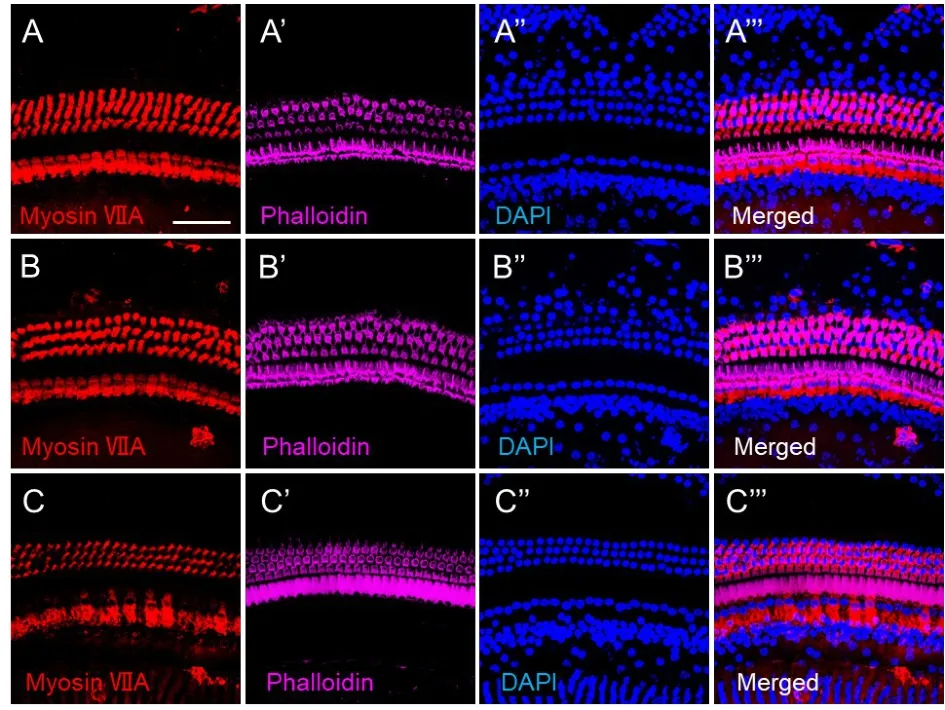
图3 正常对照组和单侧听觉剥夺组小鼠毛细胞的大体形态。A-C.免疫荧光染色检测正常对照组小鼠的毛细胞(AA’’’)、单耳听觉剥夺小鼠剥夺耳的毛细胞(B-B’’’)、未剥夺耳的毛细胞(C-C’’’)。Anti-myosin VIIa标记耳蜗毛细胞的细胞质(红),phalloidin标记毛细胞的纤毛(紫),DAPI标记细胞核(蓝)。标尺=25 μm。Fig.3 The morphology of hair cells(HCs)in cochlea of normal control group and unilateral conduction auditory deprivation group.A-C.The HCs in ear of normal control group(AA’’’),in deprived ear(B-B’’’)and non-deprived ear(CC’’’)of unilateral auditory deprivation group,respectively.Anti-myosin VIIa(red)marks the cytoplasm of HCs,phalloidin(purple)marks the stereocilia of HCs,DAPI(blue)marks nuclei.Scale bar=25 μm.
2.4 单侧气导听觉剥夺对小鼠耳蜗螺旋神经节细胞的影响
共聚焦激光显微镜下分别观察正常对照组、单侧听觉剥夺组剥夺耳、未剥夺耳的耳蜗螺旋神经节细胞(图4)。免疫荧光抗体anti-Tubulin标记螺旋神经节细胞的胞浆,免疫荧光染料DAPI标记细胞核。结果显示:正常对照组、单侧气导听觉剥夺小鼠的剥夺耳和未剥夺耳中,耳蜗螺旋神经节细胞均保持了正常的细胞形态,且未见螺旋神经节细胞缺失、细胞固缩等异常表现。

图4 正常对照组和单侧听觉剥夺组螺旋神经节细胞的大体形态。A-C.免疫荧光染色检测正常对照组的螺旋神经节细胞(A-A’’’)、听觉剥夺组剥夺耳的螺旋神经节细胞(BB’’’)、未剥夺耳的螺旋神经节细胞(C-C’’’)。Anti-Tubulin标记螺旋神经节细胞的细胞质(红),DAPI标记细胞核(蓝色)。标尺=5 μm。Fig.4 The morphology of spiral ganglion cells(SGCs)in cochlea of normal control group and unilateral conduction auditory deprivation group.A-C.The SGCs in ear of normal control group(A-A’’’),in deprived ear(B-B’’’)and non-deprived ear(C-C’’’)of unilateral auditory deprivation group,respectively.Anti-Tubulin (red)marks the cytoplasm of SGCs,DAPI(blue)marks nuclei.Scale bar=5 μm.
3 讨论
声刺激是听觉系统正常发育的必要条件,听觉剥夺对听觉系统发育的影响备受关注[12,13]。发育早期声刺激缺乏可改变听觉中枢对声音的反应和处理[14,15]。长期听觉剥夺会干扰信号传递,使听皮层突触可塑性异常,造成语言感知能力下降[5,6,16]。在中枢神经系统发育期,声-电刺激缺乏可导致中枢神经元凋亡增加[17,18]。发育早期感觉剥夺引起的细胞凋亡的增加并不局限于中枢神经元,外周听觉系统中也证实了毛细胞异常凋亡现象的存在[7]。
耳蜗是感音神经性聋最常见的受损部位,而带状突触是最易受损的耳蜗结构之一[19,20]。前期研究报道:发育关键期双耳听觉剥夺的小鼠,听力学表现为双侧ABR听阈升高和I波潜伏期延长,形态学表现为内毛细胞带状突触数量显著减少;内毛细胞线粒体凋亡与带状突触的持续性异常有关[7]。在前期研究基础上,本研究采用耳塞封闭外耳道,构建听觉剥夺动物模型。这种听觉剥夺方法操作简便、剥夺效果稳定[21]。本研究结果示:发育关键期单耳听觉剥夺也可致听觉异常,尽管这种变化不如前期研究报道的双耳气导听觉剥夺后的变化显著。听力学结果显示单侧气导听觉剥夺可导致小鼠单耳听力障碍,表现为剥夺耳ABR阈值升高和I波潜伏期的延长,而未剥夺耳的听功能未受到明显影响。听觉发育关键期单耳气导剥夺可导致小鼠剥夺耳听功能和带状突触的异常,不会导致剥夺对侧耳的耳蜗突触重塑。同时,单侧听觉剥夺对耳蜗内、外毛细胞及螺旋神经节细胞的大体形态没有明显影响,没有观察到感音神经细胞的异常丢失,也没有出现未剥夺耳的耳蜗细胞代偿性增生或细胞数量代偿性增加。
综上所述,听觉发育关键期单侧听觉剥夺可对小鼠剥夺耳的听功能及内耳形态产生显著影响,这种内耳形态学的改变主要体现为听觉剥夺侧耳蜗内毛细胞带状突触的数量变化。同时本研究也证明,与单侧听觉剥夺导致的听中枢神经突触重塑现象不同,发育关键期单侧听觉剥夺不会导致对侧外周听觉系统突触产生代偿性增多,提示中枢和外周听觉系统在突触重塑功能和机制上存在明显差异。本研究为进一步了解听觉剥夺在听觉系统发育中的影响提供理论支持。
