体外发酵番茄红素的益生元作用
2022-08-17岳云双周晓璐胡小松
岳云双,周晓璐,马 晨,胡小松,陈 芳
(中国农业大学食品科学与营养工程学院 农业部果蔬加工重点实验室 国家果蔬加工工程技术研究中心教育部果蔬加工工程技术研究中心 北京 100083)
人类肠道微生物主要划分为两类,即必需或有益的菌群和易导致机体感染的机会性菌群[1]。这两类菌群以一定比例共同栖息在肠道中,维持肠道内环境的稳态。当两类菌群间的平衡被打破,导致肠道微生态失调时,易引发胃肠道疾病,如溃疡性结肠炎、肠易激综合征和克罗恩病等[2]。除有益菌自身通过竞争性抑制致病菌的生长而维持肠道内环境平衡外,肠道菌群的代谢产物也可参与调节宿主免疫系统的生理功能,如短链脂肪酸(Short chain fatty acids,SCFA)。SCFAs 通过促进肠上皮细胞的增殖,增加黏蛋白的表达,调节氧化应激和免疫调节因子的水平,来保护肠道上皮细胞免遭破坏,从而改善肠道的屏障功能。增加肠道中有益菌群的数量,进而促进肠道SCFAs 的分泌量,对维持肠道内环境的稳态,保障肠道功能具有重要意义。
番茄红素属于不含氧元素的一类类胡萝卜素,其分子式为C40H56,相对分子质量为536.85,纯品为针状深红色晶体,是存在于植物中的一种天然色素,其主要存在于成熟的红色植物果实中,如番茄、番石榴、西瓜等[3]。番茄红素属于直链型碳氢化合物,其分子结构式含有11 个共轭双键及2 个非共轭双键,具有抗炎、抗氧化、抗肿瘤及免疫调节等多种生物活性[4-5]。研究证实,番茄红素对幽门螺杆菌、大肠杆菌、金黄色葡萄球菌等致病性微生物具有明显的抑制作用[6-8]。在小鼠日粮中添加番茄粉,可显著增加肠道菌群的丰富度和多样性,降低梭状芽孢杆菌和黏孢杆菌的相对丰度,缓解高脂日粮诱导的小鼠肝癌[9]。此外,少量研究表明,小鼠或肥胖病人摄入番茄红素后可显著降低变形菌门的相对丰度,增加双歧杆菌属和乳酸杆菌属的相对丰度,缓解小鼠肠炎或肥胖引起的代谢紊乱[10-11]。然而,目前番茄红素的益生元作用研究不足。本研究采用体外模拟肠道微生态体系,研究番茄红素对肠道菌群中益生菌的数量及其代谢产物——SCFAs 产量的影响,为阐明番茄红素的益生元功效提供理论基础。
1 材料与方法
1.1 试验材料
番茄红素(纯度>92%),上海源叶生物科技有限公司。雄性健康C57BL/6J 小鼠(8 周龄),北京维通利华实验动物技术有限公司。所需标准品:乙酸(99.8%)、丙酸(99.8%)、丁酸(99.5%)、异丁酸(99%)、戊酸(99.8%)、异戊酸(98.5%)、猪胰腺胰蛋白酶(1 500 U/mg)、猪胰腺胰酶(8 X USP)、猪胃黏膜胃蛋白酶 (250 units/mg)、猪胃黏蛋白(Type II)、L-半胱氨酸(97%)、2 乙基丁酸(纯度99%),美国Sigma 公司;色谱级甲醇、乙腈,美国Honeywell 公司;3 号胆盐、蛋白胨及酵母提取物,奥博星生物技术 (北京) 有限责任公司;NaCl、K2HPO4、KH2PO4、MgSO4、CaCl2、NaHCO3、乙 醇(无水,分析纯级)、葡萄糖,国药集团化学试剂有限公司(沪试);DNA 提取试剂盒(粪便,DP328),天根生化科技(北京)有限公司;试验所需特异性引物(肠道菌群)由北京擎科新业生物技术有限公司合成。
1.2 试验设备与仪器
LAI-3DT 型厌氧培养箱,上海龙跃仪器设备有限公司;IS-RSD3 台式恒温振荡器,美国精骐有限公司;LightCycler480 II 实时荧光定量PCR 仪,德国Roche 公司;GC-2010 Plus 气相色谱仪、FID检测器、SH-Stabilwax-DA (30 m×0.32 mm×0.50 μm)色谱柱(1575313),日本岛津公司。
1.3 方法
1.3.1 体外模拟胃肠道消化液的配制 体外模拟胃液和肠液的配制参照石梦玄等[12]建立的方法。模拟胃液的配制(1 L):NaCl 3.10 g,KCl 1.10 g,CaCl20.15 g,NaHCO30.6 g,用去离子水溶解并定容至1 L。取100 mL 胃电解液,添加23.6 mg 胃蛋白酶,随后加入1.0 mL 1.5 mol/L CH3COONa 缓冲液(pH=5.0)。室温下磁力搅拌器搅拌10 min,同时用0.5 mol/L 盐酸调节溶液pH 值至2.0。
模拟肠液的配制(1 L):NaCl 5.40 g,KCl 0.65 g,CaCl20.25 g,用去离子水溶解后定容至1 L。按照体积比为1∶1∶2 的比例吸取小肠电解液∶7%胰酶上清液∶4%胆汁盐溶液于离心管中,混合均匀后加入13 mg 胰蛋白酶,搅拌使其充分溶解,随后滴加0.5 mol/L 的NaOH 溶液,调节溶液pH 值至7.0。
1.3.2 发酵液培养基配制 NaCl 0.1 g,K2HPO40.04 g,KH2PO40.04 g,MgSO40.01 g,CaCl20.01 g,NaHCO32.00 g,蛋白胨2.50 g,酵母提取物4.00 g,葡萄糖0.40 g,粘蛋白2.00 g,胆盐0.50 g,L-半胱氨酸0.46 g,Tween-80 2 mL,随后采用去离子水溶解并定容至1 L,并滴加0.5 mol/L NaOH 溶液调节pH 值至7.0,高压灭菌后待用。
1.3.3 粪便菌群悬液的制备 收集小鼠新鲜粪便,根据Ding 等[13]的方法制备粪菌悬液。粪便与无菌PBS 缓冲液(pH 7.0)以1∶9(m/V)的比例混合,搅拌使其混合均匀,涡旋10 min 后,离心(1 000 r/min,10 min),取上层菌群悬液。
1.3.4 体外发酵 取5 mL 模拟胃液于50 mL 离心管中,并加入质量分数为0.2%的番茄红素,振荡涡旋使其充分混匀后,置于37 ℃恒温振荡培养箱(120 r/min),孵育1.5 h 后,加入等体积的模拟小肠液,振荡涡旋充分混匀后,再次置于37 ℃恒温振荡培养箱(120 r/min)继续孵育1.5 h,孵育结束后收集获得番茄红素消化液。随后将番茄红素消化液、菌悬液和混合培养基按体积比1∶3∶6 的比例混合,并置于37 ℃厌氧培养箱,待培养0,3,6,12,24 h 分别取样5 mL,12 000 r/min 离心10 min,分别收集上清液及沉淀保存于-80 ℃待用。不含有番茄红素组为对照组。
1.3.5 菌群数量的测定 采用实时荧光定量绝对定量法测定样品中乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、普氏菌属 (Prevotella)、罗斯氏菌属(Roseburia)、阿克曼氏菌属(Akkermansia mucinipila)、瘤胃球菌属(Ruminococcus)等有益菌数量。采用上述菌种和总菌的相对应特异性扩增引物,构建各菌种的质粒标准品作为扩增模板,利用特异性引物进行实时荧光绝对定量PCR,该反应采用德国Roche 公司LightCycler480 II 实时荧光定量PCR 仪进行测定,利用CT 值计算拷贝数,结果用copies/mL 表示,菌种引物序列见表1。

表1 肠道菌群菌属引物Table 1 Primers used for intestinal microbiota
1.3.6 SCFAs 产量测定 吸取800 μL 上清液并加入50%硫酸溶液200 μL,立即加入1 mL 乙醚,振荡涡旋10 s 后,插入冰盒中静置10 min,随后4℃离心机12 000 r/min 离心10 min,离心结束后轻轻加入CaCl2使其脱水后,吸取上层有机相转移入进样瓶中,再加入质量浓度为5 mg/mL 的内标应用液40 μL (使定位内标的质量浓度达到100 μg/mL),混匀,过膜(尼龙膜0.22 μm),即可上机测定。气相色谱仪中采用SH-Stabilwax-DA(30 m×0.32 mm×0.50 μm) 色谱柱测定乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸的含量,采用外标法计算上述短链脂肪酸的浓度。气相色谱仪参数:氢火焰监测器 (Flame ionization detector,FID),载气为N2,流速:19.0 mL/min,分流比1∶10,空气流速:300 mL/min,H2流速:34.8 mL/min;检测器进样口温度:260 ℃,初始温度:80 ℃(1.5 min),以10 ℃/min 的速度升温至240 ℃,温度达260 ℃保持20 min。进样量1 μL,重复进样3 次。
1.3.7 试验数据分析 所有试验结果均为3 次重复试验所得,并以“平均值±标准差”表示。利用SPSS 20.0 软件进行单因素方差分析,短链脂肪酸产量与肠道菌群数量进行Spearman 相关性分析,P<0.05 为差异显著。
2 结果与分析
2.1 体外模拟肠道发酵体系中番茄红素对菌群数量的影响
由图可知,对照组和番茄红素组经体外发酵后,总菌的数量都明显上升(图1a),表明本研究采用的发酵体系有利于肠道菌群的生长。另外,研究结果显示,随着发酵时间的延长,番茄红素作为发酵底物,不同程度上提高了乳酸杆菌属(图1b)、双歧杆菌属(图1c)、拟杆菌属(图1d)、普氏菌属(图1e)、阿克曼氏菌(图1f)的数量;对罗斯氏菌属(图1g)及瘤胃球菌属(图1h)的检测结果显示,随着发酵时间的延长,无论对照组还是番茄红素组都降低了上述两种菌属的数量,然而番茄红素作为发酵底物,减缓了上述两种菌属数量的骤减,稳定了这些菌属的数量。
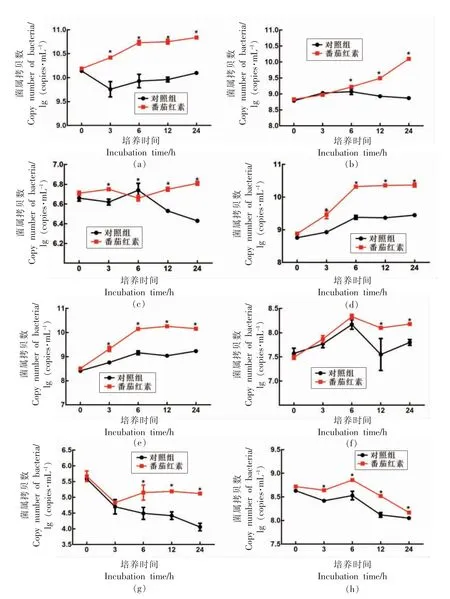
图1 体外发酵后总菌(a)、乳酸杆菌属(b)、双歧杆菌属(c)、拟杆菌属(d)、普氏菌属(e)、阿克曼氏菌拟杆菌属(f)、罗斯氏菌属(g)和瘤胃球菌属(h)数量变化Fig.1 The number of all bacteria (a),Lactobacillus (b),Bifidobacterium (c),Bacteroides (d),Prevotella (e),Akkermansia mucinipila (f),Roseburia (g),and Ruminococcus (h) after the in vitro fermentation
2.2 体外模拟发酵体系中番茄红素对SCFAs 的影响
番茄红素对肠道菌群的代谢产物乙酸的影响如图2a 所示,发酵至6 h 时,乙酸的产量达到最高,且远高于对照组,随后逐渐降低,发酵至12 h时乙酸的产量略低于对照组,然而随着时间的延长,番茄红素再次促进乙酸的产生,至24 h 时,乙酸产量显著高于对照组(图2a)。番茄红素显著促进了丙酸的产生,发酵至12 h 时达到最高 (图2b);丁酸的产量在番茄红素组和对照组中均呈先升高后降低的趋势,且发酵至12 h 时达到最高,而与对照组相比,番茄红素在发酵3 h 时即促进了丁酸的增加,发酵至24 h 时依然维持较高的丁酸产量(图2c);与对照组相比,番茄红素显著促进了异丁酸的产生,且随着发酵时间的延长,异丁酸产量逐渐增加(图2d);发酵0~6 h 期间,番茄红素与对照组中戊酸的产量均呈逐渐降低的趋势,6 h 后,番茄红素显著增加了戊酸的产量(图2e);与对照组相比,番茄红素显著促进了异戊酸的产生,且呈先升高后降低的趋势,发酵至6 h 时,异戊酸的产量达到最高(图2f)。
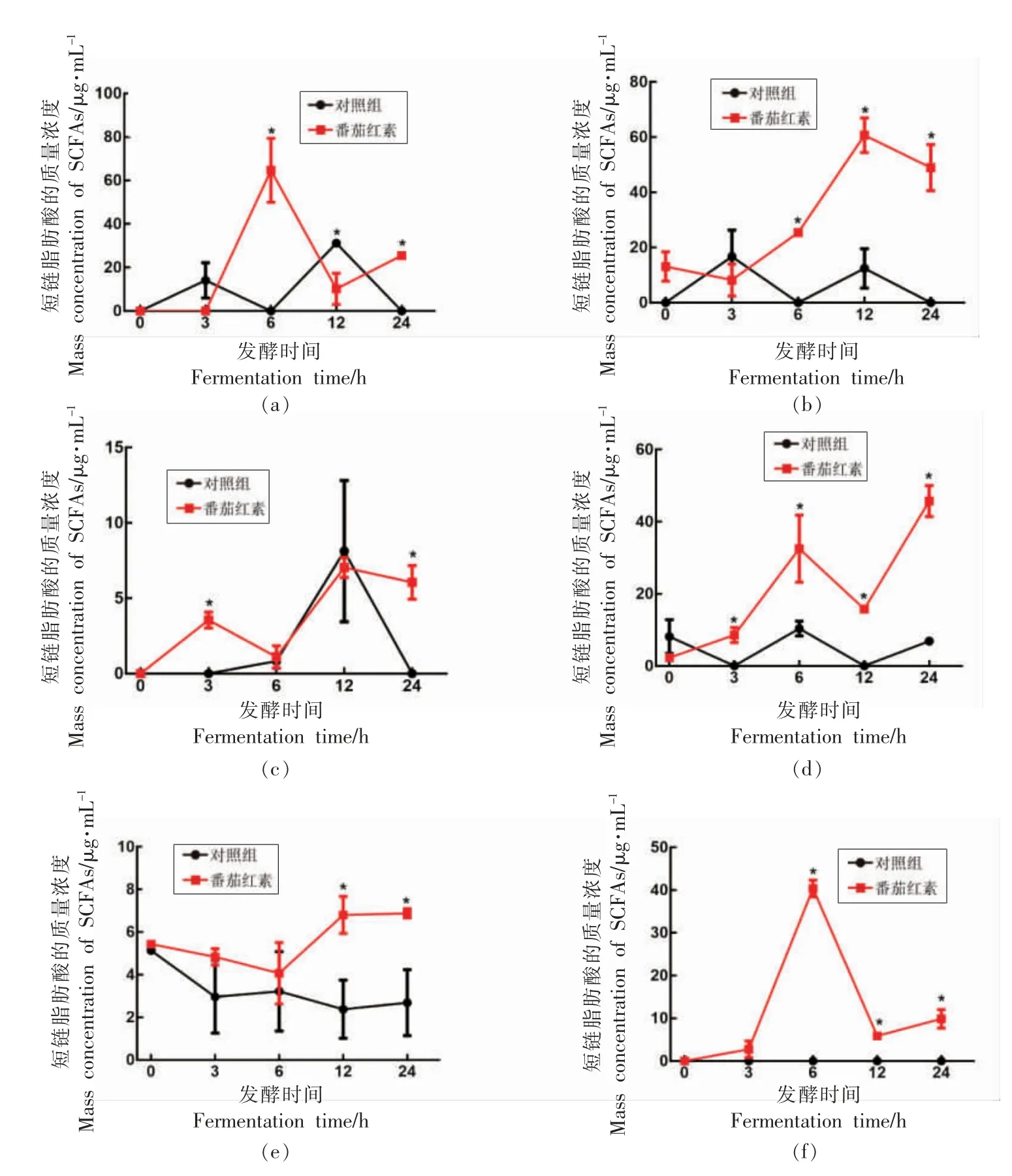
图2 体外发酵体系中乙酸(a)、丙酸(b)、丁酸(c)、异丁酸(d)、戊酸(e)和异戊酸(f)的产量变化Fig.2 The yield change of SCFAs in the in vitro fermentation system acetic acid (a),propionic acid (b),butyric acid (c),iso-butyric acid (d),valeric acid (e) and iso-valeric acid (f)
2.3 体外发酵番茄红素体系中肠道菌群与SCFAs 的相关性分析
由图3可知,SCFAs 产量与肠道菌群数量之间存在相关性,发酵3 h 后,总菌、双歧杆菌、拟杆菌、普氏菌属和瘤胃球菌属的数量与丁酸、异丁酸的产量呈极显著正相关(图3a);发酵至6 h 时,总菌、拟杆菌、普氏菌属和瘤胃球菌属的数量与乙酸、丙酸、异丁酸和异戊酸的产量呈显著正相关(图3b);发酵至12 h 时,总菌、乳酸菌、双歧杆菌、拟杆菌、普氏菌属、罗斯氏菌属和瘤胃球菌属的数量与丙酸、异丁酸、戊酸和异戊酸的产量呈极显著正相关,而上述菌属的数量与乙酸的产量呈极显著负相关(图3c);发酵至24 h 后,总菌、拟杆菌、双歧杆菌、乳酸菌、普氏菌属、阿克曼氏菌属、罗斯氏菌属和瘤胃球菌属数量与乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸产量呈极显著正相关 (图3d)。
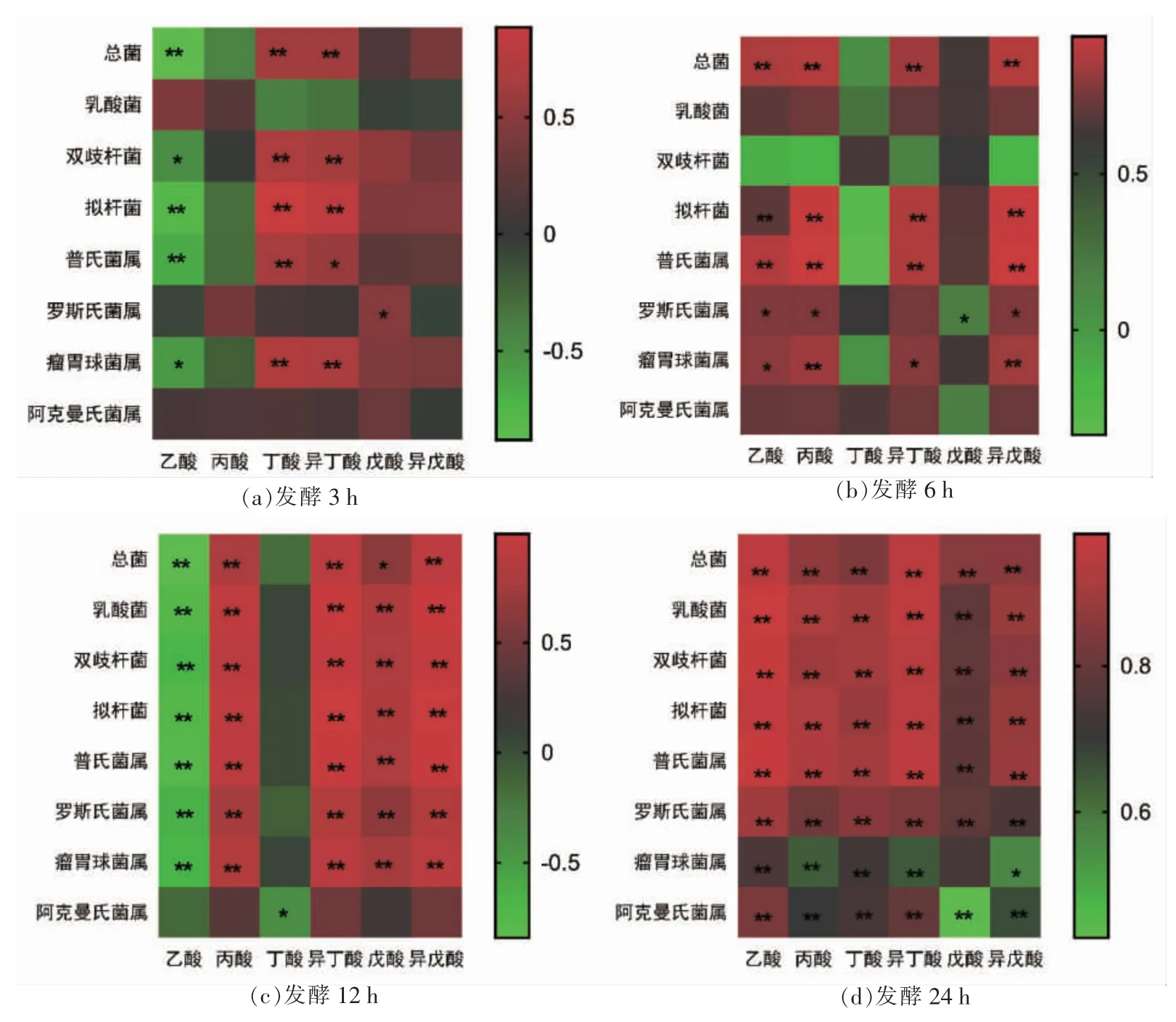
图3 体外发酵各时间点肠道菌群与短链脂肪酸的相关性分析Fig.3 Correlation analysis between short chain fatty acids concentration and microbial flora number at different fermentation time in the in vitro fermentation system
3 结论与讨论
益生元通常是指不可被宿主消化吸收,却可以被宿主微生物选择性地利用,同时赋予宿主健康益处的底物[16]。番茄红素为部分可消化的植物化学物质[17-18],它们可以到达结肠与肠道中微生物群接触。Wiese 等首次发现长期摄入番茄红素后,不仅可以缓解肥胖导致的代谢紊乱,而且可以显著增加双歧杆菌的相对丰度[11]。最近也有学者发现,小鼠灌胃番茄红素后可显著降低变形菌门的相对丰度,增加双歧杆菌属和乳酸杆菌属的相对丰度,从而缓解小鼠肠炎[10]。本研究采用体外发酵体系评价番茄红素的益生元特性,结果表明其能显著提高乳酸菌属、双歧杆菌属、普氏菌属和拟杆菌属的数量,减缓罗斯氏菌属和瘤胃球菌属的减少,显著增加乙酸、丙酸、丁酸、正戊酸、异戊酸等短链脂肪酸的水平,表明番茄红素具有潜在的益生元作用。
双歧杆菌属和乳酸菌属是最常见的有益菌,可缓解氧化应激,增强肠道屏障功能,维持机体的免疫平衡[19-21]。一方面它们可抑制有害菌和病原体的数量,另一方面通过刺激肠道局部和全身免疫反应来维持肠道内环境的稳态,从而保障了宿主健康。越来越多的研究发现,炎症性肠病的发病与肠道双歧杆菌数量减少有关,增加肠道中双歧杆菌数量有助于治疗轻中度炎症性肠病[22]。另外,双歧杆菌还可利用单糖或低聚糖等代谢产生乙酸[23]。乳酸菌可通过其分泌的代谢物,如有机酸、细菌素等抑制致病菌的生长,降低有害菌感染引起的炎症反应。目前,针对治疗胃肠道病原菌的乳酸菌制剂也已经投入使用,如防治大肠杆菌、沙门氏菌及李斯特菌等引起的感染。另外,乳酸菌还可通过调节丝裂原活化蛋白激酶(Mitogen activated protein kinases,MAPK)信号通路,增加紧密连接蛋白的表达,进而改善肠道屏障功能[19-20]。罗斯氏菌属和瘤胃球菌属均可利用单糖或多糖产生乙酸、丙酸和丁酸等短链脂肪酸[24-25]。并且最新研究证实,瘤胃球菌在抑制I 型糖尿病中具有重要作用。I 型糖尿病患者肠道中瘤胃球菌数量减少,且CD8+Treg 细胞的数量较健康人群更低,而补充瘤胃球菌后,CD8+Treg 细胞数量增加,抑制了链脲霉素诱导的I 型糖尿病的发生[26]。普氏菌属和拟杆菌属可分解多种碳水化合物,产生琥珀酸等物质,并通过肠道的糖异生作用,改善胰岛素抵抗和葡萄糖不耐受等疾病[27],另外它们还可分解碳水化合物产生乙酸和丙酸[28],乙酸又可作为底物促进合成丁酸[29]。近几年的研究证实,阿克曼氏菌属也是人类肠道菌群中重要的成员之一,占人类肠道菌群的1%~5%。研究者还证实,在肥胖和糖尿病人粪便中阿克曼氏菌属的丰度显著降低,而添加阿克曼氏菌属活菌可以抑制高脂饮食(HFD)导致的肥胖和肠道屏障功能破坏[30]。此外,阿克曼氏菌还能够特异性的利用肠道中粘蛋白,而改善肠道屏障功能,被称为潜在益生菌[31]。
大量研究已确定了SCFAs 的关键作用,其不仅作为肠道的能源物质为肠道提供能量,促进肠道细胞的增殖,提高肠道的屏障功能,而且在参与调节机体外周免疫功能,抑制炎症反应,调节肥胖机体的炎症反应水平等方面发挥重要作用[32]。SCFAs 还可介导共生菌群与免疫系统之间的通讯,如调节结肠调节性T 细胞-Treg 细胞的数量及功能,来维持机体促炎及抗炎机制的平衡,进而保护机体免受肠道炎症的侵害[33]。此外,SCFAs 还可通过改变引起肠道癌症的基因表达和转录作用,来抑制癌细胞的增殖和迁移,进而抑制肠道癌症[34]。本研究发现,随着发酵时间的延长,SCFAs的产量与肠道菌群的数量相关性呈逐渐增加的趋势,至发酵24 h 时,SCFAs 的产量与肠道菌群的数量呈极显著正相关,表明番茄红素或可通过增加益生菌及其代谢产物-SCFAs 的产量,进一步在肠道疾病干预中发挥作用。
虽然体外发酵体系结果还有待于动物实验的进一步验证,但最新研究显示,肥胖病人或肠炎小鼠食用番茄红素1 个月或40 d 后,肠道菌群中的双歧杆菌属和乳酸杆菌属相对丰度显著增加[10-11]。这意味着体外发酵体系的结果在一定程度上可用于评价其在体内对菌群的调节作用。总之,番茄红素作为发酵底物可以通过增加产SCFAs 菌属的数量进而促进SCFAs 的产生,来发挥其益生元功效,这将为番茄红素用于改善肠道屏障功能,治疗肠道炎症等疾病提供科学依据。
