大鼠脑外伤后星形胶质细胞及血清中相关蛋白随时间表达变化研究
2022-08-17史文哲罗文哲宋汉君李国良王星凯盛延良
史文哲,罗文哲,宋汉君,李国良,王星凯,蔡 玉,盛延良
(1.佳木斯大学基础医学院 黑龙江省微生态-免疫调节网络与相关疾病重点实验室,黑龙江 佳木斯154000;2.潍坊医学院附属医院,山东 潍坊 261000)
弥漫性脑损伤(Diffuse brain injury,DBI)是一种闭合性脑外伤,是由交通事故、机械性暴力、摔跌及体育活动所引起的突发性创伤,其致残率及致死率均较高。随着法治观念的进步,人们的维权意识也在不断增强,加之脑组织自身结构及功能的复杂性,使得脑损伤的治疗一直以来都是临床中的重点及难点问题[1]。DBI可造成即时性损伤和随后病理生理过程中的延迟性损伤[2]。即时性损伤包括神经元、弥漫性轴索损伤、血管破裂等,继而发生广泛的神经炎症、氧化应激、细胞凋亡及星形胶质细胞功能障碍介导的继发性损伤[3]。星形胶质细胞(Astrocytes,AS)在中枢神经系统(Central nervous system,CNS)中含量丰富,近期基于神经退行性疾病的研究,有学者提出幼稚星形胶质细胞在受到刺激后也会分化为不同表型,即神经毒性反应性星形胶质细胞(A1s)和神经保护性反应性星形胶质细胞(A2s)[4-5],并确定了各自的特异性标记物,即一种名为C3的补体成分(使用C3裂解产物C3d抗体标记)和S100A10[5]。两种不同分型的星形胶质细胞在脑损伤后不同时间节点表达,并发挥不同的作用。既有破坏性作用又有修复作用,这一概念取决于疾病的时间进程[6]。明确其在损伤后不同时间节点的表达变化,以期为法医学中脑损伤的时间推断及临床治疗提供借鉴。
1 材料与方法
1.1 实验试剂 小鼠抗GFAP单克隆抗体(K200067),兔抗C3d多克隆抗体(430A-74-RUO),兔抗C3d多克隆抗体(K109325P),TritonX-100、驴正常非免疫血清(SL034),Cy3标记的驴抗兔IgG,DAPI,抗荧光衰减封片剂(S2100),FITC标记的驴抗小鼠IgG(D110081),大鼠神经胶质纤维酸性蛋白(GFAP)ELISA试剂盒,大鼠C3d ELISA试剂盒。
1.2 实验动物分组与模型制作 健康SPF级Sprague-Dawley(SD)雄鼠48只,8周龄,体重(250±20)g,购自佳木斯大学实验动物中心。将大鼠随机分为正常对照组(Control组)和DBI后4、8、12 h及1、3、5、7 d组(n=6)。采用改良的Marmarou方法[7]制造大鼠DBI模型,使打击头对准大鼠两耳与两眼水平连线的中点。待大鼠稍清醒时(有刺痛反应),使用500 g砝码自1 m高度从透明PVC管中自由落体落下。Control组除麻醉外,不作任何处理。采用Longa评分法[8]评定动物神经功能缺损程度,模型建立后选取评分2~3分(共4分)的中型脑损伤大鼠进行下一步实验。操作完成后清洁消毒笼具并做好标识,及时观察、记录动物的生命体征变化。此过程中因不符合Longa评分标准或各种原因造成的动物死亡,均按照原标准进行补充。
1.3 动物组织取材 在预先设定的时间点进行麻醉,取心血置于促凝管后,断头取脑;所有大鼠处死取出全脑后一分为二,一半迅速取海马组织于冻存管中,置于-80 ℃冰箱备用;另一半置于10 %中性甲醛中固定约48 h,用于HE及免疫荧光染色。促凝管放置1 h后,经1000 g离心10 min,取上清液分装,保存于-80 ℃冰箱中备用。
1.4 免疫荧光双重染色 GFAP/C3d、GFAP/S100A10进行免疫荧光双重染色,观察海马 GFAP+、C3d+、S100A10+细胞表达变化。以GFAP+C3d+双阳性细胞代表A1s,以GFAP+S100A10+双阳性细胞代表A2s。脑组织切片经脱蜡水化、微波热修复、1%TritonX-100透膜后,用10%驴血清封闭,随后滴加相应一抗,稀释浓度如下:GFAP(1∶300)、C3d(1∶100)、S100A10(1∶200),GFAP/C3d、GFAP/S100A10混匀后分别滴加于切片,4 ℃孵育过夜。次日取出湿盒恢复至室温后,滴加FITC(1∶200)与Cy3(1∶300)混匀液,与暗盒中室温孵育1 h,用DAPI染色液进行细胞核染色。用防淬灭封片剂封片,最后指甲油封固,置于荧光显微镜下观察。以抗体稀释液代替一抗作为空白对照。
1.5 酶联免疫吸附实验(ELISA) 将血清从-80 ℃冰箱中取出,解冻回温。将试剂盒从-4 ℃冰箱中取出,静置30 min。此期间将20倍浓缩洗涤液稀释20倍备用。根据操作步骤稀释原倍标准品,加样:分别设置空白对照孔(不加样品及酶标试剂,其余步骤相同)、标准孔、待测样品孔。在酶标包被板上准确加标准品50 μl(样品稀释度为5倍)。温育及洗涤、加酶(空白孔除外),再次温育洗涤后,37 ℃避光显色15 min后终止反应,此时液体由蓝色转为黄色。终止后立即进行测定,以空白孔调零,450 nm波长测量各孔吸光度(OD值)。测量并计算结果:每个样本设置3个复孔,使用Excel绘制标准曲线并进行数据分析,并使得到的标准曲线回归方程r≥0.9900,将样品OD值代入方程式计算样品浓度,再乘以稀释倍数5,即得到样品实际浓度。

2 结 果
2.1 大体观察 实验组大鼠可见头皮下、帽状腱膜下出血,颅脑未见骨折,大脑实质表面可见蛛网膜下腔、脑组织腹侧面少量出血,脑组织肿胀充血,未见局灶性脑挫伤及挫裂伤。Control组大鼠未见明显异常。
2.2 HE染色 选取丘脑中1/3切面做连续切片、HE染色,分别观察Control组及实验组各分组大鼠脑皮层及深部脑组织形态学变化。结果示:Control组大鼠脑组织结构完整,细胞层次清晰,海马区锥体细胞规则排列,胞体呈圆形或锥形分布,胞核淡蓝染色,未见水肿及坏死的神经细胞。实验组大鼠与Control组大鼠相比,脑组织出现不同程度损伤,大脑、小脑、脑干可见局部蛛网膜下腔出血,蛛网膜下腔散在分布大量红细胞,并伴有少量炎细胞反应及纤维蛋白渗出,部分伴有局灶性浅表性脑挫伤,侧脑室、脑室内脉络丛也可见出血并伴少量炎细胞浸润。部分实验动物在大脑皮质、皮质下脑白质、脑干、小脑及近海马回区脑实质内可见散在性分布的点、灶状脑挫伤出血,挫伤灶周围伴炎性细胞反应,小胶质细胞反应性增多,并可见噬神经细胞现象和卫星现象。挫伤灶及海马周围还可见不同程度神经元变性,并可见不同程度神经细胞坏死,锥体细胞结构紊乱,排列疏松,神经元细胞数量减少,细胞周围间隙增宽,并可见蛋白水肿液。以上结果表明,大鼠脑组织损伤后具有DBI特征,且DBI后12 h海马回区神经元变性开始明显,以1 d左右最为显著,细胞核固缩深染,胞浆嗜酸性增强,甚至出现胞膜破裂、细胞解体消失,细胞、小血管周围间隙显著增大,DBI后3 d组神经元坏死减轻,水肿减轻,7 d时逐渐恢复。
2.3 各组脑组织中A1s、A2s细胞表达比较 分别以GFAP+C3d+/GFAP+、GFAP+S100A10+/GFAP+阳性细胞率代表A1s、A2s的表达,免疫荧光检测结果提示,与Control组相比,A1s 在DBI 4 h后表达增多,此后呈上升趋势,1 d左右达高峰,随后下降;正常大鼠脑组织中星形胶质细胞大部分以A2s形式存在,DBI后4 h表达减少,1 d左右其表达最低,随后逐渐升高,各组比较差异均有统计学意义(均P<0.05)。见表1。
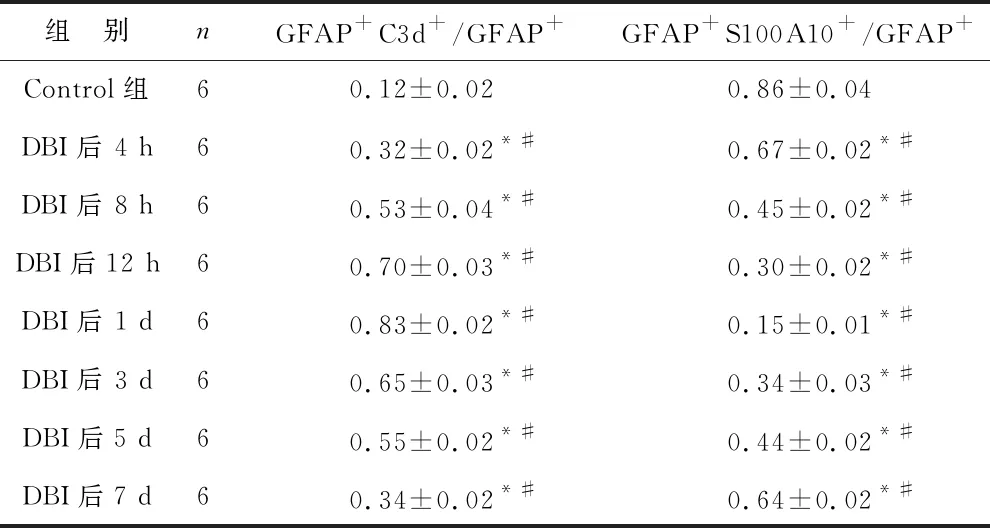
表1 大鼠海马组织中A1s、A2s细胞表达比较(%)
2.4 ELISA实验 ELISA实验检测血清中GFAP、C3d蛋白浓度,结果示:DBI后4 h,两者浓度均升高,此后呈上升趋势,于DBI后1 d表达呈现高峰,后逐渐下降,7 d时浓度仍明显高于Control组;而S100A10在DBI 4 h后也呈上升趋势,3 d左右达高峰,后逐渐下降,DBI后7 d仍高于Control组,差异均有统计学意义(均P<0.05)。见表2。
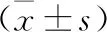
表2 大鼠DBI后血清中GFAP、C3d、S100A10浓度比较
3 讨 论
GFAP为星形胶质细胞的标志性蛋白,有学者提出,敲除GFAP基因或抑制其相关信号可促进神经发生。并通过实验证明,缺乏GFAP和波形蛋白的小鼠发育正常,且在脑外伤后神经发生和轴突均增多[9]。尽管GFAP对星形胶质细胞的激活和在急性应激情况下是必不可少的,这可能是由于GFAP基因缺失时,未定位的神经前体细胞的分化向神经元分化方向倾斜的缘故。最近,李炳譞等[10]通过免疫荧光技术观测了A1s在大鼠脑挫伤模型中的表达,并分析了其表达时间及树突的数目、长度及复杂程度等形态学变化,该实验表明A1s在脑挫伤后3 d开始出现,7 d达高峰,随后逐渐下降;何芳等[11]应用免疫组化法观测大鼠重型脑挫伤模型,伤后1 h GFAP+细胞表达增加,至伤后7 d达高峰;吴茂旺等[12]通过对大鼠DBI模型的研究发现,GFAP于伤后6 h开始增加,随时间进展GFAP+细胞数量增加、范围扩大,4 d左右达高峰;本实验通过免疫荧光实验表明,DBI后4 h,大鼠海马区域GFAP+细胞数量开始增加,1 d后达高峰,此后呈下降趋势。ELISA实验表明,血清中GFAP表达趋势与免疫荧光相同。之所以出现上述时间表达的差异,可能是由于损伤模型、损伤程度及实验观察区域选取的不同所致。
早期的一些关于人类、动物模型的研究表明,A1s是阿尔兹海默病、多发性硬化症等神经退行性疾病中主要的星形胶质细胞亚型[5],考虑到上述原因,我们选取8周龄大鼠作为实验对象,避免大鼠年龄产生的影响。后期有实验证明A1s在头部创伤中起重要作用[13]。研究显示,在创伤性脑损伤患者中,神经毒性补体蛋白在星形胶质细胞来源的外泌体中表达增多,这些补体蛋白会导致突触和神经元损伤[14]。重要的是,CNS损伤后A1s可被迅速诱导产生,并使得CNS的神经元及少突胶质细胞迅速死亡。
星形胶质细胞在疾病或损伤后被激活,分化为A1s、A2s两种表型,近期有通过缺血性脊髓损伤模型证明,给予适当的治疗干预,可以使星形胶质细胞由A1s转化为A2s,从而有利于损伤的修复。然而,本实验通过通过C3d+/GFAP+和S100A10+/GFAP+免疫荧光双重染色对A1s、A2s的表达进行验证,A1s、A2s均呈单峰表达模式,且趋势相反,在致伤后1 d左右表达分别达到峰值和谷值。表明在脑组织损伤前期,A1s占据主要优势,对颅脑损伤后炎症起到一定促进作用,从而使损伤程度加重。在损伤后1 d左右,两者达到各自峰值,此后A2s又表现出升高趋势,而A1s降低,此后A2s则占据优势,在抗炎和损伤修复方面起到一定作用,因此,根据以上可大致对损伤时间做出推断,当表达数量A1s>A2s时,损伤时间在1 d内,当A1s 而血清中的含量与海马组织中趋势则不同,DBI 4 h后呈上升趋势,3 d左右达高峰,后逐渐下降,DBI后7 d仍高于Control组。这可能是由于,S100A10在星形胶质细胞中含量较高,DBI后S100A10通过受损的血脑屏障或通过脑脊液循环入血,使得血液中S100A10浓度升高。目前已经在多种疾病,如癌症、精神疾病和神经变性等,均发现S100A10表达异常,并通过数据表明,血液中S100A10浓度具有生物标志物的潜力[15]。本研究通过检测血清中S100A10也发现其在DBI后表达异常,且随时间表达呈先降低后升高的趋势,具有一定规律性。因此,其在DBI中损伤时间推断中具有一定潜力,今后还应探索其表达与患者预后是否存在相关性。 对于颅脑损伤,学者们已通过多种方法探索其治疗对策,尤其是对脑损伤后的炎性反应。其中包括中医针灸法对相关穴位进行干预,使得脑损伤模型大鼠的神经功能及炎性反应得到明显改善[16],并且可通过影响PI3K/AKT通路关键蛋白,发挥对脑损伤的治疗作用[17]。此外,最近还有研究称,参芍口服液、益生菌等均可抑制脑损伤后的炎性反应[18-19]。益生菌对脂多糖诱发大鼠脑内神经炎症及认知功能障碍具有保护作用,脂多糖可诱导神经炎性A1s的分化,因此,益生菌可能会通过改善颅脑损伤病人肠道菌群,从而促进脑损伤的修复[18]。我们已知,脑损伤后的炎性反应在脑损伤后修复过程中发挥重要作用,因此,通过损伤时间的推断,可了解炎性反应的时间,并有助于医务人员在恰当时机采取相应治疗措施。 该实验存在不足但也在意料之中的是,C3的补体成分C3d并不是A1s的一个完全特异性的标记物,偶尔也可在神经元中发现,同样,S100A10也同样如此。因此我们通过C3d与GFAP的免疫荧光双重染色来纠正这个问题,以GFAP+C3d+双阳性细胞作为A1s,以GFAP+S100A10+双阳性细胞作为A2s。我们知道,C3d是C3的补体成分之一,因此,还有实验证明,通过C3和小胶质细胞标记物CD68进行免疫荧光双重染色,并未发现两者共存的细胞,因此,这降低了C3存在于小胶质细胞的可能性[20]。并且,通过形态学,我们观测到C3d+细胞和S100A10+细胞在很大程度上与星形胶质细胞相似。接下来的任务,可能需要通过更多的标记物来识别不同分型的星形胶质细胞,以增加其确定性,并且应从多方面加以考虑,包括转录组、蛋白质组、形态学和特定的细胞功能,并证明不同的物质对病理特征的影响。 虽然目前刺激和导致星形胶质细胞反应性和转化的潜在机制仍不清楚,但通过检测脑组织中A1s、A2s的表达变化,可对早期脑损伤时间的推断起到一定作用。在临床中GFAP有利于判断脑损伤程度及预后,在法医学中,通过检测血清、脑脊液中GFAP也是判断致死性脑外伤及推断损伤时间的重要生物学标志物[21-22],且与其他生物标志物联合使用时,可进一步提高准确性[23]。通过检测血清中GFAP、C3d、S100A10得知,C3d、S100A10在血清中变化幅度均较GFAP明显,且以C3d为甚。因此,是否可将上述指标应用到临床案例中,早期及时监测两者动态变化,并联合临床中影像学、电生理学等资料,为判断脑外伤的损伤程度及预后提供一定依据。
